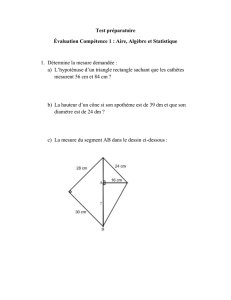
ACIDES AMINÉS H3N+ C COO– R α

ACIDES'AMINÉS!
!
Définition !"!#$%!&&!%'()!#$%!*'#+,-#$%!.$!/0%$!,'(%)1)-0()!#$%!23')+1($%4!
!
Structure-des-AA !!"!
-($!203)1$!,'**-($!5!)'-%!#$%!&&6!07$,!#$%!8,)'!amine-IR-(NH2!/0%19-$)-$)!carboxyle-(COOH-0,1.$:!3$#1+$%!0-!;!α4!
#0!chaîne'LAT-!<'-!30.1,0#:!"!spécifique!.$!,=09-$!&&6!.+)$3*1(0()!%$%!23'231+)+%!,=1*19-$%!
!
22!&&!%'()!protéinogènes!>!3$23+%$()+%!.0(%!#$!,'.$!?+(+)19-$!⇔!$()30()!.0(%!#0!,'*2'%1)1'(!.$%!23')+1($%4!
!@$%!0-)3$%!&&!%'()!('(!23')+1('?A($%-
8!&&!%'()!essentiels->!($!2'-70()!B)3$!%C()=+)1%+%!20%!#D'3?0(1%*$4!!Leu!Thr!Lys!Trp!Phe!Val!Met!Ile!
!
E'#031)+!"!$##$!7031$!$(!8'(,)1'(!.$!#0!,=0F($!@&G!"!2'#013$!<1'(1%0/#$%!'-!('(:!⇔!&&!%'#-/#$!H!'-!02'#013$!⇔!=C.3'2='/$!
!
Les-aa-peuvent-subir-des-modifications !!!
!!
IJ&;GKLM!
Exemple!
Phosphorylation-%-3!#$%!,=0F($%!#0)+30#$%!.$!S,-T,-ou-Y-
!
!
N+31($!!!!!!!!!!!!!!!!!!!!!E='%2='O%+31($!
Carboxylation-
!
P#-)0*0)$!!!!!!!!!!!!!!!!!!γ‐carboxyglutamate-
Q!pince-à-Ca++-R!.0(%!#$%!23')!.D'%%18'!<'%)+',0#,1($:!
Décarboxylation-
'(!'/)1$()!.$%!amines-biogènes-(neurotransmetteur)!!
!
!!!!!!!!!!!!!!!!!!S1%)1.1($!!!!!!!!!!!!!!!!!!!!!!!!!!!!!=1%)0*1($!<!0##$3?1$:!
!
!!!!!P#-)0*0)$!!!!!!!!!!!!!!!!!!!!!!!!!!γO0*1('/-)C319-$!<GABA)!
N‐glycosylation-%-3!#$%!,=0F($%!@&G!.$!N-et-Q-
!
O‐glycosylation!%-3!#$%!,=0F($%!@&G!.$-S-et-T-
!
Désamination-
'(!'/)1$()!.$%!α‐céto-acide-
-
Glutamate----------------------α‐cétoglutarate!
Hydroxylation!
T!'-!UO=C.3'VC!proline!!!!!!$)!!!!!!WO=C.3'VC!lysine-
,'(%)1)-0()%!.-!collagène-
!
!
X+8!"!-(! C-est-asymétrique-(*) !!%D1#!$%)!3$#1+!5!U!?32$*$()%!différents!<!P#C!(D0!20%!.$!;!0%C*+)319-$:!
@$!C!asymétrique!(*)!2$3*$)!.D$V2#19-$3!Y!23'231+)+%!KMXJEZMX&MGZN!"!
• +(0()1'*A3$%!"!#$%!&&!$V1%)$()!%'-%!#0!8'3*$!.$!Y!configurations- (L-et-D)-1*0?$%!#D-($!.$!#D0-)3$!.0(%!-(!
*13'13!*01%!('(O%-2$32'%0/#$%4!!!!!!Eucaryote-"!00!.$!#0!%+31$!@4!!!!!!Ex!:!L‐alanine!et!D‐alanine!!!
• 2'-7'13!3')0)'13$!<22!'2)19-$:!"!#$%!&&!.+71$()!#0!#-*1A3$!7$3%!#0!?0-,=$!<>!LEVROGYRE:6!'-!7$3%!#0!.3'1)$!
<>!DEXTROGYRE:4!!!!!Y!+(0()1'*A3$%!'()!-(!2'-7'13!3')0)'13$!opposé------------------------------------------- -
-!&[;[M!#1$(!$()3$!#+73'?C3$\.$V)3'?C3$!$)!#$%!%+31$%!@\X!!
!
Absorption-dans-l'UV !"!TOUS!#$%!&&!0/%'3/$()!.0(%! #DUV!<Y]^!(*:4!@$%!&&!03'*0)19-$%!<_6!`6!a:!23+%$()$()!en!
plus!-(!21,!.D0/%'32)1'(!5!Yb^!(*4!!
!
Propriétés-acido‐basiques !!
G'-%!#$%!&&!2'%%A.$()!au!moins!Y!%1)$%!1'(1%0/#$%!<]!0,1.$!$)!]!/0%19-$!⇔!amphotère:!"!!
!COOH!0,1.$!<2c0!d!Y:!9-1!2$3.!-(!Se!%1!2S!f!2c0!
!NH2!/0%19-$!<2c0!d!g6h:!9-1!,02)$!-(!Se!%1!2S!i!2c0!
!!!!!!!j!pH-physiologique!<2S!>!k:6!,$%!Y!8'(,)1'(%!%'()!ionisées!
! ! A!pH!très!acide!l’AA!est!chargé!+!;!à!pH!très!basique!l’AA!est!chargé!–!
@$%!&&!9-1!2'%%A.$()!-($!chaîne!LAT!ionisable!'()!-(!2c0!%-22#+*$()013$!"!
!S6!I6!c!</0%19-$%:!,02)$()!-(!23')'(!9-0(.!#$!2S!$%)!0%%$l!0,1.$!<i!0-!2c0:!
! X6!Z!<0,1.$:!2$3.$()!-(!23')'(!9-0(.!#$!2S!$%)!0%%$l!/0%19-$!<f!0-!2c0:!
!
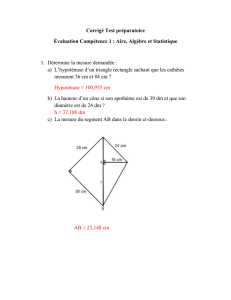
Quand!!pH!=!pK!<#0!8'(,)1'(!$%)!1'(1%+$!5!W^m:6!#$!2S!varie-très-peu!*0#?3+!#D0n'-)!.D0,1.$!
'-!.$!/0%$!"!,D$%)!-($!zone-tampon!<?31%+$!%-3!#0!,'-3/$:!
!!
@$!point-iso‐électrique-(pHi)!$%)!#$!2S!2'-3!#$9-$#!#D&&!0!-($!charge-nette-nulle-H!0-!2S1!#0!%'#-/1#1)+!$%)!#0!e!801/#$!
MÉTHODE!DES!BOLS!
Pathologie !!
!E=+(C#,+)'(-31$!"!0,,-*-#0)1'(!.$!F!$)!.+81,1)!.$!Y6!.o!5!#D0/%$(,$!.$!_!=C.3'VC#0%$4!!!F!
!phénylpyruvate!
!phényl‐lactate!!
!GC3'%1(+*1$!"!0,,-*-#0)1'(!.$!Y-"!!
! ! ! ! !GC2$!1!!>!hépato‐rénal-"!2/!8'1$\3$1(!e!30,=1)1%*$!
! ! ! ! !GC2$!2!>!occulocutané-"!#+%1'(!+21.$3*19-$!e!3$)03.!*$()0#!
H3N+
C
COO–
R
α
grp carboxyle
grp amine
chaîne latérale
kinase
décarboxylase
désaminase
0
0
,
5
1
1,5
2
2
4
6
8
10
12
pH
pK1
pHi
pK2
ajout OH-
CORN
H vers soi
Sens horaire L
C
α

PROTÉINES'
! !
! @$%! 23')+1($%! %'()! .$%! *0,3'*'#+,-#$%! 8'3*+$%! .D-($! '-! 2#-%1$-3%! ,=0F($%! .D&&! <&&! 23')+1('?A($%:6!
23+%$()$%!.0(%!)'-%!#$%!)1%%-%!.$!#D'3?0(1%*$4!Z##$%!%'()!.+81(1$%!!203!#$-3!structure-primaire!(séquence!d’AA),!*01%!
#$-3!!spécificité- fonctionnelle- dépend-de-leur-configuration-spatiale!<%)3-,)-3$!KK013$6!KKK013$6!Kp013$:4!Elles!ont!un!rôle!dans!le!
transport!(hémoglobine),!la!communication!(hormones),!la!catalyse!(enzymes).!
!@0!2'#031)+!.$%!&&!.+)$3*1($!#0!,'(81?-30)1'(!%20)10#$!.D-($!23')4!Z(!*1#1$-!hydrophile-"!#$%!&&!5!,=0F($!#0)4!
2'#013$!%'()!$V2'%+%!0-!*1#1$-!H!#$%!&&!5!,=0F($!#0)4!02'#013$!%'()!3$2#1+%!0-!,$()3$!.$!#0!23')!<*1#1$-!=C.3'2='/$:!
!
La-structure-primaire !-
Elle'est'définie'par'la'séquence'''''''''''''''''''''''''''''''
en'AA'constituant'la'protéine.''
Z##$!3$?3'-2$!)'-)$%!#$%!#101%'(%!,'70#$()$%!"!peptidiques-et-ponts-disulfures.-----------------------------------------------------------------!!
@0!#101%'(!2$2)1.19-$!$%)!#D0%%',10)1'(!.D-($!8'(,)1'(!;LLS!<,03/'VC#$:!$)!MST!<0*1($:!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
.$!.$-V!&&!,'(%+,-)18%6!1#!C!0!perte-d’une--molécule-d’eau4!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
@0!,'(81?-30)1'(!trans!.$!,$))$!#101%'(!$%)!#0!plus-stable!$)!.'(,!#0!plus-fréquente4!!
-
La-structure-secondaire !--
K#!%D0?1)!.$!l’agencement-de-la-protéine-dans-l’espace4!
L(!)3'-7$!.$%!liaisons-hydrogène-$()3$!#$%!AA-proches4!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
La!Pro!fait!adopter!des!coudes!à!la!prot!
!forme!d’une!épingle!à!cheveux.!-
-
La-structure-tertiaire !--
@0!23')+1($!%$!3$)3'-7$!%'-%!8'3*$!.D-($!%-,,$%%1'(!.D=+#1,$%!q6!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
.$!8$-1##$)%!r!$)!.$!,=0F($%!2$2)1.19-$%!%1*2#$%4!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
L(!C!3$)3'-7$!.$%!#101%'(%!$()3$!.$%!&&!+#'1?(+%6!
1#!2$-)!%D0?13!.$!#101%'(%!"!
!!!!O!hydrogènes-<$()3$!&&!5!,=0F($!#0)4!2'#013$:!
!!!!O!hydrophobes-<$()3$!&&!5!,=01($!#0)4!02'#013$%:!
!!!!O!ioniques!<$()3$!&&!5!,=0F($!#0)4!1'(1%0/#$%:!
!
La-structure-quaternaire !-!
E$3)$!.$!#0!,'()1(-1)+!.$%!&&!H!#$%!!N[!%'()!#1+%!203!.$%!liaisons-non-covalentes4!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
ZV!"!@D=+*'?#'/1($!2'%%A.$!U!N[!2'%%+.0()!,=0,-($!#$-3!%)3-,)-3$!K013$6KK013$!$)!KKK013$!!!!
!!!!!!@$!,'##0?A($!2'%%A.$!T!N[!2'%%+.0()!,=0,-($!#$-3!%)3-,)-3$!K013$6KK013$!$)!KKK013$!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
\st!%)3-,)-3$!9-0)$3(013$!($!7$-)!20%!8'3,+*$()!.13$!U!N[!
Les-pathologies !!!!-Alzheimer-(amyloïdoses)!"!#$%!203)1$%!$V)30,C)'%'#19-$%!.$%!23')+1($%!)30(%*$*/30(013$%!%'()!0('3*0#$*$()!
,#17+$%4!Z##$%!%D0,,-*-#$()!$(%-1)$!$)!%D0?3A?$()!8'3*0()!01(%1!.$%!2#09-$%!0*C#'u.$%4!
-----------------------------------------Maladie-à-Prion-:![($!23')+1($!Q!E3E!R!$(!=+#1,$!q!$%)!1(8$,)+$!203!-($!E3E!20)='#'?19-$!$(!8$-1##$)!r!9-1!#-1!801)!
0.'2)$3!5!%'(!)'-3!-($!%)3-,)-3$!$(!8$-1##$)!r4!@$%!!E3E!%$3'()!,'()0*1(+$%!.$!23',=$!$(!23',=$4!
!
Les-moyens-d’étude-de-la-structure-primaire !-
•Hydrolyse-acide-:!,'-2$!)'-)$%!#$%!#101%'(%!2$2)1.19-$%4!L(!'/)1$()!#0!,'*2'%1)1'(!.$!#0!23')+1($6!pas!sa!séquence.!
-
•Réactif- d’Edman- ou- Phényl-Isothio- Cyanate- (PITC)-"!;D$%)! -(!%+9-$(,$-36! 1#! %$! 81V$!%-3! #0! 8'(,)1'(! 0*1($! .$!#D&&! $(!! MO)$3*! 2'-3!
.'(($3!-(!Phényl!Thio!Hydanthoide‐AA(PTH‐alanine…)!2-1%!'(!$88$,)-$!-(!,#170?$!0,1.$!2'-3!%+203$3!#$!EGSO&&!.-!3$%)$!.$!#0!23')+1($6!#$!EGSO&&!
$%)!1.$()181+4!L(!3$*$)!#0!23')+1($!$(!23+%$(,$!.$!EKG;!2'-3!3$,'**$(,$34!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
-
•Exopeptidases-"!,'-2$()!#$%!&&!2#0,+%!0-V!$V)3+*1)+%6!'(!.1%)1(?-$!#$%!"!!
!!!!!!!!!!!!]4!&*1('2$2)1.0%$%!(coupent!à!droite!des!'N‐term)!"!#0!@$-,1($&*1('E$2)1.0%$!,'-2$!))!%0-)!E6!#D&*1('2$2)1.0%$!v!,'-2$!))!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
------------Y4!;03/'V12$2)1.0%$%!(coupent!à!gauche!des!C‐term)!"!#0!A!,'-2$!5!?0-,=$!.$!=#$6@$-!$)!p0#6!#0!B!($!,'-2$!9-$!I!$)!c!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!-
-
•Endopeptidases!"!Trypsine!,'-2$!5!.3'1)$!.$!I!$)!c!;!Chymotrypsine!.$!a6!`6!_6!@6!v!H!Élastase!.$!&6!P6!N!
- -
•Chromatographies-"!203!,'#'(($!+,=0(?$-%$%!.D1'(%!"!-)1#1%0)1'(!.$!/1##$%!,=03?+$%!%-3!-($!,'#'(($4!@0!%+2030)1'(!%$!801)!$(!!8'(,)1'(!.$!#0!
,=03?$!"!%'1)!203!70310)1'(!.$!ES!<9-0(.!#0!23')!0))$1()!%'()!2S16!$##$!%$!.+)0,=$:6!%'1)!203!,'*2+)1)1'(!<0n'-)!.$!M0;#:!!
!! ! !!!!!!!203!0881(1)+!"!'(!-)1#1%$!.$%!$(lC*$%!'-!.$%!0()1?A($%!<0?:4!E03!$V$*2#$!"!#$%!/1##$%!%'()!0%%',1+$%!5!-(!0()1,'32%!0-9-$#!%$!
81V$!#D0?!,'33$%2'(.0()6!#$%!0-)3$%!0?!%'()!+#-+%4!-
L(!3$)3'-7$!-(!$(3'-#$*$()!$(!hélice-α!'-!
feuillet-plissé-β6!2030##A#$!'-!0()12030##A#$!
!<#D0()1!+)0()!#$!2#-%!%)0/#$:4!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
\st!%)3-,)-3$%!K013$6KK013$!$)!KKK013$!
!,'()1(-1)+!$()3$!#$%!&&!
!
Kp013$!>!0%%',10)'!.$!%)3-,)-3$%!KKK013$!
!2$3)$!.$!#0!,'()1(-1)+!$()3$!#$%!&&!
\st!;D$%)!-($!#101%'(!!
2#0($!
31?1.$!!!!
polaire--
*01%-non‐ionisable!
!
Perte!d’une!molécule!d’eau!
1
/
2
100%