dans la myasthénie auto-immune

JUIN 2014
Ce document présente l'état actuel des connaissances
scientifiques sur la myasthénie auto-immune, mis à jour à
l'occasion des Journées des Familles 2014 de l'AFM-
Téléthon. Il est téléchargeable sur le site internet de
l'AFM-Téléthon : WEB www.afm-telethon.fr .
Pour en savoir plus sur la myasthénie auto-immune, vous
pouvez consulter le Repères et le Zoom sur. la myasthénie
auto-immune ainsi que les Repères Savoir et Comprendre
qui traitent de sujets scientifiques, médicaux,
psychologiques et sociaux.
Destinés aux personnes atteintes de maladies
neuromusculaires et à leurs familles, ils sont disponibles
sur le site internet de l'AFM-Téléthon et auprès du Service
régional de l'AFM-Téléthon de votre région.
Ils ne peuvent en aucun cas se substituer à l'avis d'un
médecin, même s'ils peuvent vous faciliter le dialogue
avec l'équipe soignante.
Avan
Cées
dans la
myasthénie
auto-immune
> myasthenia gravis
> myasthénie acquise

Avancées dans la
myasthénie auto-immune
Savoir & Comprendre
Sommaire
Faits marquants ..................................................................................... 3
Qu’est-ce que la myasthénie auto-immune ? ..................................... 4
À quoi la myasthénie auto-immune est-elle due ? ............................ 5
La réaction auto-immune est dirigée contre des constituants la jonction
neuromusculaire .............................................................................................................. 5
Le récepteur de l'acétylcholine est indispensable à la transmission de
l'ordre de contraction musculaire ............................................................................. 5
Les protéines MuSK et LRP4 sont nécessaires au regroupement des
RACh à la jonction neuromusculaire ....................................................................... 5
Des personnes triplement séronégatives ................................................................. 7
Un dérèglement du système immunitaire associé au thymus ...................... 7
Où en est la recherche dans la myasthénie auto-immune ? ............. 8
Des bases de données pour mieux connaître la maladie ................................ 9
Analyse épidémiologique et clinique de la myasthénie liée à LRP4 ............. 9
Mieux décrire la myasthénie auto-immune anti-MuSk .................................... 9
Développer des modèles animaux et cellulaires de la myasthénie .......... 10
Des modèles animaux de myasthénie anti-RACh .............................................. 10
Des modèles animaux de myasthénie anti-MuSK ............................................. 10
Des modèles animaux de myasthénie anti-LRP4 ............................................... 11
Mécanismes moléculaires de la myasthénie auto-immune anti-MuSk .. 11
Mécanismes cellulaires du développement de la myasthénie auto-
immune ............................................................................................................................ 11
Le rôle du thymus ........................................................................................................... 11
L’hypothèse virale ........................................................................................................... 11
L’hypothèse hormonale ............................................................................................... 12
Des prédispositions génétiques ................................................................................ 12
Mieux comprendre la composante génétique du développement de la
myasthénie auto-immune ........................................................................................ 13
Rôle de l’inflammation ............................................................................................... 13
Rôle des micro-ARN.................................................................................................... 13
Réguler l'activité du système immunitaire ......................................................... 14
L’élimination des anticorps anti-récepteurs de l’acétylcholine .................... 14
Optimiser le traitement de la myasthénie auto-immune ............................... 14
Le méthotréxate .............................................................................................................. 15
Le belimumab, un immunomodulateur ................................................................. 15
Développer des traitements dans les myasthénies réfractaires ................. 16
Le rituximab dans les myasthénies réfractaires liées aux RACh ................... 16
Le rituximab dans les myasthénies réfractaires liées à MuSK ....................... 16
L’eculizumab dans les myasthénies réfractaires liées aux RACh .................. 16
Développer des traitements dans la myasthénie oculaire ........................... 17
Les corticoïdes dans la myasthénie oculaire ........................................................ 17
D’autres pistes thérapeutiques à l’étude chez la souris ................................ 17
La piste de la thérapie cellulaire ............................................................................... 17
La piste de l’albutérol .................................................................................................... 17
Rédaction
Myoinfo,
Département d'information sur
les maladies neuromusculaires
de l'AFM-Téléthon, Évry
Validation
S. Berrih-Aknin
UPMC UM76 – INSERM U974 –
CNRS UMR 7215, Institut de
Myologie Hôpital La Pitié-
Salpêtrière, Paris
2 ǀ AFMTéléthon ǀ Juin 2014

Avancées dans la
myasthénie auto-immune
Savoir & Comprendre
Faits marquants
> La conférence internationale sur la myasthénie auto-immune,
Myasthenia 2013, a eu lieu les 1er au 2 juillet 2013 à l’Institut Pasteur
(Paris). Elle a été suivie du meeting annuel de Fight-MG le 3 juillet 2013.
> Le congrès sur l’auto-immunité s’est déroulé à Nice du 26 au 30 mars
2014.
> La base de données européenne de patients coordonnée par le
réseau "FIGHT-MG" rassemble les données de près de 4 200 personnes
atteintes de myasthénie auto-immune.
> Le projet de "Fight-MG" étudie des facteurs génétiques et
épigénétiques chez des jumeaux.
> Un nouveau modèle de souris généré par une immunisation ciblée
anti-LRP4 a été développé.
> Meilleure compréhension des mécanismes impliqués dans la
myasthénie
- l’agrine, nouvelle cible potentielle d’anticorps et à l’origine d’une forme
de myasthénie auto-immune,
- rôle de l’interaction de MuSK avec LRP4 dans le fonctionnement de la
jonction neuromusculaire,
- rôle des microARN et de l'interleukine 17 dans l'inflammation,
- résistance des lymphocytes T à être supprimé par les cellules T
régulatrices.
> La piste d’une origine virale dans la myasthénie auto-immune se
confirme mais n’est pas liée à une infection par le papillomavirus.
> Moduler l'activité du système immunitaire
• Étude internationale comparant l'évolution de la maladie avec ou
sans thymectomie, chez des personnes atteintes de myasthénie auto-
immune traitées par corticoïdes. Recrutement terminé.
• Essai MYACOR
Évalue un nouveau protocole corticoïdes/azathioprime chez 114
personnes atteintes de myasthénie auto-immune en France. Recrutement
terminé.
• Essai du méthotrexate
Chez 50 personnes atteintes de myasthénie auto-immune aux États-Unis
et au Canada. Recrutement terminé.
• Essai du belimumab
Chez 42 personnes atteintes de myasthénie auto-immune aux États-Unis.
Recrutement en cours.
> Traiter les formes réfractaires
• Essai FORCE
Évalue le rituximab chez 12 personnes atteintes de myasthénie réfractaire
en France. Phase clinique terminée, données en cours d’analyse.
3 ǀ AFMTéléthon ǀ Juin 2014

Avancées dans la
myasthénie auto-immune
Savoir & Comprendre
• Essai Eculizumab
Chez 92 personnes atteintes de myasthénie réfractaire aux États-Unis.
Recrutement en cours.
> Traiter la myasthénie oculaire
• Essai Epitome
Chez 11 personnes atteintes de myasthénie oculaire aux Etats-Unis et au
Canada. Phase clinique terminée, données en cours d’analyse
> Des pistes thérapeutiques à l’étude chez la souris
- Des travaux de thérapie cellulaire sur un modèle de souris "humanisées"
sont en cours d’étude.
- La prise d’albutérol à court terme est efficace dans une souris modèle de
myasthénie liée à MuSK.
Qu’est-ce que la myasthénie auto-immune ?
La myasthénie auto-immune est une maladie rare qui touche environ 5 à
10 personnes sur 100 000.
Elle se manifeste par une faiblesse musculaire d'intensité et de durée
variables pouvant toucher n'importe quel muscle. Cette faiblesse
musculaire a la particularité d'augmenter à l'effort ou à la répétition du
mouvement. Elle peut aboutir à une paralysie partielle du ou des muscle(s)
concerné(s).
La myasthénie auto-immune apparaît souvent entre 20 et 40 ans, le plus
souvent chez les femmes (60% des cas). Après 40 ans, la répartition
homme/femme tend à s'inverser. Depuis plusieurs années, le nombre de
personnes âgées de plus de 60 ans chez qui on fait le diagnostic de
myasthénie a augmenté.
La myasthénie auto-immune se manifeste de façon très différente d'une
personne à l'autre (myasthénie oculaire, myasthénie généralisée, formes
avec anticorps anti-récepteur de l'acétylcholine, formes avec anticorps
anti-récepteur tyrosine kinase musculaire, formes doublement
séronégatives, formes avec anticorps anti-LRP4...) et peut fluctuer dans le
temps pour un même individu.
Cette faiblesse musculaire fluctuante s'accompagne fréquemment
d'anomalies du thymus, sous forme d’une hyperplasie chez le sujet jeune
ou de thymome chez le sujet âgé.
Le thymus est une glande située dans le thorax derrière le sternum. Son
activité et sa taille sont maximales jusqu'à la puberté, avant de diminuer à
l'âge adulte. Son rôle est de rendre certaines cellules du système
immunitaire, les lymphocytes T, aptes à distinguer ce qui appartient à
l'organisme (le "soi") de ce qui provient de l'environnement (le "non-soi")
et à reconnaître spécifiquement les différents agents pathogènes (virus,
microbes, bactéries...).
Une
maladie
est dite
rare
quand
elle touche moins d'une personne
sur 2 000. Les maladies rares font
l'objet d'une politique de santé
publique commune dans les
domaines de la recherche, de
l'information et de la prise en
charge.
Les anticorps sont des protéines
complexes impliquées dans
l'immunité, dont le rôle est de
reconnaître spécifiquement un
élément étranger à l'organisme
afin qu'il soit détruit par le
système immunitaire. Ils
appartiennent à la famille des
immunoglobulines (Ig) dont il
existe cinq grands types : IgA,
IgD, IgE, IgG, IgM. Les IgG sont les
plus fréquentes de notre
organisme.
4 ǀ AFMTéléthon ǀ Juin 2014

Avancées dans la
myasthénie auto-immune
Savoir & Comprendre
Les traitements actuels de la myasthénie (anti-cholinestérasiques,
thymectomie, corticoïdes, immuno-modulateurs, immunoglobulines,
plasmaphérèse...) permettent à la plupart des personnes atteintes de
myasthénie de mener une vie quasi normale.
À quoi la myasthénie auto-immune est-elle due ?
La myasthénie auto-immune est une maladie neuromusculaire due à un
dysfonctionnement du système immunitaire. Le système immunitaire, qui,
normalement, protège l'organisme contre des éléments étrangers ou des
agressions extérieures, réagit à des constituants de son propre organisme :
les médecins parlent de réaction auto-immune.
La cause de ce dérèglement du système immunitaire est encore inconnue,
mais les scientifiques pensent qu’une infection virale ou un déséquilibre
hormonal pourraient, dans certains cas, être à l’origine de l’activation du
système immunitaire, qui dans un environnement génétique favorable
pourrait "s’emballer" de façon excessive.
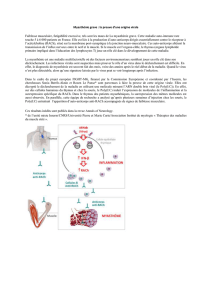
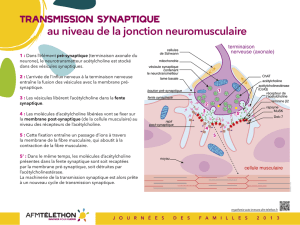
La réaction auto-immune est dirigée contre des constituants la
jonction neuromusculaire
Dans la myasthénie, la réaction auto-immune est dirigée contre des
constituants de l'interface entre le nerf et le muscle, la jonction
neuromusculaire, ce qui aboutit à un défaut de transmission de l'influx
nerveux.
Le système immunitaire fabrique des anticorps contre le récepteur de
l'acétylcholine (RACh) ou contre le récepteur tyrosine kinase musculaire
"MuSK", ou encore contre la protéine LRP4, protéine associée à la protéine
MuSK. Toutes ces protéines - le récepteur de l'acétylcholine, le récepteur
tyrosine kinase musculaire "MuSK", la protéine LRP4 – sont situées à la
jonction neuromusculaire.
Le récepteur de l'acétylcholine est indispensable à la transmission de
l'ordre de contraction musculaire
Plus de 85% des personnes atteintes de myasthénie fabriquent des
anticorps dirigés contre le récepteur de l’acétylcholine (anticorps anti-
RACh). En se fixant sur ces récepteurs, les anticorps bloquent le
fonctionnement de ceux-ci ou provoquent leur destruction.
L'acétylcholine ne peut alors plus se fixer sur son récepteur et la
transmission de l'influx nerveux vers le muscle s'effectue mal : le muscle se
contracte moins bien et se fatigue. Il s'ensuit une faiblesse musculaire
d'intensité et de durée variables, qui peut toucher n'importe quel
muscle et qui augmente à l'exercice.
Les protéines MuSK et LRP4 sont nécessaires au regroupement des
RACh à la jonction neuromusculaire
Parmi les malades présentant une forme généralisée sans anticorps anti-
RACh -on parle de myasthénie "séronégative"-, environ 40% ont des
anticorps contre le récepteur tyrosine-kinase spécifique du muscle
(anticorps anti-MuSK).
5 ǀ AFMTéléthon ǀ Juin 2014
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%