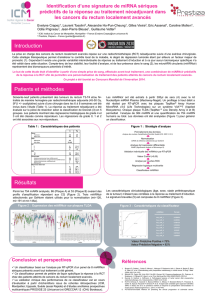
et al - Master Pathologie Humaine

Master
Tronc
commun
Novembre
2009
Pierre Cau
INSERM U910 Faculté de Médecine
Laboratoire de Biologie Cellulaire, Hôpital La Timone
Marseille
pierre.cau@univmed.fr
Les microARN (miRNA, miR)
1. Introduction
2. Synthèse des miRNA
3. miRNA et régulation de l’expression de gènes :
dans le cytosol
4. miRNA et régulation de l’expression de gènes :
dans le nucléoplasme
5. Régulations de la synthèse des miRNA
6. Rôles en Biologie et pathologies

Craig C. MelloAndrew Z. Fire
Nobel
Physiologie
Médecine 2006
«!Pour leur découverte de l’ARN interférence, l’inhibition de
l’expression (silencing) de gènes par un ARN double brin!»
http://nobelprize.org/nobel_prizes/medicine/laureates/2006/
http://nobelprize.org/nobel_prizes/medicine/laureates/2006/
1. Introduction
siRNA (small interferent) et miRNA (micro) :
Lee RC, Feinbaum RL, Ambros V. 1993. The C. elegans heterochronic gene lin-4
encodes small RNAs with antisense complementarity to lin-14. Cell, 75, 843.

Une animation sur le site web de Nature :
http://www.nature.com/focus/rnai/animations/index.html
http://www.nature.com/focus/rnai/animations/index.html
1. Introduction

2. Synthèse
1. gènes de miRNA
2. pré-miRNA
3. 1er clivage
(Drosha)
4. exportation
5. 2ème clivage
(Dicer)
6. complexe RISC
7. P bodies
Cau et Seïte, 2007
Cours de Biologie cellulaire
Editions Ellipses
Figure 12/12

2. Synthèse
Zhao et Srivastava, 2007, TIBS, 32, 189
1. Organisation génomique des miRNA :
•20% avec promoteur indépendant
•40% dans introns (gènes codant ou non pour protéines)
avec ± la même orientation que le gène dans lequel le gène miR est inclus
•10% dans exons
•Environ 10% dans séquences répétées Alu du génome
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
1
/
49
100%