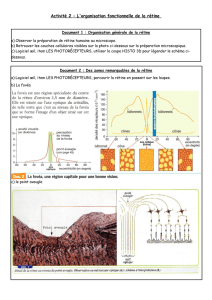
Dégénérescence progressive de la rétine chez un chien Berger

Revue Méd. Vét., 2010, 161, 4, 178-184
Introduction
Les rétinopathies atrophiques du chien concernent la
neurorétine, l’épithélium pigmentaire de la rétine ou l’asso-
ciation des deux. Elles peuvent avoir une origine toxique,
métabolique, infectieuse, parasitaire ou héréditaire [3, 6, 14].
Elles sont regroupées sous le terme générique d’atrophie
rétinienne progressive (ARP) lorsqu’elles ont une origine
héréditaire. Elles sont alors divisées en ARP généralisée et
ARP centrale [3, 6, 14]. L’ARP centrale désigne une atteinte
primitive de l’épithélium pigmentaire de la rétine et porte
aussi le nom de dystrophie de l’épithélium pigmentaire [3, 6,
14]. Les ARP généralisées sont des affections de la neuroré-
tine également qualifiées de dégénératives car leur lésion
princeps est la lyse des photorécepteurs par apoptose. Elles
se subdivisent en ARP précoces (dysplasies et dégénérescences
précoces des photorécepteurs) ou tardives (dystrophies des
photorécepteurs) [1, 2, 3, 6, 14, 16, 17, 20]. Leur unité cli-
nique est une diminution progressive de la vision jusqu’à la
cécité totale et irréversible [6]. Le déficit visuel est souvent
observé primitivement en faible luminance, avant de devenir
complet dans toutes les ambiances lumineuses [6]. Ces réti-
nopathies se compliquent parfois tardivement d’une cataracte
et plus précocement d’une dégénérescence vitréenne [3, 6, 14].
Les rétinopathies atrophiques héréditaires, ou présumées
telles, ont été décrites dans de nombreuses races canines [4,
6, 7, 12, 13, 15, 20, 21].
Cas clinique
COMMÉMORATIFS, ANAMNÈSE
Un chien militaire berger hollandais mâle, âgé de deux ans,
a été présenté à la consultation pour une suspicion de déficit
visuel. Affecté depuis peu comme chien de patrouille, son
comportement inhabituel lors des phases d’entraînement a
alerté son maître : mauvaise position lors du rappel, difficulté
d’identification des objectifs. Lors de la visite d’achat à l’âge de
13 mois, le vétérinaire avait noté une anisocorie modérée. L’examen
oculaire complet n’avait alors révélé aucune autre anomalie.
L’animal était correctement vacciné et vermifugé ; il était
nourri avec une alimentation industrielle de bonne qualité.
EXAMEN CLINIQUE GÉNÉRAL ET OCULAIRE
L’examen clinique général n’a montré aucune anomalie
particulière.
RÉSUMÉ
Un chien militaire berger hollandais de l’armée française âgé de deux ans a
été présenté en consultation d’ophtalmologie à l’Ecole Nationale Vétérinaire
de Toulouse pour un déficit visuel se traduisant par une diminution de sa
capacité opérationnelle. A l’examen, l’animal montrait une mydriase aniso-
corique gauche associée à des lésions d’atrophie rétinienne modérées sur
l’œil droit, beaucoup plus sévères sur l’œil gauche. Le chien présentait par
ailleurs une dégénérescence vitréenne débutante du côté gauche. L’examen
échographique a confirmé l’atteinte vitréenne tandis que l’électrorétinographie
a mis en évidence une atteinte fonctionnelle grave de la rétine. L’examen
histopathologique des globes oculaires, après euthanasie de l’animal, a cor-
roboré l’hypothèse épidémio-clinique d’atrophie progressive de la neurorétine.
Cette affection présumée héréditaire est, selon les auteurs, décrite pour la
première fois chez le berger hollandais.
Mots-clés : Atrophie rétinienne, ARP, photorécepteurs,
anisocorie, électrorétinographie, chien.
SUMMARY
Progressive retinal degeneration in a Dutch Shepherd
A two years old military Dutch Shepherd dog of the French army was pre-
sented at the ophthalmology clinic of the National Veterinary School of
Toulouse for vision impairment. On ophthalmic examination of the animal
anisocoria with left mydriasis was observed. Ophthalmoscopic lesions indi-
cative of retinal atrophy were also found in both eyes and were more marked
on the left side. Vitreous degeneration was present on that side, and was
confirmed by ultrasound examination. Electroretinography highlighted
serious alterations of the retinal electrophysiology. The histopathological
examination of the eyeballs, performed after euthanasia, confirmed the cli-
nical diagnosis of progressive retinal atrophy. To the authors’ knowledge this
is the first time that presumably hereditary retinal disorder is reported in the
Dutch Shepherd breed.
Keywords: Retinal atrophy, PRA, dystrophy, photoreceptors,
anisocoria, electroretinography, dog.
Dégénérescence progressive de la rétine
chez un chien Berger Hollandais
T. DULAURENT1*, P.F. ISARD1, C. PETIT2, C. GIRARDET3, A. REGNIER4, I. RAYMOND-LETRON5
1Centre Hospitalier Vétérinaire Saint-Martin, 275 route Impériale, 74370 Saint- Martin Bellevue, FRANCE.
2Secteur Vétérinaire de Toulouse, BP 63236, 31132 Balma Cedex, FRANCE.
3Secteur Vétérinaire de Paris, Ecole militaire, BP 48, 00445 Armées, FRANCE.
4Service d’ophtalmologie, Ecole Nationale Vétérinaire de Toulouse, 23 chemin des Capelles, 31076 Toulouse, FRANCE.
5Laboratoire d’histopathologie, Ecole Nationale Vétérinaire de Toulouse, 23 chemin des Capelles, 31076 Toulouse, FRANCE.
* Auteur chargé de la correspondance : dulaur[email protected]

Revue Méd. Vét., 2010, 161, 4, 178-184
DÉGÉNÉRESCENCE PROGRESSIVE DE LA RÉTINE CHEZ UN CHIEN BERGER HOLLANDAIS 179
Au cours de l’examen oculaire, la vision paraissait normale
avec persistance des réponses de clignement à la menace et à
l’éblouissement. L’animal présentait cependant une mydriase
anisocorique gauche (photographie 1); la pupille gauche se
contractait peu sous les stimuli lumineux répétés. Les
réflexes photomoteurs direct et consensuel gauches étaient
fortement diminués. Le myosis de l’œil droit était par
ailleurs incomplet sous stimulation lumineuse directe.
L’examen attentif du segment antérieur n’a mis en évidence
aucune anomalie.
Après mydriase pharmacologique obtenue par instillations
locales répétées de tropicamide 0,5 % (Mydriaticum®, Théa) et
de phényléphrine 10 % (Néosynéphrine Faure®10 %, Europhta),
l’examen du cristallin n’a pas montré d’anomalie. Le vitré de
l’œil droit était normal ; le vitré de l’œil gauche présentait
une synérèse en région rétro-lentale, ainsi qu’une hyalose
astéroïde pigmentée d’intensité modérée (photographie 2).
L’examen ophtalmoscopique a révélé la présence de nom-
breuses lésions rétiniennes sur chaque œil.
- La rétine de l’œil droit présentait une zone atrophique en
région supéro-temporale. L’ensemble de la région du tapis
montrait en ophtalmoscopie indirecte une réflexion lumineuse
augmentée, ou bien une teinte grisâtre anormale, en fonction
de l’orientation du rayon lumineux incident. La vascularisation
rétinienne paraissait néanmoins normale (photographie 3).
- Les lésions rétiniennes de l’œil gauche étaient quant à elles
beaucoup plus sévères. Des lésions atrophiques multifocales,
nummulaires, de taille variable, parcheminaient l’ensemble
de la région du tapis. D’autre part, l’ensemble du tapis mon-
trait une réflexion très largement augmentée. La vascularisation
rétinienne était presque inexistante. Enfin la papille, d’aspect
terne, était bordée d’un conus (photographie 4).
EXAMENS COMPLÉMENTAIRES
Devant la présence de lésions vitréo-rétiniennes graves, un
bilan lésionnel (échographie) et un bilan fonctionnel
(électrorétinographie) ont été réalisés.
- L’échographie a révélé la présence de lésions hyperécho-
gènes de petite taille dans la portion postérieure du vitré,
confirmant la hyalose astéroide (photographie 5).
PHOTOGRAPHIE 1 : Mydriase anisocorique gauche. PHOTOGRAPHIE 2 : Synérèse vitréenne et discrète hyalose astéroïde pig-
mentée de l’œil gauche.
PHOTOGRAPHIE 3 : Lésions focales d'atrophie rétinienne et tapis grisâtre
(Oeil droit).
PHOTOGRAPHIE 4 : Atrophie rétinienne généralisée, vascularisation grêle
et conus (Oeil gauche).

Revue Méd. Vét., 2010, 161, 4, 178-184
180 DULAURENT (T.) ET COLLABORATEURS
- L’électrorétinographie a été réalisée selon le protocole suivant :
L’examen est pratiqué sur un animal dont les rétines sont
adaptées à une ambiance de niveau lumineux photopique.
1/ Test de fonctionnement des bâtonnets et cellules asso-
ciées. ERG transitoire : 5 stimulations chromatiques de cour-
te longueur d’onde (bleu : 440 nm) et de niveau lumineux
scotopique sont délivrées en ambiance scotopique, après une
minute, 5 minutes puis 7 minutes d’adaptation à l’obscurité.
Résultat : les réponses étaient discernables, de morphologie
non typique; les ondes a et b n’étaient pas identifiables (figure 1).
2/ Test de la jonction neurorétine/épithélium pigmentaire.
Adapto-ERG : la morphologie non typique des courbes pré-
cédentes n’a pas permis d’évaluer le couplage neuroépithélium
/ épithélium pigmentaire (figure 1).
3/ Test de fonctionnement des cônes, des bâtonnets et des
cellules associées. ERG transitoire : 1 stimulation achroma-
tique (blanche) de niveau lumineux photopique est délivrée
en ambiance scotopique.
Résultat : les réponses étaient discernables mais de
morphologie non typique pour l’œil gauche; les valeurs des
amplitudes et des temps de culmination des ondes « a » et
« b » n’étaient pas dans les limites des valeurs de référence
pour l’œil droit. Les ondes n’étaient pas identifiables pour
l’œil gauche (figure 1).
4/ Test de fonctionnement des cônes et des cellules asso-
ciées. ERG stationnaire (Flicker) : 20 stimulations achroma-
tiques, de niveau lumineux photopique sont délivrées en
ambiance photopique à une fréquence de 30 Hz, après adap-
tation de la rétine à une ambiance de niveau lumineux photopique.
Résultat : les amplitudes mesurées crête à crête n’étaient
pas dans les limites des valeurs de référence (figure 2).
En conclusion, l’examen a montré un trouble majeur de
l’électrogénèse rétinienne pour chaque œil, toutefois beaucoup
plus marqué pour l’œil gauche.
DIAGNOSTIC DIFFÉRENTIEL
Les données épidémio-cliniques, complétées par les résultats
des examens complémentaires, ont conduit au diagnostic
d’atrophie rétinienne généralisée bilatérale, très avancée sur
l’œil gauche, accompagnée de séquelles vitréennes dégéné-
ratives nettes sur l’œil gauche.
La présentation clinique, le mode d’évolution suspecté de
l’atrophie rétinienne et l’âge de l’animal ont permis de privi-
légier l’hypothèse de dystrophie des photorécepteurs.
PRONOSTIC
Devant l’absence de solution thérapeutique spécifique efficace,
le pronostic de ce type d’affection est très péjoratif, avec une
perte visuelle progressive, précoce, totale et définitive.
TRAITEMENT
Les atteintes atrophiques de la rétine sont incurables à ce
jour chez le chien. Des solutions palliatives sont habituellement
proposées pour faciliter le quotidien des animaux aveugles et
de leurs propriétaires. Elles ont traits aux conditions de vie
de l’animal (disposition des meubles dans le foyer, compen-
sation de la cécité par le développement de l’ouïe…). Pour
un chien militaire dont la capacité opérationnelle est primor-
diale, aucune de ces propositions n’était envisageable.
SUIVI
Etant donné le caractère incurable de l’affection oculaire,
le chien militaire a été réformé pour motif médical. Compte
tenu de la dangerosité potentielle du chien, exacerbée par le
développement de sa maladie, une rétrocession dans le milieu
PHOTOGRAPHIE 5 : Echographie de l’œil gauche. Noter la présence des
structures échogènes dans la partie postérieure de la cavité vitréenne.
PHOTOGRAPHIE 6 : Coupe histologique de la rétine de l’œil gauche, arté-
factuellement détachée de l’épithélium pigmentaire, présentant un
aspect d’atrophie externe sévère. L’épaisseur globale de la rétine
est très diminuée et associée à un aspect atrophique des cônes et
bâtonnets (C&B), un dépeuplement des couches nucléaires exter-
nes (Nu Ext) et interne (Nu Int) et une disparition des couches
plexiformes. Noter par contre la persistance des neurones dans la
couche la plus interne des cellules ganglionnaires (Ggl). Coloration
H&E x400.

Revue Méd. Vét., 2010, 161, 4, 178-184
DÉGÉNÉRESCENCE PROGRESSIVE DE LA RÉTINE CHEZ UN CHIEN BERGER HOLLANDAIS 181
FIGURE 1 : Tracés électrorétinographiques. Les trois premiers tracés correspondent à la réponse des bâtonnets et des cellules associées,
après stimulations monochromatiques bleues, de niveaux lumineux scotopique, délivrées en ambiance scotopique après 1 minu-
te, 5 minutes et 7 minutes d’adaptation à l’obscurité. Le dernier tracé correspond à la réponse des cônes, des bâtonnets et des cel-
lules associées, après stimulation lumineuse achromatique, de niveaux lumineux photopique, délivrée en ambiance scotopique.
civil n’a pas été possible et une euthanasie a été pratiquée.
Les deux yeux ont été prélevés immédiatement après la
mort de l’animal et fixés dans du formol tamponné à 10 %.
Un examen histopathologique de routine a été réalisé sur les
deux globes oculaires après coloration standard à l’hémalun
éosine.
EXAMEN ANATOMOPATHOLOGIQUE
L’analyse microscopique de ces globes a montré une struc-
ture oculaire normale, totalement dénuée de contexte inflam-
matoire avec un épithélium pigmentaire de la rétine normal
mais des lésions atrophiques bilatérales de la rétine.
- Sur l’œil gauche ont été observées des lésions dégénératives
et atrophiques diffuses généralisées d’intensité sévère de la
neurorétine. Elle était globalement amincie, avec une vacuo-
lisation diffuse de toutes les couches. Une déplétion marquée
des couches nucléaires internes et externes, une atrophie des
couches plexiformes, et une atrophie et une déplétion des
segments externes des photorécepteurs ont été mises en évi-
dence. Les cellules ganglionnaires semblaient moins atteintes
que les couches plus externes, même si leur nombre était
également diminué, étayant le diagnostic d’atrophie rétinienne
externe. Par endroit, l’atrophie était telle que la rétine ne formait
plus qu’une bande très fine contenant une seule couche rési-
duelle de noyaux (photographie 6).
- La neurorétine de l’œil droit était moins touchée, avec
une épaisseur globale plus importante, une vacuolisation dif-
fuse, une déplétion moins marquée des noyaux des couches
nucléaires interne et externe, et une meilleure conservation
des segments externes des photorécepteurs.
Ce tableau lésionnel était donc celui d’une atrophie réti-
nienne externe bilatérale, modérée à droite et sévère à gauche.

Revue Méd. Vét., 2010, 161, 4, 178-184
182 DULAURENT (T.) ET COLLABORATEURS
Discussion
L’atrophie rétinienne représente le stade terminal de la
perte des qualités morphologiques et fonctionnelles de la
rétine. Cet état pathologique peut être lié à des causes très
variées chez le chien (toxique, nutritionnelle, métabolique,
infectieuse, parasitaire…). L’atrophie rétinienne est irréver-
sible et conduit irrémédiablement à la cécité [3, 4, 6, 14, 17].
L’atrophie rétinienne progressive correspond à un groupe
d’affections qui ont pour point commun d’être toujours bila-
térales, de présenter une évolution progressive vers la cécité
dans un contexte excluant toute inflammation ou d’autres
affections oculaires primitives. La mort cellulaire est alors
dite « programmée » et se produit par apoptose (contrairement
aux autres causes d’atrophie rétinienne où la mort cellulaire
se produit par nécrose et produit une inflammation).
De très nombreuses races canines sont concernées par
l’ARP, mais peu d’informations sont disponibles sur la pré-
valence et les particularités relatives à chaque race.
Néanmoins, le trait épidémiologique commun à presque toutes
les races étudiées est le caractère héréditaire de cette affec-
tion, transmissible selon un mode autosomique récessif [6,
14, 17].
L’atrophie rétinienne progressive regroupe en réalité des
états pathologiques dont le déterminisme est variable.
Retenons la dysplasie des photorécepteurs, qui se traduit par
un mauvais développement des bâtonnets et des cônes qui ne
parviennent jamais à maturité fonctionnelle [6, 14]. La
dysplasie des photorécepteurs affecte donc la fonction réti-
nienne de façon très précoce, entraînant une cécité totale
entre 1 an et 5 ans [6, 14]. Les premières manifestations oph-
talmoscopiques peuvent être identifiées dès la huitième
semaine d’âge [6, 14]. Un autre type d’atrophie rétinienne
progressive est la dystrophie des photorécepteurs. Cette
affection intervient après maturation des photorécepteurs et
traduit un trouble métabolique de ces derniers [6, 14]. Pour
cette raison, les manifestations cliniques sont plus tardives
que lors de dysplasie des photorécepteurs, puisque la dystrophie
se développe lorsque la maturité fonctionnelle des cellules
est acquise (par ailleurs, l’âge d’apparition des manifestations
cliniques est variable d’une race à l’autre).
Il existe de nombreux type de dystrophies des photorécepteurs.
Certains affectent primitivement les cônes puis les bâtonnets
(Cone-Rod Dystrophy), d’autres touchent les bâtonnets puis
les cônes (Progressive Rod-Cone Degeneration : pcrd). Les
dégénérescences progressives de type pcrd semblent les plus
fréquentes [14] ; certaines races y sont particulièrement pré-
disposées (Caniches nain et toy, Retriever du Labrador). Ce
type de rétinopathie dégénérative se manifeste par un déficit
visuel de nuit contemporain de l’atteinte fonctionnelle des
bâtonnets, compliqué dans un deuxième temps d’un déficit
visuel de jour, contemporain de l’atteinte fonctionnelle des
cônes [14]. Ce sous-groupe de dystrophie des photorécepteurs
représente un modèle animal pour l’étude de la rétinite pig-
mentaire (Retinitis pigmentosa) chez l’homme. La figure 3
rappelle les différents types d’atrophie rétinienne rencontrés
dans l’espèce canine.
La dysplasie et la dystrophie des photorécepteurs sont souvent
très semblables cliniquement. Les manifestations ophtalmos-
copiques sont communes. Elles sont bilatérales et se traduisent
d’abord par une modification de la réflexion du tapis, qui
prend une teinte grise ou bien hyperréfléchissante en fonction
de l’orientation du rayon lumineux incident. Ces modifications
s’aggravent avec le temps. Peu à peu, le calibre vasculaire
décroît, la réflexion du tapis augmente. Dans les stades les
plus avancés, le tapis finit par être uniformément réfléchissant,
la vascularisation disparaissant parfois totalement [6, 14]. La
papille prend alors une teinte grise, terne ; elle est parfois
bordée d’un croissant hyperréfléchissant appelé conus [6].
FIGURE 2 : Tracé électrorétinographique traduisant la réponse des cônes, après 20 stimulations achromatiques, de niveau lumineux
photopique, délivrées en ambiance photopique à une fréquence de 30 Hz.
FIGURE 3 : Les différents types d'atrophie rétinienne rencontrés chez le
chien.
 6
6
 7
7
1
/
7
100%