Microbiologie Alimentaire et Industrielle

Mémoire DE MAGISTER
EN
Microbiologie Alimentaire et Industrielle
Thème
Présenté Par: Mme Henni Nassiba
Devant le Jury de :
Pr. BELKHOUDJA M Président Université d’Oran
Pr. CHEKRROUNE A Examinateur Université d’Oran
Dr. BEKKADA A Examinateur Université de d’Oran
Dr. CHERIGEUNE A Co-Encadreur Université de Mostaganem
Pr. BENSOLTANE A Encadreur Université d’Oran
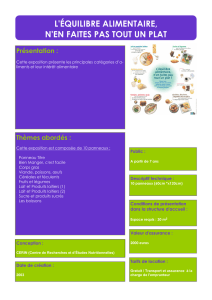
Utilisations des Bactéries Lactiques pour la
fabrication d’un Yaourt probiotique à Partir d’un
Lait de Brebis
2010 - 2011

12 isolats de bactéries lactiques ont été isolées et identifiées en se basant sur leur
caractéristiques physiologiques et biochimique à partir de 05 échontillons de lait cru de vache
collectés de différente région à savoir.
Parmi les isolats, 07 appartenaient au genre Streptococcus soit un taux de 58,33% et 05 au
genre Lactobacillus soit un taux de 41,67% .Etant donnée que notre étude porte sur les
espèces impliquées dans la fabrication de yaourt,les résultats d’isolement et les tests
d’identification ont ciblé les deux souches constituant le levain mixte à savoir Lactobacillus
bulgaricus et Streptococcus thermophilus .
Les souches bactériennes ont été identifiées en se basant sur leur profil macroscopique
et microscopique ainsi que par le système Api50.
Ces souches présentent des propriétés technologiques variables, à savoir un bon
pouvoir acidifiant, par la production d’acide lactique, une activité protéolytique et une
résistance aux inhibiteurs comme les antibiotiques.
L’acidité exprimée en degré dornic °D après24/h de fermentation était de l’ordre de
(79°D et 90°D) chez les espèces Lactobacillus bulgaricus et Streptococcus thermophilus
respectivement.
L’activité protéolytique chez les souches lactiques est importante, évaluée entre
8à11mm chez les Streptococcus thermophilus et 15à22 mm pour les Lactobacillus
bulgaricus.
Le test de l’antibioresistance des souches permet de signaler généralement leurs
sensibilités apparentes aux différents antibiotiques utilisés.
L’activité antagoniste des souches lactiques spécifiques du yaourt a révélé que ces
souches ont un pouvoir d’inhibition vis-à-vis de St. Aureus et Salmonella sp.
Les propriétés technologiques de B. animalis sont déterminées par son aptitude à
fermenter le lait de brebis et le lait écrémé en culture pure et en culture mixte en association
avec Lactobacillus bulgaricus et Streptococcus thermophilus.
L’évolution des valeurs de pH dans le lait de brebis et le lait écrémé enrichi après 24
heures est caractérisée par une baisse de pH atteignant les valeurs 4.7 et 4.9 dans le lait
écrémé enrichi et le lait de brebis respectivement. Inversement, les teneurs en acidité Dornic
augmentent et atteignent 72 °D après 24 heures de fermentation dans le lait écrémé enrichi,
alors que dans le lait de brebis, la teneur atteinte en fin de fermentation est de 69 °D.
La survie de Bifidobacterium animalis dans les produits fermentés en culture mixte,
associée avec Lb. delbrueckii subsp bulgaricus et S.thermophilus(Strp) dans le lait
reconstitué écrémé et le lait de brebis stocké à 6°C pendant 21jours (0-4h) durée de
fermentation et 7-21jours durée de post-acidification) s’est révélée beaucoup mieux en culture
mixte qu’en culture pure dans le lait fermenté de brebis.
Mots clé : Lait (vache, brebis), yaourt, bactéries lactiques, Bifidobacterium, culture mixte,
fermentation, viabilité.

12 strains of lactic bacteria were isolated and indetified on the basis of their
physiological and biochemical caracteristics from 5 samples of raw cow’s milk of different
regions.
07 isolates belong to Streptococcus (58.33%) and 05 were Lactobacillus (41.67%).
Since this study focuses on the species involved in the manufacture of yogurt, results of
isolation and identification tests were therefore, targeted both Lactobacillus bulgaricus and
Streptococcus thermophilus.
Results were confirmed by macroscopic, microscopic and system Api50
studies and species. They present different technological properties such as power of acidity
caused by lactic acid production, proteolytic activity and inhibitory resistance to antibiotics.
This activity was between 8 to 11mm and from 15 to 22mm in Streptococcus thermophilus
and Lactobacillus bulgaricus respectively.
Acidity after 24h of fermentation, expressed in dornic degre (°D), was 79°D and 90°D
with Lactobacillus bulgaricus and Streptococcus thermophilus respectively. However, their
bioresistance tests enable to have an idea about the sensibility to the studied antibiotics.
It was noticed that this two strain have an inhibitory activity towards St. Aureus and
Salmonella sp.
Technological properties of B. animalis were measured by their ability to ferment sheep milk
in both pure and mixed culture combination with Lactobacillus bulgaricus and
Streptococcus thermophilus.
Changes in pH values in both sheep milk and skimmed milk enriched after 24 hours were
characterized by a decrease to 4.5 and 4.8 respectively. While Dornic acidity levels
were increased to 57 ° D after 24 hours of fermentation in skimmed milk enriched, whereas in
the sheep milk,t reached at the end of fermentation 69 ° D.
Survival of Bifidobacterium animalis in mixed culture fermented products, associated with
Lb. delbrueckii subsp bulgaricus and S.thermophilus reconstituted skim milk and sheep
milk stored at 6 ° C for 21 days (0-4h) of fermentation and 7 to 21days of post-
acidification, revealed better in mixed culture than in pure culture in fermented milk
of sheep.
Keywords : Milk (cow, sheep), Yogurt, lactic bacteria, Bifidobacterium, Mixed culture,
fermentation.

5
1207Strptococcus
58,33%05Lactobacillus41,67%).
StreptococcusLactobacillus
L’API SystèmeStreptococcus
thermophilusLactobacillusbulgaricus
24
97 D°(D°90 –StreptococcusthermophilusLactobacillusbulgaricus
PH811
B. animalis
6°21
Bifidobacterium

Remerciements
Initialement, ce projet n’aurait pas été réaliser sans la bénédiction du bon dieux qui m’a
permis de m’instruire et qui à récompensé mes prière.
Au terme de ce modeste travail, je tiens à adresser mes vifs et sincères remerciements et
ma profonde reconnaissance au professeur BENSOLTANE Ahmed ; pour son aide, sa
patience, sa disponibilité et ses précieux conseils tout le long de mon travail.
J’exprime mes respectueux remerciements à Monsieur BELKOUDJA Moulay
d’avoir accepté de présider le jury de soutenance.
Je remercie Monsieur CHEKROUN Abdallah, d’avoir accepté d’examiner et juger ce
travail.
Je remercie vivement Monsieur BEKKADA Ahmed de son aide et ses précieux
conseils et de m’avoir fait l’honneur de superviser ma thèse et de faire partie du jury.
Je tiens à remercier Monsieur CHERIGUNE Abderrahim de sont aide appréciable le
long de ce travail.
Ma gratitude ira également au personnel du laboratoire régional vétérinaire de
Mostaganem pour leur soutien et leur sympathie.
Toutes mes remerciements vont également à léquipe de laboratoire de Microbiologie
alimentaire et industrielle Es-Senia : Nassima.M ; Mahi.M ; Wafaa.B ; Soria.S.B et Houssin,
pour leur encouragements et leur aide.
Enfin, Je remercie toute personne qui à contribué de prés ou de loin à l’élaboration de ce
modeste travail.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
1
/
171
100%