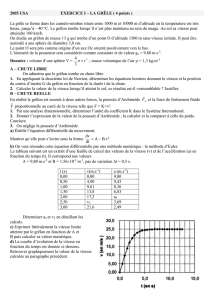
Exercice I QCM (8 pts)

TS Jeudi 8 mars 2012
Physique/Chimie - DS 7
Exercice I QCM (8 pts)
Une grue soulève une charge de masse m = 1,0.103 kg suspendue par un filin d'acier dont on
négligera la masse. On prendra g = 10 m.s-2.
1ère phase : partant du repos, la charge s'élève avec une accélération de valeur
a1 = 1,0 m.s-2.
2ème phase : la charge a ensuite un mouvement uniforme de vitesse v = 3,6 m.s-1.
3ème phase : en fin de montée, la charge ralentit avec une accélération de valeur
a2 = 1,0 m.s-2.
Pour chacune des questions suivantes, en utilisant les lois de Newton, choisir en la
justifiant la réponse correcte.
1. Pendant la première phase, la force exercée par le filin sur la charge est :
Supérieure ;
Inférieure ;
Égale
À la force exercée par la charge sur le filin.
2. Pendant la première phase, la tension du filin a pour valeur :
0 N ;
9,0.103 N
1,0.104 N
1,1.104 N
3. Pendant la deuxième phase, la tension du filin a pour valeur :
0 N
6,4.103 N
1,0.104 N
1,36.104 N
4. Pendant la troisième phase, la tension du filin a pour valeur :
0 N
9,0.103 N
1,0.104 N
1,1.104 N

Exercice II Étude d'un mélange (12 pts)
On mélange, à 25 °C, 20 mL d'une solution d'ascorbate de sodium et 50 mL d'une solution
d'acide éthanoïque. Les deux solutions ont la même concentration c = 1,0.10-1 mol.L-1.
1. Écrire les équations des réactions des espèces introduites avec l'eau.
2. Calculer les constantes d'équilibre correspondantes.
3. Écrire l'équation de la réaction entre les ions ascorbate et l'acide éthanoïque.
4. Que vaut la constante d'équilibre de cette réaction ?
Dans la suite de l'exercice, on négligera les réactions des espèces introduites avec l'eau.
5. Que vaut le quotient de réaction initial ?
6. Prévoir le sens d'évolution spontanée du système.
7. Calculer les quantités de matière initiales des réactifs.
8. Établir le tableau d'évolution de la transformation.
9. Déterminer l'avancement final de la réaction.
10. Calculer les différentes concentrations à l'équilibre.
11. Déterminer par une méthode à votre choix le pH à l'équilibre.
Données.
Acide ascorbique/ion ascorbate C6H8O6(aq)/C6H7O6-(aq) KA1 = 8,9.10-5 ;
Acide éthanoïque/ion éthanoate CH3COOH(aq)/CH3COO-(aq) KA2 = 1,8.10-5 ;
À 25 °C, Ke = 10-14.
Exercice III Prévoir l'évolution d'une pile (8 pts)
Une pile est obtenue en reliant deux demi-piles par une solution gélifiée de chlorure de
potassium, K+(gel) + Cℓ-(gel). Une des demi-piles est constituée d'une lame d'étain plongeant
dans une solution de chlorure d'étain (II), Sn2+(aq) + 2 Cℓ-(aq), telle que [Sn2+]i = 0,10 mol.L-1 ;
l'autre est constituée d'une lame de nickel (II), Ni2+(aq) + 2 Cℓ-(aq), telle que [Ni2+]i = 1,0.10-2
mol.L-1. On la branche aux bornes d'une résistance.
Soit K = 8,9.10-4, la constante d'équilibre à 25 °C associée à la réaction d'équation :
Ni2+(aq) + Sn(s) = Ni(s) + Sn2+(aq)
1. Prévoir le sens d'évolution spontanée du système chimique constituant la pile. En
déduire l'équation modélisant la transformation qui a lieu dans la pile.
2. Quelle est la réaction qui a lieu à l'électrode de nickel ?
3. Quelle est la réaction qui a lieu à l'électrode d'étain ?
4. Faire un dessin de la pile considérée, indiquer l'anode et la cathode, et y
représenter le mouvement des différents porteurs de charge.
5. En déduire la polarité de cette pile et son schéma conventionnel

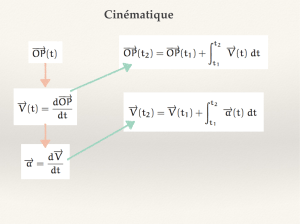
Exercice IV Calculer une accélération (6 pts)
La distance parcourue en mètres par une automobile est donnée par la relation suivante :
X(t) = 2t2 +15.103
Où t est la durée en secondes.
1. Quelle est la position de l'automobile à l'instant t = 0 ?
2. Donner l'expression de la vitesse instantanée V(t).
3. Calculer la valeur de la vitesse à t = 0 et 7 s après son démarrage.
4. Quelle est la valeur de l'accélération du mouvement ?
Question bonus
À t = 10 s, la voiture freine avec une accélération ax = -5 m.s-2, quel sera le temps de
freinage jusqu'à l'arrêt complet et la distance parcourue ?
1
/
3
100%