Corrigé ET1 mai 07

1
BIO241 année 2006-2007
Examen Terminal de 1ère session du 22 mai 2007
__________________________________________________________
Documents et calculatrice non autorisés
Notation sur 120 points
ATTENTION !!!! Rédiger les 3 parties sur des feuilles séparées
4 pages
Partie I : Hémoglobine – Structure et fonction (30 pts)
(cours de M. Robert-Nicoud)
(Répondre de façon brève et précise aux questions posées ; numéroter les
réponses)
1/ Structure des sous-unités de l’hémoglobine
Chez l’homme, l’hémoglobine adulte est un tétramère constitué de deux sous-unités
alpha et de deux sous-unités beta.
Question 1a : Au niveau de la structure secondaire, quel est le motif le plus représenté
au sein de ces sous-unités et quelles en sont les caractéristiques principales ?
Question 1b : Quel est le principal type de liaison non covalente qui stabilise cette
structure secondaire et quels sont les groupements impliqués dans la formation de ces
liaisons ?
2/ Groupement prosthétique
Chaque sous-unité de l’hémoglobine contient un groupement prosthétique.
Question 2a : Quelle est la nature de ce groupement et quel est l’état d’oxydation de
l’atome qui fixe la molécule de dioxygène ?
Question 2b : Décrire à l’aide d’un schéma l’organisation spatiale du site de fixation de
l’oxygène.
3/ Coopérativité
La capacité totale de liaison de l’hémoglobine pour l’oxygène est de 4 molécules. La
liaison des quatre molécules de dioxygène (formation d’oxyhémoglobine) est un
processus coopératif.
Question 3 : Comment s’explique la nature coopérative de ce processus de liaison ?
4/ Effets du CO2 et du pH
L’affinité de liaison de l’hémoglobine pour l’oxygène est affectée par la concentration de
dioxyde de carbone (CO2) et le pH dans le milieu.
Question 4 : Comment s’expliquent les effets du CO2 et du pH ?
5/ Effets du DPG
La liaison de l’oxygène est également influencée par des molécules telles que le 2,3-
diphosphoglycérate (DPG) qui diminue l’affinité de l’hémoglobine pour l’oxygène.
Question 5a : Quel est le mode d’action de cette molécule de DPG ?
Chez les personnes acclimatées aux hautes altitudes, la concentration de 2,3-
diphosphoglycérate dans le sang est plus faible.

2
Question 5b : Quelle en sera la conséquence pour l’efficacité du transfert de l’oxygène
vers les tissus ?
Partie II : Bioénergétique/enzymologie (45 pts)
(cours de F. Cornillon)
1 - La Rubisco catalyse la réaction suivante :
1a - Donner le nom complet de la Rubisco.(1 point)
Ribulose-1,5-bisphosphate carboxylase oxygénase
1b - Nommer les réactants X et Y. Donner leur formule semi-développée.(4 points)
X= Ribulose-1,5-bisphosphate et Y = 3-Phospho-glycérate
1c - Dans quels organismes retrouve-t-on cette enzyme ? (1 point)
Organismes photosynthétiques eucaryotes (plantes et algues) et procaryotes (certaines
bactéries)
1d - Quelle est la localisation principale de la Rubisco au sein d'un organisme eucaryote
type, du niveau intracellulaire à celui de l'organisme ? (2 points)
Enzyme soluble dans le stroma des chloroplastes des cellules (du mesophylle) des feuille
1e - Quelle est la place de cette réaction dans le métabolisme des organismes concernés
? (1 point)
Première étape du Cycle de Calvin (et étape initiale de la photorespiration)
1f - Quel est l'intérêt de cette enzyme à l'échelle de la planète ? (2 points)
Responsable de la fixation du C atmosphérique par les organismes autotrophes, maillon
essentiel du cycle du C.
2 - à 27°C, pour la réaction écrite ci-dessus : ∆G°’= -35 KJ.mol-1.
2a - Donner la signification de l'abréviation ∆G°’. (1 point)
Variation d’énergie libre standard apparente
2b - Que pouvez vous déduire du signe et de la valeur -35 KJ.mol-1 ? Préciser dans
quelles conditions. (2 points)
Dans les conditions standard (Patm, ici T=27°C, [réactants] =1M), la réaction est
spontanée dans le sens 1 (car signe négatif) et est irréversible (car valeur est élevée)
2c - In vivo, les concentrations en réactant sont les suivantes [X] = 1 mM, [CO2] = 10
µM, [Y] = 5 mM. Dans quel sens la réaction tend elle à se faire in vivo ? (5 points)
Données :
R = 8 J. mol-1 K-1
ln 5 = 1,7 et ln 10 = 2,3
∆G’ = ∆G°’ + RT Ln [Y]2 / [X] [CO2]
= -35000 + 8x300x Ln [52 / 10x10-3]
= -35000 + 8x300x (2Ln5 + 2ln10)
= - 15800 J.mol-1
Signe <0 donc sens 1
2d - Donner la relation permettant de calculer la constante d’équilibre, à 27°C, de la
réaction à partir du ∆G°’. (1 point)
X + CO2 + H2O 2Y

3
∆G’ = 0 = ∆G°’ + RT Ln Keq
2e - Le calcul donne une valeur de Keq très élevée. Comment peut-on interpréter cette
valeur ? (2 points)
Equilibre fortement déplacé dans le sens de la formation des produits. Réaction quasi-totale dans le
sens 1
3 - L'expérience suivante est effectuée :
Dans un premier tube à essai, à t = 0, on place une concentration de [X] = 0,6 mM, dans
2 mL de tampon pH = 8, à T = 27°C, en présence d'un excès de CO2. On laisse évoluer
la réaction.
3a - Tracer en rouge la courbe [Y] = f(t) obtenue sur le graphe ci-dessous (à reproduire
sur votre copie). (1 point)
3b - Dans un deuxième tube à essai, à t = 0, on place une concentration de [X] = 0,6 mM, dans
1,95 mL de tampon pH = 8, à T = 27°C, en présence d'un excès de CO2, auquel on ajoute 50 µL de
solution de RubisCO à une concentration de 0,05 mg.mL-1.
Tracer, d'une autre couleur, sur le même graphe, la nouvelle courbe [Y] = f(t) obtenue dans ce
cas. (2 points)
3c - Quelle est la valeur A ( ?) demandée sur l'axe des ordonnées ? Donner sa signification.
Justifier votre réponse. (2 points)
[Y]max = 2x0,6 mM = 1,2 mM
C’est la valeur de produit formé quand la réaction atteint l’équilibre
3d - Si la valeur A demandée est atteinte au temps t sans Rubisco, à quel temps,
approximativement, sera-t-elle atteinte en présence de Rubisco ? (2 points)
1012 fois plus rapidement (valeur moyenne d’accélération de réaction par une enzyme), donc au
temps t/1012
3e - Une série de données expérimentales permet d'arriver au résultat suivant :
Pour 1 mg d'extrait chloroplastique, Vm = 180 µM.h-1 et Km vis à vis de X = 40 µM.
Expliquer à l'aide de graphiques correctement légendés, comment on peut obtenir
expérimentalement les valeurs Vm et Km d'une enzyme. (3 points)
Tracés de plusieurs graphes expérimentaux du type [Y]=f(t) à [X0] fixée, donnant une valeur de V0
pour chaque valeur de [X0]. Puis tracé du graphe 1/V0 = f(1/[X0]) pour déterminer les valeurs
1/Vm et -1/Km

4
3f - Donner la signification des abréviations Vm et Km, les définitions des termes Vm et Km dans
les cas généraux et ce que leur étude permet d'apporter à la connaissance de l'enzyme considérée.
(3 points)
Vm : vitesse maximale ; Km : constante de Michaelis
Vm = vitesse initiale maximale atteinte pour une concentration en S saturante
Km = [S] pour laquelle V0=Vm/2
Vm permet d’évaluer l’étape de catalyse de S en P (donc l’efficacité cinétique de E)
Km l’étaoe de fixation du S (est un indicateur de l’affinité de l’enzyme pour son substrat)
3g - Donner la définition de l'activité enzymatique et ses conditions d'application. (2 points)
AE = nombre de nmoles de S transformées par seconde, s’exprime en nkat, et est calculée pour un
volume donné de solution enzymatique (AE déterminée dans des conditions optimales de T et de
pH pour l’enzyme considérée)
3h - Calculer l'activité enzymatique de 1 mL de la solution de Rubisco utilisée pour le test. (2
points)
AE (1 mL) = 20 x AE (50 µL)
AE(50 µL) = 180 x 10-6 x 2 x 10-3 / 60 x 60 = 0,1 nmol.s-1 = 0.1 nkat
AE (1mL) = 2 nkat
3i - Donner la définition de l'activité spécifique. (2 points)
AS = AE (1mL) / masse de prot dans 1 ml de solution enzymatique
3j - Calculer l'activité spécifique de la solution de Rubisco utilisée. (2 points)
AS = 2 / 0,05 = 40 nkat.mg-1
4 - La Rubisco, isolée et purifiée sans précaution particulière est partiellement inactive.
Si l'enzyme, ainsi purifiée, est préalablement incubée avec du CO2 et du Mg2+, une
activité enzymatique comparable à celle obtenue in vivo est restaurée.
Comment pouvez vous expliquer qu'en mettant en présence la Rubisco avec du CO2,
avant de doser son activité, son activité soit maximale ? (2 points)
Le CO2 n’est pas seulement un substrat, c’est aussi un activateur
Partie III – métabolisme
(cours de C. Breton)
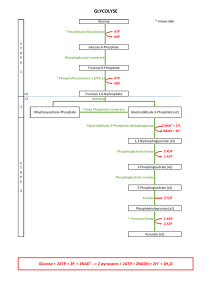
1 – La glycolyse (14 pts)
1a - Définir ce qu’est cette voie métabolique et sa localisation cellulaire
2 pt
Voie de conversion du glucose en pyruvate
1b – Quelles sont les réactions irréversibles de la glycolyse dans la cellule. Donner les
noms des réactants et les enzymes
6 pts
Etape 1 : Glucose + ATP Glucose-6-P + ADP Hexokinase (Glucokinase)
Etape 3 : Fru-6-P + ATP Fru-1,6-bis-P + ADP Phosphofructokinase (PFK)
Etape 10 : Phosphoénolpyruvate + ADP Pyruvate + ATP Pyruvate Kinase (PK)
1c – Quelles sont les enzymes de la glycolyse inhibées si le niveau énergétique de la
cellule est élevé ?
3 pts
HK, PFK et PK
(Si seules PFK et PK sont données, c’est bon aussi)

5
1d – Quels sont les trois principaux modes de régulation de l’activité des enzymes
métaboliques ?
3 pts
- régulation génétique (influe sur le nombre de molécules de E produites)
- régulation allostérique (activateur/inhibiteur qui influe sur la vitesse de la réaction)
- modification covalente (passage d’une forme d’enzyme on ' off) ex :
phosphorylation
Autres réponses acceptées
-disponibilité des S et co-enzymes
-retro-inhibition
2- Le destin du pyruvate (31 pts)
2a - Décrire brièvement (éventuellement à l’aide d’un schéma) les différentes étapes
mises en œuvre pour récupérer l’énergie métabolique contenue dans la molécule de
pyruvate, en condition aérobie. Ne pas détailler les réactions chimiques, mais indiquer la
localisation sub-cellulaire des réactions chimiques.
Les questions 2a+2b étaient sur 15 points
Les différentes étapes ont lieu dans la mitochondrie
- décarboxylation oxydative du pyruvate
avec production 1 acétyl-CoA, 1NADH,H+, 1 CO2
- le groupement acétate de l’acétyl-CoA est ensuite oxydé dans le cycle de Krebs.
Cette oxydation s’accompagne de la formation de 2 CO2 , 3 NADH,H+, 1 GTP
(ATP), 1 FADH2
- l’énergie contenue dans les coenzymes réduits est récupérée au niveau de la
chaîne respiratoire (membrane interne de la mitochondrie). Les coenzymes
réduits cèdent leurs deux électrons à un système de transporteurs qui, par une
cascade de réactions d'oxydo-réduction, amène ces électrons jusqu'à
l'accepteur final, qui est l'oxygène moléculaire. Ce transfert d’e- est couplé à
un gradient de protons à travers la membrane mitochondriale (gradient
électrochimique ; force proto-motrice). L’énergie de ce gradient sera récupérée
pour la synthèse d’ATP. Cette synthèse se fait au niveau d’un complexe
enzymatique appelé ATP synthase. La synthèse d’ATP couplée à ce transport
d’électrons est appelée Phosphorylation oxydative.
Production de 3 CO2, 1GTP, 4NADH, 1FADH2 par mole de pyruvate
2b - Donner le bilan net en ATP de l’oxydation d’une molécule de pyruvate (utiliser les
valeurs hautes de P/O) – Justifier votre réponse
Production nette 15 moles ATP / mole de pyruvate (calculé à partir du bilan 1GTP,
4NADH, 1FADH2)
Valeurs hautes : 1NADH,H+ = 3 ATP 1FADH2=2ATP
La justification pourra être donnée éventuellement dans la question précédente
2c - Quel est le devenir du pyruvate en condition anaérobie, chez l’homme ? Décrire
précisément la ou les réactions en jeu (noms et formules semi-développées des
réactants, nom de l’enzyme) et son intérêt pour la cellule.
3 pts
Pyruvate (CH3-CO-COO-) + NADH,H+ lactate (CH3-CHOH-COO-) + NAD+
Enzyme : lactate déshydrogénase (LDH)
Intérêt : Régénération du NAD+
2d – Donner les bilans nets en ATP provenant de l'oxydation totale d'une molécule de
glucose en aérobiose (donner uniquement la valeur haute) et en anaérobiose.
2 points
38 ATP en anaérobiose (36 c’est encore correct, voire 32, mais là on n’est plus dans les
valeurs hautes !!!)
2 ATP en anaérobiose
 6
6
1
/
6
100%