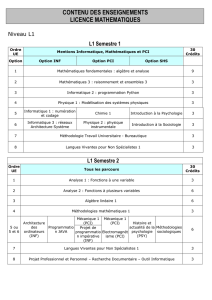
l`allergie a l`iode existe-t-elle

Utilisation des produits iodés 259
L’ALLERGIE A L’IODE EXISTE-T-ELLE ?
F. Leynadier, Hôpital Tenon, 4 rue de la Chine - 75970 Paris Cedex 20
INTRODUCTION
Les produits de contraste iodés (PCI) sont constitués de 3 atomes d’iode fixés sur 1
ou 2 cycles benzéniques. On en distingue aujourd’hui 2 types en fonction de leur osmo-
lalité (Tableau I) :
Le Lipiodol® (esters d’acides gras iodés) ne peut être inclus dans cette liste.
Tableau I
Produits de contraste iodés commercialisés en France
(GNP, 12ème éd., 2000, Editions du Vidal)
Caractéristiques DCI Nom commercial
Amidotrizoate Angiographine®
Gastrographine®
Radioselectan®
Ioxitalamate Telebrix®
Ionique basse osmolalité
(≈ 600 mosm.kg
-1
)Ioxaglate Hexabrix®
Iobitridol Xenetix®
Iohexol Omnipaque®
Ioméprol Iomeron®
Iopamidol Iopamiron®
Iopentol Ivepaque®
Iopromide Ultravist®
Ioversol Optiject®
Optiray®
Non ionique iso-osmolaire
(≈ 300 mosm.kg
-1
)Iodixanol Visipaque®
Ioniques hyperosmolaires
(1530 à 1860 mosm.kg
-1
)
Non ioniques basse osmolalité
(≈ 600 mosm.kg-1)

MAPAR 2001260
• Les PCI classiques sont des monomères (1 seul cycle benzénique) ioniques, c’est-à-
dire associés à un cation sodium ou méglumine (sucre). En milieu aqueux, ces PCI se
dissocient en deux particules, le cycle benzénique d’une part et, d’autre part, le
cation, ce qui double leur osmolalité. Pour atteindre une quantité d’iode suffisante
pour l’opacification radiologique, environ 300 mg d’iode.mL-1, ils doivent avoir une
hyperosmolarité d’environ 5 à 6 fois supérieure (1530 mosm.kg-1 à 1860 mosm.kg-1)
à celle du sang circulant (environ 300 mosm.kg-1) [17].
Il en résulte des effets secondaires comme une douleur au point d’injection, une sen-
sation de chaleur, des complications cardiovasculaires (hypotension, angor, etc) ou
rénales, pour ces dernières en raison d’un effet toxique direct sur les cellules épithé-
liales tubulaires.
• La nouvelle génération de PCI a une osmolalité identique ou au plus 2 fois supérieure
à celle du sang. Il peut s’agir de monomères non ioniques, ne nécessitant plus la
présence de cation, ou de dimères ioniques (2 cycles benzéniques reliés ensemble,
chacun portant 3 atomes d’iode) ce qui double la quantité d’iode par molécule. Ces
PCI entraînent moins d’effet secondaire dépendant de l’osmolalité par rapport aux
PCI classiques [6, 17]
Cependant les 2 types de PCI sont capables de provoquer des effets secondaires
dont l’expression clinique ressemble aux accidents d’allergie immédiate, c’est-à-dire
dans la forme la plus sévère au choc anaphylactique classique, lequel cependant est
provoqué par la présence d’immunoglobulines E (IgE) spécifiques d’allergènes
comme par exemple des aliments, des venins d’hyménoptères, etc. Il n’en est pas de
même pour les PCI, puisqu’à quelques exceptions près, la présence d’IgE spécifiques
n’a jamais pu être établie in vivo par tests cutanés à lecture immédiate ou, in vitro, par
dosage des IgE spécifiques ou par test d’histamino-libération. Par convention, ces acci-
dents sont nommés anaphylactoïdes afin de les distinguer de l’anaphylaxie classique
dépendante des IgE.
Il convient d’exclure de ce cadre le malaise ou la syncope vagale ainsi que l’attaque
de panique, ces incidents ou accidents survenant plus volontiers chez des sujets ayant
des antécédents identiques dans d’autres circonstances comme les prélèvements san-
guins, l’anesthésie locale, les douleurs ou émotions vives, etc.
1. REACTIONS DE TYPE ANAPHYLACTOIDE
On admet que sont considérés comme réactions anaphylactoïdes les tableaux com-
portant au moins un des symptômes suivants : urticaire, angio-œdème (œdème de
Quincke), sensation de striction laryngée avec ou sans stridor, gêne respiratoire ou sibi-
lance, hypotension (d’au moins 30 mmHg pour la pression systolique), syncope à
l’orthostatisme, troubles du rythme ou arrêt cardiaque associés à une urticaire et/ou à
un œdème de Quincke.
Ces symptômes doivent apparaître moins de 20 minutes après le début de la perfu-
sion et leur gravité est considérée comme :
• Bénigne : s’il s’agit d’une urticaire et/ou d’un œdème de Quincke ne nécessitant pas
de traitement ;
• Modérée : si un traitement s’impose ;
• Sévère : en cas d’œdème laryngé, de bronchospasme ou d’hypotension rendant ou
non l’hospitalisation indispensable.
L’incidence est diversement appréciée dans la littérature. Le tableau II montre la
synthèse des données les plus récentes (Lieberman et Seigle, 1999) (Tableau II) [17].

Utilisation des produits iodés 261
L’étude de Lang et coll [13] est sans doute la plus intéressante car elle porte sur une
série consécutive de 5393 patients ayant un scanner avec PCI. Il s’agit d’hommes dans
51 % des cas et de femmes dans 49 % (NS). On note 73 (1,39 %) incidents ou accidents
de type anaphylactoïde, plus souvent chez les femmes (70 %). En particulier, les réac-
tions les plus sévères touchent 21 fois sur 22 des femmes, le risque relatif («odd ratio»)
atteignant 21,77 (IC 95 % : 3,13 - 435,12).
Les facteurs de risques sont assez bien déterminés : la notion d’allergie et d’asthme
est classique bien qu’elle ne repose que sur une seule étude contrôlée [6, 17] qui com-
pare 50 sujets ayant eu une réaction anaphylactoïde à 50 témoins. Les allergiques, définis
par des tests cutanés positifs et/ou la présence d’IgE spécifiques pour les pneumallergè-
nes, sont, dans cette étude, 2 fois plus nombreux dans le groupe des sujets ayant eu une
réaction.
Les traitements par bêta-bloquant ou les insuffisances cardiaques sévères représen-
tent aussi un risque assez bien démontré, comme l’est aussi un antécédent de réaction
anaphylactoïde à un PCI. Dans ce cas d’ailleurs, la récidive n’apparaît que chez 35 %
des patients au maximum.
2. HYPOTHESES PHYSIOPATHOLOGIQUES
Dès les premières descriptions des chocs aux PCI, l’hypothèse d’une allergie
dépendante des IgE a été évoquée. Comme elle ne pouvait être clairement démontrée,
d’autres mécanismes ont été envisagés incriminant l’hyperosmolarité des PCI. Cepen-
dant la persistance de ces accidents, bien que moins fréquents mais parfois plus graves,
avec les nouveaux PCI remettait en cause le rôle de l’hyperosmolarité [17].
Il est démontré que tous les PCI provoquent une libération d’histamine et de trypta-
se par les mastocytes et les basophiles mais sans libération de médiateurs néoformés
(dérivés de l’acide arachidonique). Cet effet est d’ailleurs sans relation avec la présen-
ce d’iode puisqu’il persiste de façon identique avec le diatrizoate non iodé. Les atopiques,
c’est à dire les malades ayant une allergie de type immédiat avec rhinite, asthme, der-
matite atopique, etc, ont un effet histaminolibérateur plus marqué, sans doute en raison
de l’état de «pré-activation» de leurs cellules par l’interleukine 3.
Parmi les hypothèses, on a imaginé un rôle direct avec un récepteur membranaire
ou encore l’activation du complément avec génèse d’anaphylatoxines. En fait, la plus
vraisemblable fait intervenir la facilité des PCI de s’agréger et ainsi de se fixer sur des
immunoglobulines membranaires comme les IgG ou les IgE par exemple. Le travail de
Lasser [14] montre que chez des rats, l’injection de monomère provoque en 1 à 2 minu-
tes une chute tensionnelle importante qui se corrige ensuite en quelques minutes. En
revanche, des dimères ne déterminent pas cette chute tensionnelle. Cet auteur explique
l’histaminolibération par la présence d’agrégats de PCI : lors d’une injection rapide,
ces agrégats, en trop grande quantité, ne seraient pas capables de se fixer (liaison non
spécifique) de façon satisfaisante sur les IgE membranaires alors qu’une injection plus
lente faciliterait au contraire cette fixation. Cet auteur assimile les PCI à des «pseudo-
Réactions Hyperosmolaires Nouveaux produits
Toutes confondues 12,7% 3,1%
Sévères 0,22% 0,044%
Urticaire 3,16% 0,47%
Tableau II
Incidences des effets secondaires des PCI

MAPAR 2001262
antigènes». Il est établi que dans les réactions anticorps/antigènes, en particulier dans
l’histaminolibération, un excès d’antigènes ou au contraire une quantité très insuffi-
sante, n’induit aucune réaction, laquelle ne survient que pour des taux d’antigènes à
peu près équivalents à ceux des anticorps (classique courbe en «cloche» des réactions
antigènes/anticorps). Pour intéressante que soit cette hypothèse, qui bien entendu ne
fait pas intervenir des IgE spécifiques des PCI, il reste à expliquer l’absence de libéra-
tion de médiateurs néoformés, qui sont pourtant libérés en grande quantité lors de
l’activation des mastocytes et des basophiles par des antigènes classiques.
L’allergie immédiate aux PCI dépendante des IgE n’a fait l’objet que de quelques
rares publications sur des séries insuffisantes. Une étude récente de Mita et coll [21] a
cependant inclus 55 patients qui avaient présenté une réaction anaphylactoïde lors de
l’utilisation d’ioxaglate (Hexabrix®) et 31 témoins ayant reçu le même PCI sans effet
secondaire. Par Elisa et radio-immunologie, ces auteurs ne trouvent des IgE spécifi-
ques de l’ioxaglate que chez 47,1 % des malades ayant eu une réaction anaphylactoïde
et chez aucun des 31 témoins.
Par radio-immuno-essai, ces auteurs montrent que la pré-incubation du sérum con-
tenant des IgE spécifiques avec 1 mg.mL-1 d’ioxaglate, fait disparaître 81 % de ces IgE
spécifiques (liaison IgE/ioxaglate). En revanche, avec la même technique, aucune «con-
sommation» des IgE spécifiques n’est observée si le sérum est incubé avec un autre
PCI, l’iohexol (Omnipaque®), dont la structure principale est différente de celle de
l’ioxaglate, mais qui comporte comme tous les PCI des atomes d’iode dans cette struc-
ture. Ainsi, il est possible de conclure que les IgE spécifiques reconnaissent la structure
globale de la molécule et non l’iode fixée sur cette structure.
Ce résultat correspond aux données déjà établies pour un modèle plus classique
qu’est l’allergie immédiate aux bêta-lactamines ou aux curares : par exemple, les tests
cutanés à lecture immédiate positifs après un choc anaphylactique au suxamethonium
(Célocurine®) sont souvent négatifs pour des curares comme le pancuronium (Pavu-
lon®) dont la structure globale est différente mais qui porte, comme la Célocurine®,
2 fonctions ammonium quaternaire [15, 16]. De même, est-il habituel d’avoir une ex-
cellente tolérance des céphalosporines chez des sujets ayant eu une anaphylaxie à la
pénicilline G, bien que ces deux types d’antibiotiques aient le même noyau bêta-
lactame. On peut là aussi conclure qu’un anticorps reconnaît très spécifiquement un
épitope antigénique au sein d’une molécule et qu’entre deux structures chimiques
paraissant proches, le site épitopique peut être totalement différent.
4. REACTIONS TARDIVES AUX PCI
En 1986, Panto [23] rapportait le premier cas de toxidermie survenant plusieurs
heures après injection de PCI. Le tableau clinique avec lésions cutanées maculo-papu-
leuses ou morbiliformes est proche de celui si souvent observé avec les amino-pénicillines
(amoxicilline, etc) pour lesquelles le diagnostic repose sur des tests épicutanés (patch-
tests) [18, 25]. Lorsque des biopsies pratiquées sur des tests cutanés positifs aux
amino-pénicillines sont effectuées, on observe un infiltrat inflammatoire dermique avec
lymphocytes et éosinophiles associé à une spongiose intradermique et une acan-
those [26]. Des travaux récents confirment qu’il s’agit bien d’une réaction immunolo-
gique puisque dans le sang périphérique le taux de lymphocytes T activés (HLA DR+)
exprimant le Cutaneous Lymphocyte-Associated Antigen s’accroit pendant la phase
aiguë de la toxidermie à l’amino-pénicilline [3, 4, 7].
Bien que rares, les réactions tardives aux PCI sont très instructives car elles mon-
trent que l’iode n’intervient nullement dans la réaction allergique. Par exemple,

Utilisation des produits iodés 263
Courvoisier et Bircher [9] montrent que des tests épicutanés sont très positifs pour l’io-
pamidol (Iomapiron®) chez un malade ayant eu une toxidermie à 2 reprises après
utilisation de ce PCI. Les tests épicutanés étaient aussi très positifs pour deux autres
PCI, l’iohexol (Omnipaque®) et l’ioversol (Optiject®), qui n’avaient jamais été utilisés
chez ce patient. Par contre, ces tests étaient négatifs avec l’amidotrizoate (Radioselec-
tan®), différent des précédents par sa structure, notamment par les chaines latérales. Ce
même travail montre que les tests épicutanés à la povidone iodée (Bétadine® au 1/10
ème
)
,
au Lugol, à la teinture d’iode et au triiodométhane (Iodoform) sont négatifs chez ce
patient. La publication de Gall et coll [10] rapporte l’observation d’un patient ayant eu
une toxidermie les deux fois où il avait reçu de l’iopamidol (Iomapiron®). Là encore
les tests épicutanés étaient positifs pour ce PCI mais aussi pour l’ioméprol (Iomeron®)
et l’iopromid (Ultravist®) mais négatifs pour deux autres PCI dont l’un a pu être réad-
ministré sans effet secondaire. Les tests étaient aussi négatifs avec l’iodure de potassium.
Ainsi, ces observations confortent le rôle potentiellement immunologique des PCI
et disculpent clairement la responsabilité de l’iode.
4. ALIMENTS IODES
En dehors des médicaments, l’iode se retrouve dans de nombreux aliments (pois-
sons, fruits de mer, etc) mais plus encore dans certains additifs alimentaires provenant
d’algues marines comme les alginates ou les carraghénates [5, 9].
Les chocs anaphylactique aux aliments sont dus à des IgE spécifiques d’une ou de
plusieurs protéines, et plus spécifiquement d’épitopes linéaires ou conformationnels
constitués de 10 à 20 d’acides aminés de ces protéines [27]. Il faut noter que certaines
protéines comme la parvalbumine de la morue est un allergène fréquent dont la présen-
ce dans d’autres espèces de poissons, explique nombre d’allergies croisées entre
poissons [27]. Pour les crustacés, dont la crevette, la protéine allergisante la plus habi-
tuelle est la tropomyosine trouvée dans d’autres espèces de crustacés mais aussi dans
les acariens domestiques (Dermatophagoïdes pteronyssinus, etc) expliquant la relative
fréquence (environ 8 %) de tests cutanés positifs à la crevette chez des sujets souffrant
d’allergie aux acariens. Ces données n’ont évidemment aucune relation avec la pré-
sence d’iode.
D’ailleurs, les Japonais, grands consommateurs d’iode, n’ont pas plus fréquem-
ment d’accident aux PCI [12]. Inversement aucune donnée de la littérature ne montre
de complications de type allergique liées à l’iode alimentaire chez des sujets ayant eu
un choc anaphylactoïde à un PCI, alors même qu’ils consomment des crèmes glacées
très riches en alginate ou en carraghénate.
5. MEDICAMENTS IODES
Les halogénides (bromides, iodides) sont exceptionnels : cette pathologie cutanée
chronique comporte des placards marrons ou violacés, végétants et pustuleux survenant
lors de traitements par des médicaments comme l’amiodarone par exemple. Un méca-
nisme allergique n’est pas en cause. La physiopathologie en demeure très
obscure [1, 8, 20].
Presque aussi rares sont les observations d’allergie immédiate impliquant des anti-
septiques comme la polyvidone iodée (Bétadine®) [22, 28] : dans ces cas, la polyvidone
non iodée elle-même, paraît directement en cause avec positivité des tests cutanés à
cette substance [11, 19], mais négativité avec le Lugol, l’iodure de potassium ou l’iopa-
midol.
 6
6
 7
7
1
/
7
100%