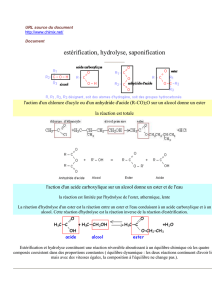
Esters et savons

Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 157
Chapitre n° 11 : ESTERS ET SAVONS
I) Généralités sur les esters
1)
:
Définition
Les molécules d'ester contiennent le groupe d'atomes :
:
Nous nous limiterons le plus souvent à des radicaux alkyle (R et R'
sont des chaînes hydrocarbonées saturées, dérivées des alcanes).
Ce sont des composés très répandus à l'état naturel.
Exemples : arômes des fruits, parfums des fleurs, corps gras ...
On peut déterminer leur formule brute :
R – COO – R’ ⇔ CpH2p + 1 – COO – CqH2q + 1
- le nombre d'atome de carbone est : p + q + 1
- le nombre d'atome d'hydrogène est : 2.p + 1 + 2.q + 1 = 2.(p + q + 1)
- le nombre d'atome d'oxygène est : 2
En posant p + q + 1 = n on trouve pour formule brute des esters dérivés des hydrocarbures
saturés : CnH2nO2
2) Obtention
L'obtention est possible en faisant réagir entre eux, l'acide carboxylique R – COOH et l'alcool
R’ – OH.
:
On obtient un ester et de l'eau suivant la réaction équilibrée :
R – COOH + HO – R’
←
→
R – COO – R’ + H2O
Les trois caractéristiques de cette réaction, appelée réaction d'estérification, sont :
- réaction lente,
- réaction limitée.
- réaction athermique.
3) Nomenclature
* On part du nom de l'acide carboxylique dont ils dérivent (groupe R – C), on supprime le mot
acide, on remplace ensuite le suffixe oïque du nom de l'acide par oate.
:
* On fait suivre ce nom de de, puis du nom déduit du groupe résiduel R'.
ex. :
éthanoate d'éthyle
ex. :
propanoate de méthyle
ex. :
éthanoate de méthyle
ex. :
méthanoate d'éthyle
ex. :
3-éthylpentanoate de
2,2-diméthylpropyle
groupe fonctionnel
ester
groupe
carbonyle

Esters et savons
Page 158 Christian BOUVIER
II) Estérification et hydrolyse
1)
:
Etude théorique
a) Equilibre chimique :
:
La réaction d’estérification est la transformation spontanée conduisant à la formation d’un
ester R – COO – R’ et H2O, à partir d’acide carboxylique R – COOH et d’alcool R’ – OH.
On peut écrire : R – COOH + HO – R’
←
→
R – COO – R’ + H2O
Les réactions d’estérification sont lentes, limitées et athermiques.
Si on ajoute de l'eau à un ester, il y a en partie régénération de l'acide et de l'alcool.
La réaction d’hydrolyse d’un ester est la réaction inverse de la réaction d’estérification.
D'où l’écriture : R – COO – R’ + H2O
←
→
R – COOH + HO – R’
De même, les réactions d’hydrolyse sont lentes, limitées et athermiques.
b) Etat d'équilibre :
Les réactions chimiques d’estérification ou
d’hydrolyse d’un ester conduisent à un état
d’équilibre.
On considère un mélange
d’une quantité
nester, neau, nacide et nalcool, constituant un
volume total V de mélange.
La réaction d’estérification s’écrit :
R – COOH + HO – R’
←→
R – COO – R’ + H2O
Nous admettrons que la constante
d’équilibre Kr de la réaction s'écrit :
Kr =
éq,alcooléq,acide
éq,eauéq,ester n.n n.n
2) Contrôle des paramètres de la réaction
a) Contrôle de la vitesse de réaction :
:
Pour augmenter la vitesse de formation d’un
ester au cours d’une estérification ou d’un
acide carboxylique au cours d’une hydrolyse,
on peut augmenter la température ou utiliser
un catalyseur
Attention : L’augmentation de la température ou la présence d’un catalyseur ne modifient
pas l’état final du système. Il permet simplement de l’atteindre plus rapidement.
.
b) Contrôle de l’état final :
Le rendement γ d’une transformation chimique est égal au taux d’avancement final τ,
exprimé en %, de la réaction associée.
On rappelle la définition τ = max
f
x
x
= γ (en %)
Pour augmenter le rendement d’une réaction d’estérification, on peut :
- utiliser l’un des réactifs en excès dans l’état initial ;
- ajouter l’un des réactifs lorsque l’état d’équilibre est atteint ;
- éliminer l’un des produits au cours de la transformation.

Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 159
3) Mécanisme de l'estérification
a) Présentation :
:
On considère le mécanisme réactionnel de l'estérification en présence d'acide sulfurique
qui catalyse la réaction.
En utilisant de l'oxygène 18 (18
8O), on a pu mette en évidence que l'oxygène de l'eau
formée (H2O) provient de l'acide (R – COOH) et non de l'alcool.
b) Mécanisme :
H2SO4
Soit R – COOH + HO – R’
←
→
R – COO – R’ + H2O
Ce mécanisme se décrit en cinq :
Première étape
: protonation du groupe carbonyle :
L'ion formé est stabilisé par mésomérie :
Deuxième étape
: attaque nucléophile de l'alcool sur le site électrophile de l'acide
carboxylique protoné :
Troisième étape
: transfert du proton (H+) du groupe issu de l'alcool sur un des groupes
hydroxyles (réaction acide-base interne ou prototropie) :
Quatrième étape
: cinétiquement limitante, c'est le départ d'une molécule d'eau (H2O) :
Cinquième étape
: simple déprotonation (restitution du catalyseur) :

Esters et savons
Page 160 Christian BOUVIER
4) Obtention pratique
Valeurs de quelques températures d'ébullition :
:
Corps (nom usuel) (nom systématique) θéb (° C)
alcool éthylique éthanol 80
alcool propylique propan-1-ol 97
acide formique acide méthanoïque 100
acide acétique acide éthanoïque 116
formiate d'éthyle méthanoate d'éthyle 54
acétate d'éthyle éthanoate d'éthyle 77
acétate de propyle éthanoate de propyle 102
a) Préparation de l’acétate d’éthyle :
- Dispositif :
On a d'un tube à essais fermé par un bouchon en caoutchouc, surmonté par un tube de
verre étroit. Le tube à essais contient un mélange d'éthanol, d'acide acétique et d'acide
sulfurique (catalyseur).
Le mélange est maintenu à une température de l'ordre de 70 ° C dans un bain-marie.
* Le grand tube de verre étroit refroidi par l'air permet la condensation des vapeurs qui
sortent du tube à essais, et empêche la "fuite" des réactifs : chauffage à reflux
* On chauffe pour que le mélange évolue plus vite. .
* L'acide sulfurique est un catalyseur de la réaction dont l'effet s'ajoute à celui du
chauffage.
- Mise en évidence de l’ester :
On verse le mélange réactionnel dans de l'eau salée : l'éthanol est soluble dans l'eau
ainsi que l'acide acétique. L'acétate d'éthyle est insoluble dans l'eau, il forme une
couche qui surnage (moins dense que l'eau salée) : cette opération s'appelle le
relargage. On peut procéder au décantage des produits dans une ampoule à décanter.
On constate une odeur de fruit de l'acétate d'éthyle.
- Perfectionnement du montage :
Si on opère sur des quantités plus grandes de produits, le réfrigérant à air ne suffit plus,
il faut utiliser un réfrigérant à eau pour le chauffage à reflux (ballon, réfrigérant à eau).
b) Préparation du méthanoate d’éthyle :
Le méthanoate d'éthyle (formiate d'éthyle) est obtenu par réaction entre l'acide
méthanoïque (formique) et l'alcool éthylique. Compte tenu des valeurs des températures
d'ébullition, il est possible de distiller le formiate d'éthyle à mesure qu'il se forme (ballon,
chauffe-ballon, erlenmeyer, colonne de Vigreux, réfrigérant à eau et thermomètre).
- Les pointes qui hérissent la colonne de Vigreux permettent d'améliorer la séparation des
vapeurs qui sortent du ballon.
- En "tête" de distillation on recueille le produit le plus volatil, donc le formiate d'éthyle.
- On identifie le produit obtenu par son odeur (odeur de rhum) et par sa température
d'ébullition (l'odeur d'éther qui peut apparaître est liée à la présence d'éthanol
déshydraté en éther).
- peut-on utiliser ce montage pour préparer l'acétate d'éthyle ou l'acétate de propyle ?

Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 161
III) Autres esters
1)
:
Les corps gras
Le glycérol ou propane-1,2,3-triol est un trialcool.
:
Un acide gras est un acide carboxylique dont le nombre d'atomes de carbone supérieur à 2
(et le plus souvent un nombre pair).
Les matières grasses ou lipides (huiles, beurres, graisses ...) sont essentiellement des
mélanges de triesters du glycérol. Une molécule de triester provient de l'action de trois
molécules d'acides gras, saturés ou non, identiques ou non, sur le glycérol.
Exemples :
- avec l'acide butanoïque (acide butirique) on obtient la butirine.
- avec l'acide stéarique (saturé) C17H35COOH on obtient la stéarine
- avec l'acide oléique (insaturé : Z-octadéc-9-ènoïque) C17H33COOH on obtient l'oléine.
2) Les polyesters
Le glycol ou éthane-1,2-diol est un dialcool.
:
- L'action de l'acide benzène-1,4-dioïque sur le glycol conduit à de longues chaînes
carbonées, dont les maillons sont liés les uns aux autres par des groupes ester. Les
diverses macromolécules, obtenues ainsi par polycondensation, constituent un mélange
thermoplastique (qui ramollit par chauffage) qu'on peut étirer en fils : c'est le Tergal.
- L'action de l'acide benzène-1,2-dioïque sur le glycérol conduit à des résines
glycérophtaliques constituées de chaînes moléculaires à trois dimensions liées entre elles
par des groupes ester.
IV) Etude de la saponification d'un ester
1)
:
Aperçu historique
Les origines du savon remontent probablement à l'époque gauloise, à laquelle on fabriquait
déjà une pâte à base de cendre et de suif. Vers le VIII° siècle apparaît le savon à base
d'huile végétale. A partir du XII° siècle, ce procédé se développe à Marseille.
:
L'industrie du savon retrouve un nouvel essor avec l'exploitation du procédé Leblanc pour la
fabrication de la soude. En 1823, les travaux de Chevreul sur les corps gras donnent la
première théorie exacte de la saponification.
Grâce à l'utilisation de nouvelles huiles, la production du savon progresse en qualité et en
quantité (120 000 t à Marseille en 1900).
Après 1930, le savon subit la concurrence des poudres à laver, puis des détergents
synthétiques, liés à l'évolution des tissus et des techniques de lavage.
2) Saponification d’un ester
Nous avons étudié l'estérification et l'hydrolyse en milieu acide.
:
Nous allons traiter un ester par une base forte.
Soit la réaction de la soude (NaOH) concentrée (10 mol.L−1) sur du benzoate d'éthyle
(C6H5COOC2H5). En 15 min environ, nous observons la formation de benzoate de sodium
suivant la réaction :
C6H5 – COO – C2H5 + Na+ + OH− → C6H5 – COO− + Na+ + C2H5 – OH
R – COO – R' + Na+ + OH− → R – COO− + Na+ + R' – OH
Cette réaction peut être comparée à l'hydrolyse d'un ester : elle conduit à un alcool mais, en
milieu basique, il se forme un ion carboxylate et non un acide carboxylique.
La saponification d'un ester est totale et exothermique (quelques dizaines de kJ.mol−1).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%