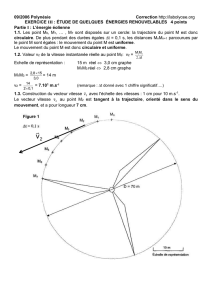
Bac blanc

1
BACCALAUREAT « BLANC »
CLASSE DE TS2 SESSION 2013
PHYSIQUE-CHIMIE
Série S
DUREE DE L’EPREUVE 3h30. – COEFFICIENT : 6
L’usage de la calculatrice est autorisé.
Le candidat doit traiter tous les exercices qui sont indépendants les uns des
autres :
- Etude de l'acide valérique
- Ondes dans un liquide
- Mouvements dans les champs

2
O
OH
O
OH
O
OH
Exercice de chimie: Etude de l'acide valérique et de ses dérivés.(9 points)
Document 1:
L'acide valérique est présent dans la plante valériane
abondante dans le Massif-Central.
Les racines de valériane recèlent des vertus capables d'améliorer
la qualité du sommeil en réduisant le temps d'endormissement
et en augmentant la durée du sommeil.
Son utilisation n'entraine pas d'accoutumance ni certains effets
secondaires au réveil comme peuvent le faire les somnifères.
D'autres vertus sont attribuées à la valériane comme celle
de diminuer la fréquence des crises d'épilepsie lorsqu'elle
accompagne un traitement anti-épileptique.
La valériane est couramment utilisée dans le sevrage tabagique.
L'absorption quotidienne de gélules d'extraits secs de racines de
valériane a la particularité de donner un mauvais goût à la cigarette.
La valériane officinale s'appelle aussi "herbe aux chats" car ces animaux sont attirés par son
odeur : elle provoquerait chez eux un état proche de l'euphorie éthylique ou cannabique …
Document 2:Oxydation des alcools.
L'oxydation ménagée d'un alcool primaire donne un aldéhyde. Si l'oxydant est en excès, on obtient
un acide carboxylique.
L'oxydation ménagée d'un alcool secondaire donne une cétone.
On identifie un aldéhyde par un test positif à la DNPH (dinitrophénylhydrazine) et par un test
positif à la liqueur de Fehling.
Une cétone donne une test positif à la DNPH et un test négatif à la liqueur de Fehling.
Document 3 :Acide valérique et ses dérivés étudiés.
●Acide valérique.
Propriétés chimiques:
A 20 °C, sa solubilité dans l'eau est 33 g / L. Température de fusion: θf = - 32 °C .
Température d'ébullition: θeb = 186°C . Densité à 20°C : d = 0,93.
L'acide valérique est corrosif. M(acide valérique) =102g.mol-1.
Odeur forte de sueur et de transpiration.
●Acide isovalérique.
C'est un acide organique présent dans diverses plantes telles que valériane, angélique, houblon,
tabac, dans le fromage en décomposition, dans la transpiration des pieds (odeur de très vieille
chaussette sale…) et dans l’urine au cours de certaines maladies comme la variole ou le typhus.
Présent dans les urines du chat, ce composé sert au marquage du territoire de l'animal.
●Acide valérique "actif ".
Liquide clair avec l'odeur piquante semblable au fromage de roquefort âcre, mais il a un goût
fruité plaisant lorsqu'il est dilué.

3
NH2OH
O
O
OH
●Acide pivalique.
C'est un solide à température ambiante de densité d=0,91.
●Norvaline.
Possède 2 valeurs de pKA : 2,36 et 9,76.
1-Recherches d'isomères de l'acide valérique.
On dispose de 4 flacons A,B,C et D contenant un acide pur parmi les acides valérique, valérique
"active", isovalérique et pivalique.
Pour chaque flacon, on procède à des analyses afin d'identifier la substance.
Voici les 4 spectres de RMN correspondant aux 4 composés (le signal du proton H de COOH n'est
pas représenté):
Flacon A
Flacon B

4
Flacon C
Flacon D
a- Ecrire les formules semi-développées de l'acide valérique et de ses 3 isomères.
Donner les noms de ces 4 molécules dans la nomenclature officielle.
b-Associer à chaque spectre une molécule. On justifiera clairement les réponses données.
2-Stéréoisomérie et synthèse.
Parmi les isomères de l'acide valérique, un acide possède 2 stéréoisomères de configuration.
a1-Dessiner ces 2 stéréoisomères en représentation de Cram (bien mettre en évidence leur
différence) .
a2-Comment nomme-t-on de façon générale de tels isomères?
b-Quel alcool donne par oxydation l'acide valérique ?
Ecrire la formule et donner le nom de cet alcool.
3-Recherche de la pureté en acide valérique.
Dans un des flacons précédents, on prélève précisément un volume V0 = 2,00 mL d'acide valérique
HA supposé pur que l'on verse dans une fiole jaugée de 1000 mL.
On complète avec de l'eau distillée puis on agite afin de préparer une solution S1.
Un volume V1= 10,0 mL de S1 est pipeté et versé dans un bécher B1.
Afin d'immerger les électrodes d'un pH-mètre, on rajoute environ 20 mL d'eau dans ce bécher B1.
On titre ensuite la solution d'acide valérique par une solution d'hydroxyde de sodium (soude) à la
concentration molaire c2= 2,0.10-2 mol.L-1.
Courbe de titrage obtenue avec les pourcentages des espèces :

5
100x
n
n
=d 0
2
a- Faire un schéma annoté du montage.
b- Ecrire l'équation de la réaction servant de support au titrage.
c1-Rappeler la définition de l'équivalence pour un titrage acido-basique.
c2- Déterminer graphiquement le volume équivalent Véq.
d-Calculer la quantité n1 d'acide titré.
e-En déduire la quantité n2 d'acide présente dans toute la solution S1.
f-Quelle serait la quantité n0 d'acide valérique si tout l'acide contenu dans V0 était pur?
g- Calculer le degré d de pureté de cet acidité en % telle que :
Est-ce que l'acide valérique dans le flacon est pur ?
i- Déterminer la valeur du pKA du couple de l'acide valérique. Justifier la méthode choisie.
j- Est-ce que l'affirmation suivante est exacte ici :
"A la demi-équivalence, le pH est égal au pKA" ?
4-La norvaline.
a-Ecrire la formule semi-développée de la norvaline et préciser les groupes caractéristiques.
b- A quelle famille appartient cette molécule?
c- Ecrire les 3 formules semi-développées des espèces qui prédominent selon la valeur du pH.
L'une de ces molécules est appelées "amphion" ou "zwitterion". Préciser laquelle et indiquer
l'origine de ces mots.
d-Tracer le diagramme de prédominance de la norvaline.
e- Quelle est l'espèce prédominante lorsque pH= 10?
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%