POSSIBILITÉS ACTUELLES D`INTERVENTION GÉNÉTIQUE

[J. Suaudeau] POSSIBILITÉS ACTUELLES D'INTERVENTION GÉNÉTIQUE
JACQUES SUAUDEAU
“POSSIBILITÉS ACTUELLES D'INTERVENTION
GÉNÉTIQUE
DANS LE DOMAINE DES MALADIES HÉRÉDITAIRES”
I - INTRODUCTION
Les maladies d'origine génétique sont pourvoyeuses d'une part non négligeable de la
souffrance humaine. On calcule qu'environ 4% (2-5%) de tous les nouveaux nés sont affectés
d'un désordre génétique ou de malformations congénitales. La plupart des désordres d'origine
génétique sont individuellement rares, mais c'est par leur nombre qu'ils pèsent lourdement sur
les systèmes de santé. On connaît en effet plus de 4000 maladies héréditaires, résultant d'un
défaut monogénique, et l'on manque d'un traitement efficace pour la plupart d'entre elles.
Avec l'avènement de la "révolution génétique", de nombreux chercheurs se sont mis à rêver de
soigner ces maladies héréditaires en introduisant des gènes normaux dans l'organisme des
patients, qui s'ajouteraient ou se substitueraient aux gènes pathogéniques, ou en restaurant la
fonction des gènes déficients. Grâce aux progrès des techniques de localisation et de clonage
1 / 42

[J. Suaudeau] POSSIBILITÉS ACTUELLES D'INTERVENTION GÉNÉTIQUE
des gènes d'une part, et à la construction de vecteurs recombinants capables de transporter
ces gènes, ce rêve est sorti de l'utopie, dans les années 70, pour passer dans la réalité
thérapeutique à partir de 1990, sous le nom de "thérapie génique".
Cette méthodologie ne peut s'appliquer qu'à des maladies génétiques simples, dues à une
aberration intéressant une séquence précise et bien localisées sur l'ADN du sujet. Les maladies
à caractère héréditaires plus complexe comme l'asthme, le diabète, les épilepsies, les maladies
cardiovasculaires, où l'on trouve une association de différentes anomalies génétiques et de
facteurs liés à l'environnement, ne peuvent bénéficier d'une cure directe par thérapie génique.
Celle-ci peut toutefois aider dans la thérapie de ces maladies en apportant à l'organisme
certains gènes exprimant des facteurs thérapeutiques, tels que le VEGF (vascular endothelial
growth factor ) ou le
GAD ( gl
utamic acid decarboxylase
).
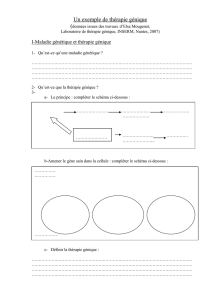
A - LES MOYENS DE LA THÉRAPIE GÉNIQUE
La thérapie génique des maladies génétiques peut se faire aujourd'hui en ayant recours à une
des quatre approches développées dans le cadre de la génétique moléculaire:
.La première est celle de l'apport. C'est elle qui a été utilisée dès le début, et c'est elle qui
continue à être prépondérante. Il s'agit d'apporter à l'organisme des "copies" normales du gène
dont la mutation est responsable de la maladie. En pratique on a recours pour ce faire à un
vecteur (viral), ou à une méthode de transfection non virale (électroporation) pour apporter dans
les cellules du sujet une séquence d'ADN homologue de la séquence normale du gène
intéressé (ADN complémentaire ou cDNA).
2 / 42

[J. Suaudeau] POSSIBILITÉS ACTUELLES D'INTERVENTION GÉNÉTIQUE
.La seconde approche est celle de la réparation du gène au niveau de sa séquence mutée.
Elle a recours aux techniques dérivées de la "recombinaison homologue" (ciblage génique ou
gene targeting
). L'utilisation des oligonucléotides chimériques et, plus récemment du trans-épissage de l'ARN
par splicéosome (
spliceosome-mediated trans-splicing
) se rattache à cette catégorie.
.La troisième approche est très récente et consiste à remplacer le gène muté, en faisant appel
à des zinc-finger
nucléases .
.Une quatrième approche consiste à mettre au silence le gène muté lorsque le produit du
gène muté est toxique ou s'accumule dans les tissus. Elle faisait appel aux thérapies
"anti-sens", peu effectives, mais aujourd'hui cette stratégie a été révolutionnée par la
découverte des ARN interférents.
B - LES DEUX TYPES DE THÉRAPIE GÉNIQUE
On distingue deux types de thérapie génique:
- la thérapie génique cellulaire somatique, ou thérapie génique somatique, qui ne réalise des
transferts de matériel génétique que dans les cellules ordinaires ("somatiques") du corps. Elle
cherche à corriger le défaut génétique de la personne traitée sans intervenir sur la transmission
du défaut génétique à la descendance de la personne traitée. La thérapie génique somatique
est mise en oeuvre après la naissance. On a proposé de la débuter
in utero
, mais cette proposition n'a pas été jugée acceptable, jusqu'à présent.
3 / 42

[J. Suaudeau] POSSIBILITÉS ACTUELLES D'INTERVENTION GÉNÉTIQUE
- la thérapie génique cellulaire germinale, ou thérapie génique germinale, qui vise à corriger le
défaut génétique non seulement dans les cellules somatiques du corps, mais aussi dans les
cellules germinales (d'où proviennent les gamètes ou cellules sexuelles), afin d'empêcher la
transmission de ce défaut génétique aux descendants. La thérapie génique germinale se
réalise sur l'embryon précoce au stade des premières divisions de segmentation ou sur les
gamètes (ovocytes et surtout spermatozoïdes). Les législations actuelles l'interdisent et les
bioéthiciens la condamnent car, en cas d'erreur dans la correction du défaut génétique en
question, celle-ci serait transmise aux descendants.
Les interventions géniques d'amélioration ("genetic enhancement") ne font pas partie de la
thérapie génique au sens propre du terme et ne seront pas envisagées ici. Elle ne visent pas en
effet à traiter une pathologie mais à améliorer les conditions physiques de telle ou telle
personne. Il s'agit d'une proposition d'eugénisme positif qui dépasse d'ailleurs les capacités
actuelles des transferts de gènes.
C - LES DEUX STRATÉGIES DE LA THÉRAPIE GÉNIQUE
Il y a deux stratégies principales dans la thérapie génique: - la stratégie ex vivo dans laquelle
des "cellules cibles" sont prélevées chez le patient et mises en culture
in vitro
pour y recevoir le gène désiré par transfert
ex vivo
, avant d'être réimplantées chez le patient en tant que cellules génétiquement modifiées
(autogreffe de cellules génétiquement modifiées). Il s'agit là de la forme la plus efficace et la
plus sûre de thérapie génique, mais elle n'est applicable que si les cellules réinjectées peuvent
atteindre, dans l'organisme, les tissus à traiter.
- la stratégie in vivo dans laquelle un vecteur (généralement un virus modifié) transportant le
4 / 42

[J. Suaudeau] POSSIBILITÉS ACTUELLES D'INTERVENTION GÉNÉTIQUE
gène d'intérêt est introduit directement dans l'organisme à traiter ( ce qui pose le problème du
ciblage tissulaire). Elle est moins efficace et son emploi est délicat, à cause des réactions de
l'organisme vis-à-vis des vecteurs administrés. On est obligé d'y avoir recours lorsqu'il s'agit de
traiter un organe précis, le foi en particulier.
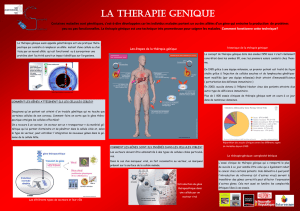
I - RÉSULTATS DES ESSAIS CLINIQUES DE THÉRAPIE GÉNIQUE SOMATIQUE
Si le concept de la thérapie génique a commencé à émerger dès qu'il est devenu possible de
localiser les gènes pathologiques, dans les années soixante, sa mise en jeu pratique n'a
commencée qu'à partir de 1972, lorsque la technique de l'ADN recombinant permit à Paul Berg
et ses collaborateurs de préparer le premier vecteur viral, le SV40. Il fallut cependant attendre
le développement des vecteurs rétroviraux, en 1981-1982, pour que soient enregistrés les
premiers succès de transferts de gène, chez l'animal, et que soit ainsi démontrée la capacité de
la thérapie génique à corriger des défauts génétiques. Le premier essai clinique de thérapie
génique eut lieu le 14 septembre 1990, amenant la guérison de la petite Ashanti DeSilva, 4 ans,
atteinte de déficit immunitaire combiné sévère par déficit en adénosine déaminase (DICS-ADA).
Depuis les médecins ont cherché à appliquer la thérapie génique somatique à de nombreuses
affections héréditaires, avec des succès variables.
Ces études, qui ont été surtout des essais de type I et II, destinés à vérifier l'inocuité du
processus, ont donné quatre types de résultats:
- il y a des maladies génétiques qui n'ont été étudiées que chez l'animal et pour lesquelles il n'y
a pas eu d'essais cliniques, principalement à cause de leur rareté: il s'agit de maladies comme
le déficit en purine nucléoside phosphorylase, le déficit en JAK3, le déficit en RAG-1, RAG-2, le
déficit en Artémis, le déficit en ZAP70.
- Il y a des maladies génétiques pour lesquelles on a beaucoup attendu de la thérapie génique,
5 / 42
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
1
/
42
100%