Examen - Université du Maine

Université du Maine - Faculté des Sciences
! Retour Examen LCU7 - Juin 2000
UNIVERSITE DU MAINE
FACULTE DES SCIENCES
LICENCE DE CHIMIE - LCU 05
CHIMIE ORGANIQUE
Barème : I = 6 + 7 + 6 + 4 + 7 = 30 ; II = 2 + 2 + 7 + 19 + 30 Total = 60 pts
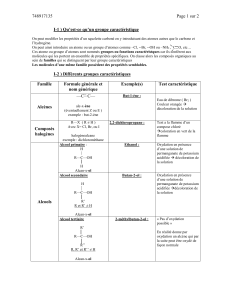
I - Les composés carbonylés 1,3-difonctionnels et α,β−éthylèniques sont très répandus en Chimie Organique et il est
nécessaire de posséder des méthodes de synthèse de ces composés. Plusieurs réactions très classiques y conduisent.
1. La réaction d’aldolisation conduit à des β−hydroxyaldéhydes (ou cétones) ou à des composés carbonylés
α,β−éthylèniques. A partir de quels produits sont synthétisées les molécules 1 et 2 ci-dessous ? Ecrire le
mécanisme complet dans le cas du produit 2. Le produit 2 serat-il majoritaire ? Expliquez pourquoi.
2. La réaction de Mannich suivie d’une autre réaction conduit aussi à des composés carbonylés α,β−éthylèniques.
Quelle est la réaction qui doit suivre la réaction de Mannich ? Comment le produit 3 peut-il être préparé par une
réaction de Mannich ? Ecrire le mécanisme complet de la réaction en milieu basique.
3. La condensation de Claisen conduit à des β−céto esters. Il y a deux condensations possibles pour obtenir le
cétoester 4. Indiquer les deux possibilités et donner le mécanisme complet d’une des deux condensation
4. La réaction de Wittig conduit elle aussi à des composés α,β−éthylèniques. Comment le composé 5 peut-il être
préparé par une réaction de Wittig ? Ecrire le mécanisme complet.
5. La réaction de Michael permet également d’accéder à des composés carbonylés fonctionalisés en β. Quels types de
réactifs interviennent ? Est-il possible de faire entrer un halogène sur cette position ? Le produit 6 a été préparé en
deux étapes dont une réaction de Michael ? Quels étaient les produits de départ ? Ecrire le mécanisme complet de la
réaction. Quelle est la seconde étape ?
II - La multisrtiatine est une des phéromones d’un coléoptère qui transporte un champignon responsable de la maladie des
ormes. Plusieurs synthèses de la multistriatine sont décrites.
1) Combien cette molécule contient-elle de carbone asymétriques ? Combien de stéréoisomères ?
2) Quelle fonction est présente dans la molécule de multistriatine ? En tenant compte de cette fonction proposer une
molécule 8 comme précurseur de 7.
OCHO
O
OH
OOO
O
COOEt
!"#
COOEt
$
%
H2NNH2
O
&
O
O
'( : Multistriatine

Université du Maine - Faculté des Sciences
! Retour Examen LCU7 - Juin 2000
3) L’une des synthèse du stéréoisomère α utilise comme produit de départ l’acide 9.
Indiquer la formule des produits 10,11 et 12 et le type de réaction qui intervient. Quel réactif permettrait de passer
du produit 12 au produit 8 précurseur de la molécule ciblée ?
4) Une seconde synthèse débute avec le diol 13.
Indiquer la formule des produits 14 à 20 en précisant le type de réaction utilisé dans chaque cas. Proposer un
mécanisme pour le passage de 16 à 17. Le produit 16 est seulement un mélange d’énantiomères. Pourquoi ? Indiquer la
configuration absolue des carbones. Quelle(s) réaction(s) et quel(s) réactif(s) seraient nécessaires pour passer de 8 à la
multistriatine.
COOH LiAlH4
!) TsCl O
!! (base) !"
*
O
O
H
H
!#
Acétone
en milieu acide
"sec"
HO
OO
!$
H
Me
C6H5COOOH !%
H
Me2CuLi !&
puis hydrolyse
!& HCl
!'
TsCl, pyridine !+
NaI
O + N
H
!*
") 1) !*
2) H2O, H+ +
(solution aqueuse)
1
/
2
100%