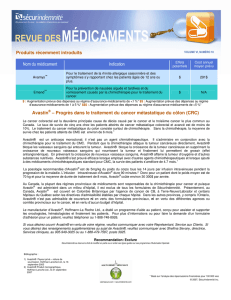
La FDA approuve une nouvelle utilisation d`Avastin plus

Communiqué de presse
F. Hoffmann-La Roche Ltd 4070 Basel
Switzerland
Group Communications
Roche Group Media Relations
Tel. +41 61 688 88 88
Fax +41 61 688 27 75
www.roche.com
1/5
Bâle, le 24 janvier 2013
La FDA approuve une nouvelle utilisation d’Avastin plus chimiothérapie dans le
traitement du cancer colorectal métastatique
Roche (SIX: RO, ROG; OTCQX: RHHBY) a annoncé aujourd’hui que la US Food and Drug Administration
(FDA) a approuvé une nouvelle utilisation d’Avastin (bévacizumab) associé à une chimiothérapie à base de
fluoropyrimidine et d’irinotécan ou d’oxaliplatine chez les personnes souffrant de cancer colorectal
métastatique (CCRm). La nouvelle indication va permettre aux personnes recevant Avastin plus
chimiothérapie à base de fluoropyrimidine contenant de l’irinotécan ou de l’oxaliplatine en traitement initial
(première ligne) du CCRm de continuer à recevoir Avastin plus chimiothérapie à base de fluoropyrimidine
avec permutation à l’irinotécan ou l’oxaliplatine après progression de l’affection cancéreuse (traitement de
deuxième ligne).
Hal Barron, MD, Chief Medical Officer et responsable de Global Product Development: “La majorité des
personnes chez lesquelles a été diagnostiqué un cancer colorectal métastatique reçoivent Avastin plus
chimiothérapie à titre de traitement initial. Avec la nouvelle homologation, ces personnes ont aujourd’hui la
possibilité de continuer à recevoir Avastin, associé à une nouvelle chimiothérapie, après aggravation de leur
maladie, ce qui pourrait leur permettre de vivre plus longtemps qu’avec la seule nouvelle chimiothérapie.”
Avastin associé à une chimiothérapie à base de fluoropyrimidine/irinotécan ou fluoropyrimidine/oxaliplatine
est à présent indiqué dans le traitement de deuxième ligne de patients souffrant de cancer colorectal
métastatique ayant vu leur maladie progresser après un protocole de première ligne à base d’Avastin.
L’homologation est fondée sur les résultats positifs de l’étude de phase III ML 18147, présentée au congrès
annuel 2012 de l’American Society of Clinical Oncology, qui a montré que les personnes ayant continué à
recevoir un protocole chimiothérapique à base d’Avastin après progression de leur cancer ont vécu plus
longtemps que celles n’ayant plus bénéficié que d’une chimiothérapie.
Avastin est le seul agent biologique approuvé par la FDA en association à une chimiothérapie à base de 5-FU
intraveineux dans le traitement initial (première ligne) du CCRm, dans le traitement de personnes dont le
cancer a progressé après chimiothérapie seule et, désormais, dans le traitement de personnes dont le cancer

2
/
5
s’est aggravé après traitement initial par un protocole à base d’Avastin. Il s’agit là de la troisième
homologation accordée à Avastin dans le traitement du CCRm sur la base d’une amélioration de la survie
globale. Avastin n’est pas indiqué dans le traitement adjuvant du cancer du côlon.
En Europe, Avastin est homologué en association à une chimiothérapie à base de fluoropyrimidine dans le
traitement de patients adultes atteints de cancer métastatique du côlon ou du rectum. En Europe,
l’information sur le produit a été actualisée sur la base des résultats positifs de l’étude de phase III ML18147,
avec entrée en vigueur au 12 décembre 2012, ce qui permet aux personnes avec CCRm qui recevaient Avastin
plus chimiothérapie en traitement de première ligne de continuer à recevoir Avastin plus chimiothérapie
après aggravation de la maladie dans le cadre du traitement de deuxième ligne.
A propos de l’étude ML18147
L’étude ML18147 était une étude multicentrique ouverte de phase III, plurinationale, randomisée, évaluant
l’efficacité et l’innocuité d’Avastin associé à une chimiothérapie standard de deuxième ligne chez 820 patients
souffrant de CCRm ayant progressé après traitement par Avastin plus chimiothérapie standard de première
ligne (à base d’irinotécan ou d’oxaliplatine). Les patients ont été affectés par randomisation à l’un des deux
groupes thérapeutiques de l’étude à la progression de la maladie.
• Groupe A: chimiothérapie* plus Avastin (équivalent de 2,5 mg/kg i.v. par semaine)
• Groupe B: chimiothérapie* seule
*La chimiothérapie a été permutée en seconde ligne selon qu’elle était à base de fluoropyrimidine/irinotécan ou de
fluoropyrimidine/oxaliplatine en première ligne.
• Le risque de décès a été réduit de 19 pour cent chez les personnes ayant reçu Avastin en association à une
chimiothérapie standard aussi bien en première qu’en deuxième ligne, par rapport à celles n’ayant
bénéficié que d’une chimiothérapie en deuxième ligne (HR=0,81; p=0,0057). La survie globale médiane a
été de 11,2 mois, contre 9,8 mois.
• Le risque d’aggravation du cancer ou de décès (survie sans progression = PFS) a été réduit de 32 pour
cent (HR=0,68; p<0,0001). La PFS médiane a été de 5,7 mois, contre 4,1 mois.
• Le taux de réponse ne différait pas significativement entre les groupes thérapeutiques.
• La survie globale et la PFS ont été calculées à partir de l’affectation aléatoire des patients au traitement de
deuxième ligne.
• Les événements indésirables (EI) constatés dans l’étude ML18147 ont été similaires à ceux observés lors
de précédentes études pivots sur Avastin utilisé lors de C CRm.

3
/
5
Le critère d’évaluation primaire de l’étude était la survie globale mesurée à partir du moment de l’affectation
aléatoire des patients au traitement de seconde ligne. Les critères d’efficacité secondaires de l’étude
englobaient la PFS, le taux de réponse global et le profil d’innocuité.
A propos du cancer colorectal
Le cancer colorectal est l’un des cancers les plus répandus dans le monde; avec plus de 1,2 million de
nouveaux cas diagnostiqués chaque année,1 il est responsable de plus de 600 000 décès par an, ce qui fait de
lui l’une des principales causes de décès par cancer.1
A propos d’Avastin - plus de huit ans pendant lesquels le traitement du cancer a changé de visage
Approuvé à l’origine, en 2004, aux Etats-Unis contre le cancer colorectal évolué, Avastin est devenu le
premier agent antiangiogénique disponible à grande échelle pour les patients souffrant de cancer au stade
avancé.
Aujourd’hui, Avastin continue de transformer la prise en charge des cancéreux grâce à son bénéfice
thérapeutique avéré en termes de survie (survie globale et/ou survie sans progression) lors de différents types
de tumeurs. Avastin est approuvé en Europe dans le traitement des stades avancés du cancer du sein, du
cancer colorectal, du cancer du poumon non à petites cellules, du cancer du rein et du cancer de l’ovaire; il
est également disponible aux Etats-Unis pour le traitement du cancer colorectal, du cancer du poumon non à
petites cellules et du cancer du rein. De plus, Avastin est homologué aux Etats-Unis et dans près de 40 autres
pays dans la thérapie du glioblastome ayant progressé après un précédent traitement. Au Japon, Avastin est
approuvé pour le traitement des stades avancés du cancer colorectal, du cancer du poumon non à petites
cellules et du cancer du sein. Avastin est le seul agent antiangiogénique disponible pour le traitement de ces
nombreux cancers au stade avancé, responsables de plus de 2,5 millions de décès par an.
Avastin a fait du traitement antiangiogénique un pilier fondamental de la thérapie anticancéreuse
d’aujourd’hui. A ce jour, plus d’un million de patients ont été traités par Avastin. Un vaste programme
clinique englobant plus de 500 études en cours examine l’utilisation d’Avastin dans plus de 50 types de
tumeurs.

4
/
5
A propos d’Avastin – mécanisme d’action
Pour croître au-delà d’une certaine taille (2 mm) et disséminer dans l’organisme (formation de métastases),
une tumeur a impérativement besoin d’un apport de sang indépendant. Elle développe donc son propre
réseau sanguin en libérant le facteur de croissance de l’endothélium vasculaire (VEGF) dans le cadre d’un
processus appelé angiogenèse, promoteur essentiel de la croissance tumorale. Avastin est un anticorps qui
cible et inhibe spécifiquement le VEGF pour garder constamment la tumeur sous contrôle. L’inhibition
spécifique du VEGF exercée par Avastin lui permet d’être combiné efficacement à un large éventail de
chimiothérapies et d’autres traitements anticancéreux avec un impact additionnel limité sur les effets
indésirables de ces traitements.
A propos de Roche
Roche, dont le siège est à Bâle, Suisse, figure parmi les leaders de l’industrie pharmaceutique et diagnostique
axée sur la recherche. Numéro un mondial de la biotechnologie, Roche produit des médicaments
cliniquement différenciés pour le traitement du cancer, des maladies virales et inflammatoires ainsi que des
maladies du métabolisme et du système nerveux central. Roche est aussi le leader mondial du diagnostic in
vitro ainsi que du diagnostic histologique du cancer, et une entreprise pionnière dans la gestion du diabète.
Sa stratégie des soins personnalisés vise à mettre à disposition des médicaments et des outils diagnostiques
permettant d’améliorer de façon tangible la santé ainsi que la qualité et la durée de vie des patients. En 2011,
Roche, qui comptait plus de 80 000 employés dans le monde, a consacré à la R&D plus de 8 milliards de
francs. Son chiffre d’affaires s’est élevé à 42,5 milliards de francs. Genentech, Etats-Unis, appartient
entièrement au groupe Roche, qui détient en outre une participation majoritaire au capital de Chugai
Pharmaceutical, Japon. Pour de plus amples informations, consulter le site internet du groupe à l’adresse
www.roche.com.
Tous les noms de marque mentionnés sont protégés par la loi.
Informations complémentaires
- Roche en oncologie: www.roche.com/media/media_backgrounder/media_oncology.htm

5
/
5
Relations avec les médias, groupe Roche
Téléphone: +41 -61 688 8888 / e-mail: [email protected]
- Alexander Klauser (responsable du bureau des médias)
- Silvia Dobry
- Daniel Grotzky
- Štěpán Kráčala
________________________
1 WHO, IARC GLOBOCAN, Cancer Incidence and Mortality Worldwide in 2008 at http://globocan.iarc.fr/
1
/
5
100%