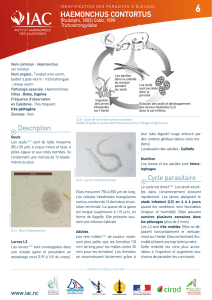
Régulation des populations de Nématodes gastro

1
N° d’ordre : 2346
THESE
présentée
pour obtenir
LE TITRE DE DOCTEUR DE L’INSTITUT NATIONAL POLYTECHNIQUE DE TOULOUSE
ÉCOLE DOCTORALE : SCIENCES ECOLOGIQUES, VETERINAIRES, AGRONOMIQUES ET BIOINGENIERIES
Spécialité : Qualité et Sécurité des Aliments
Par Mlle Caroline LACROUX
Titre de la thèse Régulation des populations de Nématodes gastro-intestinaux
(Haemonchus contortus et Trichostrongylus colubriformis) dans
deux races ovines, INRA 401 et Barbados Black Belly
Soutenue le 15 Juin 2006 devant le jury composé de :
M. Alain MILON Président
MM. Philippe DORCHIES Directeur de thèse
Jacques CABARET Rapporteur
Christophe CHARTIER Rapporteur
Jimmy DUNCAN Membre
Philippe JACQUIET Membre

2
REMERCIEMENTS
Et bien voilà, ce manuscrit est (quasiment) bouclé et c’est, comme toujours, au dernier
moment et dans l’urgence, qu’il faut peauffiner les dernières bricoles et en particulier
les remerciements. Au final, c’est toujours la partie la plus baclée. Mais bon, on va
essayer d’oublier personne…
A Philippe, pour ces quelques années de parasitologie, d’immunologie, de statistiques…
Ouf, on y est arrivés… Merci de mettre des points au milieu de mes phrases trop longues
et d’enlever tous les adverbes superflus. Néanmoins, toutefois et donc, enfin, merci
pour tout… La bouteille de champagne du Vet Research est encore au frigo, c’est quand
tu veux…
A Mr Dorchies, pour son enthousiasme constant et sans faille vis à vis de ce travail,
pour ses conseils judicieux, ses corrections entre la France et le Maroc…
A tout le laboratoire de parasitologie de l’ENVT : Françoise, Christelle, Jean-Paul …
Merci pour votre disponibilité, votre bonne humeur et votre aide au cours de ces
quelques années.
A Getachew, heureusement que tu sais quand il faut mettre « the » ou non avant les
mots, et merci pour ton aide dans les manips. Bon courage pour la tienne de thèse, mais
je ne me fais pas trop de souci…
A tous les membres du domaine expérimental de Bourges-La Sapinière : Jean Claude
Brunel, Yves Bourdillon, Hervé Morin, Thierry Fassier, Didier Marcon, Serge Py,
Eric Thévenot, Alain Burtin, Jérôme Bernard, Bruno Bouquet,Stéphane Gressin…
A l’équipe de parasitologie de Tours : Jacques Corté, Christine Sauvé et surtout Lucas
Gruner, pour votre aide lors de notre première grosse manip…
A Dominique François, pour une logistique parfaite d’expédition de moutons vers
Toulouse.
A Jacques Bouix, pour ses conseils avisés en matière de génétique lors des CSU de
Bourges.
A Sèv, Cécile, Pierrette et Cindy, merci de vous occuper de tout ce que je n’ai pas le
temps de faire en général, merci pour votre soutien durant cette difficile (et longue)
période de rédaction, pour les excursions vers la boulangerie entre midi et deux (plutôt
deux d’ailleurs), pour les extases devant les estampes japonnaises de caillettes colorées
au Giemsa (j’en veux un de tatouage…), pour l’écriture des cassettes (oui, je sais,
dorénavant on ne prendra que celles où ça écrit bien…). Bref, heureusement que vous
êtes là… Toutefois, je me demande encore s’il vaut mieux trois ou quatre roues !!!

3
A mon très cher et respecté « collègue de bureau », qui subit ma mauvaise humeur
fréquente et mes coups de gueule. En (maigre) contre-partie je réponds au téléphone (!),
c’est déjà ça. Trève de plaisanteries, sans vous je ne serais pas là. Merci pour tout et à
nos futurs vaches, chèvres et moutons…
A Paul Cabanié, professeur classé « X » comme il dit…, pour m’avoir délesté de matinées
d’autopsie quand j’étais trop à la bourre. Il n’y a que vous que je peux appeler à 9h45
pour me remplacer au pied levé à 10h00… Promis, l’année prochaine je rendrai tous mes
jours : bonne chasse…
Merci aux Poupou’s (Poupou I, Poupou II La Peste, le petit Blackou, la Crevette… mais
quand va t-on s’arrêter ?) et à vos biberons du soir qui clôturaient souvent mes journées
d’ordinateur…
A toute ma (grande) famille, mes parents et mon frère (Monsieur « Table des
matières »), qui y ont toujours cru et m’ont toujours soutenue. Merci de m’avoir toujours
laissé faire tout ce qui me passait par la tête. Avec tout mon amour…
Enfin et surtout, à Olivier, ma « pleine lune à moi »…Sans toi je ne serais jamais arrivée
au bout. Heureusement que tu as des solutions à tout (faire marcher des PCR bourrées
d’inhibiteurs, des anticorps sans bruit de fond…)… Grumpfff…

4
SOMMAIRE
CHAPITRE I : PREAMBULE ............................................................................................8
CHAPITRE II : CONTEXTE BIBLIOGRAPHIQUE .....................................................10
1. GENERALITES SUR LES STRONGLES GASTRO-INTESTINAUX DES OVINS.........................11
1.1. Classification et critères d’identification des Trichostrongles gastro-intestinaux des
ovins.............................................................................................................................11
1.2. Le cycle biologique des Trichostrongles gastro-intestinaux....................................13
1.3. Les deux espèces de Trichostrongles utilisées comme modèles dans nos travaux
expérimentaux : Haemonchus contortus et Trichostrongylus colubriformis...................15
1.3.1. Haemonchus contortus et l’haemonchose ovine...............................................15
1.3.2. Trichostrongylus colubriformis et la trichostrongylose ovine...........................17
2. MOYENS DE LUTTE CONTRE LES STRONGLES GASTRO-INTESTINAUX ...........................20
2.1. Les anthelminthiques et leur mode d’action............................................................20
2.2. Les limites d’utilisation des anthelminthiques ........................................................22
2.3. La résistance aux anthelminthiques : définition et mécanismes...............................22
2.4. Prévalence de la résistance aux anthelminthiques ..................................................24
3. METHODES ALTERNATIVES DE LUTTE CONTRE LES STRONGLES GASTRO-INTESTINAUX
.........................................................................................................................................26
3.1. Tarir les sources de contamination.........................................................................27
3.1.1. La gestion raisonnée des pâturages ..................................................................27
3.1.2. Les champignons et bactéries nématophages ...................................................28
3.2. Augmenter la résistance de l’hôte ..........................................................................29
3.2.1. La vaccination.................................................................................................29
3.2.2. Interactions nutrition-parasitisme ....................................................................33
3.2.3. La sélection de la résistance aux nématodes gastro-intestinaux ........................35
4. LA REPONSE IMMUNITAIRE DES OVINS FACE AUX STRONGLES GASTRO-INTESTINAUX .49
4.1. Organisation générale de la réponse immunitaire ..................................................49
4.2. La réponse immunitaire innée ................................................................................49
4.3. La réponse immunitaire adaptative ........................................................................51
4.3.1. Présentation des antigènes parasitaires et initiation de la réponse immunitaire
adaptative .................................................................................................................52
4.3.2. Orientation de la réponse immunitaire : Th1 ou Th2 ?.......................................54

5
4.3.3. Mise en place et rôle des effecteurs de l’immunité dans les strongyloses gastro-
intestinales................................................................................................................58
4.3.4. Conséquences de la réponse immunitaire adaptative sur les traits de vie des
parasites : manifestations de l’immunité et régulation des populations de strongles ...70
4.3.4.1. Manifestations de l’immunité contre les nématodes parasites adultes........70
4.3.4.2. Manifestations de l’immunité contre les larves de nématodes parasites .....71
4.3.5. Régulation de la réponse immunitaire..............................................................73
4.3.5.1. Induction de types cellulaires immunomodulateurs par les strongles gastro-
intestinaux.............................................................................................................73
4.3.5.2. Production de molécules parasitaires immunomodulatrices.......................75
CHAPITRE III : OBJECTIFS DES TRAVAUX DE THESE..........................................79
CHAPITRE IV : LES PROCEDURES EXPERIMENTALES (OUTILS
METHODOLOGIQUES) ..................................................................................................82
1. MODELES EXPERIMENTAUX.........................................................................................83
1.1. Les animaux...........................................................................................................83
1.1.1. Ovins de race INRA 401 .................................................................................83
1.1.2. Ovins de race Barbados Black Belly................................................................83
1.1.3. Age et sexe des animaux .................................................................................84
1.2. Les parasites..........................................................................................................84
1.3. Infestations expérimentales ....................................................................................84
2. ETUDE DES POPULATIONS PARASITAIRES .....................................................................85
2.1. Comptage des œufs de strongles dans les matières fécales .....................................85
2.2. Mise en culture in vitro des œufs de Haemonchus contortus ...................................86
2.3. Etude quantitative et qualitative de la population parasitaire chez l’hôte (bilans
parasitaires) .................................................................................................................87
2.4. Etude de la fécondité des femelles parasitaires adultes...........................................87
3. ETUDE DE PARAMETRES PHYSIOPATHOLOGIQUES CHEZ L’HOTE .................................88
3.1. Suivi de l’éosinophilie sanguine .............................................................................88
3.2. Suivi de l’hématocrite ............................................................................................88
4. ETUDE DE L’ORIENTATION DE LA REPONSE IMMUNITAIRE...........................................89
4.1. Principe de la PCR quantitative .............................................................................89
4.2. Du tissu à l’ARN….................................................................................................90
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
 205
205
 206
206
 207
207
 208
208
 209
209
 210
210
 211
211
 212
212
 213
213
 214
214
 215
215
 216
216
 217
217
 218
218
 219
219
 220
220
 221
221
 222
222
 223
223
 224
224
 225
225
 226
226
 227
227
 228
228
 229
229
 230
230
 231
231
 232
232
 233
233
 234
234
1
/
234
100%