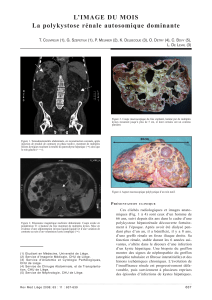
Graphique 1 - Faculté de Médecine et de Pharmacie Fès

UNIVERSITESIDIMOHAMMEDBENABDELLAH
FACULTEDEMEDECINEETDEPHARMACIE
FES
AnnéeThèseN°/201105411
UNIVERSITESIDIMOHAMMED
BENABDELLAH
FES
POLYKYSTOSERENALEAUTOSOMIQUE
DOMINANTEDEL'ADULTE
(ExpérienceduservicedeNéphrologieCHUHassanIIFès)
THESE
PRESENTEEETSOUTENUEPUBLIQUEMENTLE31/03/2011
PAR
Néele15Avril1985àElMenzel
Mlle.BOURHROUMNAJOUA
POURL'OBTENTIONDUDOCTORATENMEDECINE
MOTS-CLES:
PKRAD-IRCT-HTA-Dépistagefamilial-Guided'éducation
JURY
M. ProfesseurUrologie
M. ProfesseurUrologie
.BENAJAHDAFR-ALLAH
Professeur
M.SQALLIHOUSSAINITARIQ
ProfesseurNéphrologie
M. ProfesseurNéphrologie
FARIHMOULAYHASSAN...............................................
d
ELFASSIMOHAMMEDJAMAL.......................................
agrégéd
M..................................................
agrégédeGastro-entérologie
..............................................
agrégéde
ARRAYHANIMOHAMED................................................
assistantde
’
.
’
JUGES
PRESIDENT
RAPPORTEUR
MEMBREASSOCIE

1
Plan
Liste des abréviations ...................................................................................... 6
Liste des figures ............................................................................................. 8
Liste des tableaux .......................................................................................... 10
INTRODUCTION ............................................................................................. 11
RAPPELS .................................................................................................. 14
1. Anatomie des reins ................................................................................. 14
2. Physiologie des reins ............................................................................... 16
a. Fonctions exocrines ........................................................................... 16
b. Fonctions endocrines ......................................................................... 16
3. Polykystose rénale ................................................................................... 17
a. Définition ........................................................................................... 17
b. Pathogénie......................................................................................... 19
c. Diagnostic positif ............................................................................... 22
d. Manifestations extrarénales ............................................................... 23
e. Evolution ........................................................................................... 24
f. Traitement ......................................................................................... 24
g. Enquête familiale et conseil génétique ................................................ 25
h. Problèmes nosologiques et diagnostic différentiel .............................. 26
MATERIEL ET METHODES ................................................................................ 29
1. Type d’étude .......................................................................................... 30
2. Population d’étude .................................................................................. 30
2.1. Critères d’inclusion ......................................................................... 30
2.2. Critères d’exclusion ........................................................................ 31
3. Recueil des données ............................................................................... 31
4. Définitions ............................................................................................. 32

2
5. Saisie et analyse ...................................................................................... 35
RESULTATS .................................................................................................. 36
I. Données générales .................................................................................. 37
II. Données épidémiologiques ...................................................................... 37
1- L’incidence ....................................................................................... 37
2- l’âge ................................................................................................. 37
3- le sexe .............................................................................................. 38
4- l’origine géographique ..................................................................... 39
5- l’hérédité .......................................................................................... 39
5.1. consanguinité parentale ............................................................ 39
5.2. Antécédents familiaux ............................................................... 39
5.3. Arbre généalogique ................................................................... 40
III. Données cliniques ................................................................................. 42
1. Antécédents pathologique ................................................................. 42
2. Motif d’admission .............................................................................. 43
3. Circonstances de découverte .............................................................. 44
4. Les manifestations cliniques .............................................................. 45
IV. Données paracliniques ........................................................................... 47
1. Résultats biologiques ........................................................................ 47
2. Résultats radiologiques ..................................................................... 51
V. Lésions associées .................................................................................... 53
a. Les kystes hépatiques ........................................................................ 53
b. Les atteintes cardiaques ..................................................................... 53
c. Les hernies......................................................................................... 54
d. Anévrismes cérébraux ........................................................................ 54
e. Diverticulose colique .......................................................................... 54
f. Les associations fortuites ................................................................... 54

3
VI. Traitement ............................................................................................. 55
A. Traitement médical ............................................................................ 55
1. Traitement de l’HTA ..................................................................... 55
2. Antiprotéinuriques ...................................................................... 56
3. Antibiothérapie ............................................................................ 56
4. Traitement associé ....................................................................... 56
5. Traitement antalgique .................................................................. 56
6. Traitement de l’hyperurécemie ..................................................... 56
B. Traitement chirurgical .................................................................. 57
C. Dialyse chronique ............................................................................. 57
VII. Evolution et complications ..................................................................... 58
a. IRCT .................................................................................................. 58
b. HTA ................................................................................................... 58
c. Lithiase urinaire ................................................................................. 58
d. L’infection ........................................................................................ 59
e. L’hémorragie ..................................................................................... 59
VII. Enquête familial ..................................................................................... 60
DISCUSSION .................................................................................................. 61
1. Epidémiologie ........................................................................................ 62
1.1. Le caractère croissant de la prévalence de la PKRAD ........................ 62
1.2. Répartition de la PKRAD selon ........................................................ 63
1.2.1. L’âge ...................................................................................... 63
1.2.2. Le sexe .................................................................................. 65
1.3. Intérêt des antécédents familiaux dans la détermination du caractère
génétique ........................................................................................................ 65
2. Clinique .................................................................................................. 66
2.1. Les circonstances amenant à poser le diagnostic ............................. 66

4
2.2. Les manifestations rénales ............................................................. 66
2.2.1. kystes rénaux ......................................................................... 66
2.2.2. Le syndrome douloureux ....................................................... 67
2.2.3. L’HTA ..................................................................................... 68
2.2.4. L’insuffisance rénale ............................................................... 69
2.2.5. L’hématurie ............................................................................ 71
2.2.6. L’infection urinaire ................................................................. 72
2.2.7. La lithiase rénale .................................................................... 74
2.3. Les manifestations extra rénales ..................................................... 74
2.3.1. Les kystes du foie .................................................................. 74
2.3.2. Les atteintes cardio vasculaires ............................................... 75
2.3.3. Les atteintes abdominales ...................................................... 77
2.3.4. Les atteintes pulmonaires ....................................................... 78
3. Confirmation radiologique ....................................................................... 79
3.1. Critères de diagnostic échographique ............................................. 80
3.2. Apport de la TDM et de l’IRM .......................................................... 82
4. Modalités évolutives et complications ...................................................... 84
4.1. Evolution vers l’IRCT ....................................................................... 85
4.2 Facteurs favorisant la progression de l’IRC dans la PKRAD ............... 86
4.3. Conséquences cliniques des lésions rénales et extra rénales ............ 89
5. Stratégie de prise en charge thérapeutique ............................................. 92
5.1. Mesures hygiéno-diététiques ......................................................... 92
5.2. Traitement médical ......................................................................... 94
5.3. Traitement chirurgical ................................................................... 96
5.4. Traitement de suppléance .............................................................. 97
6. Surveillance ............................................................................................. 98
7. Dernières avancés et perspectives thérapeutiques .................................... 99
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
1
/
186
100%