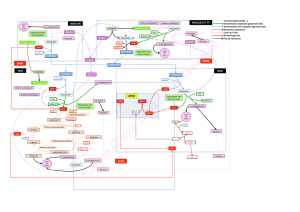
Catabolisme des Acides Aminés

!"#$%&'()&*&"+++$++,-+./.012.+-3.+412./5.6+.0/.-+1-7108/9.50:+0/+;-:.-+-3.+5:.-185.-+$+++</.012.+:5=053+>?#>@>?#A++++++++++++++
+ +
Catabolisme+des+Acides+Aminés+
!
! ,2+710.B0CD3-+-E9-335;-+3F-GG-9./-+"#$%!&'()!*+()+!,$-%!./.)01+HCD3030I-6+!J5K/5.5:-$L10.B230I-6+
710.B23-3+9-CC/C251-3M+
! ,-3+NN+-:+-E9O3+:-+30:.+2.%!%,#031%!4++
! ,-3+710.B5:-3+30:.+90:.5:/-CC-I-:.+3D:.PB.53B-3+-.+8B4128B-3+7PD350C045K/-I-:.+
! ,F2II0:529+HQ)AM+7108/5.+721+C-+92.2J0C53I-+8-3+NN+-3.+.0E5K/-+R+G01.-+90:9-:.12.50:+HI253+
7-1I-.+C2+3D:.PO3-+8-3+NN+:0:+-33-:.5-C3+721+.12:32I5:2.50:M+
!"#$%&'&()*&+(#,-#./+-01'1(*#)'&(2#
3"#4/)(5)'&()*&+(
! 5$.)%6+$,!$1/+$%78"+!&'()!9$#(2+:+),!
.:7)1!&'()!;;!/+$%!()!α<01,#.07&+!!
! ,-3+.12:32I5:23-3+0:.+C-+2=$7&#>."!
2?#%2?.,++90II-+90-:SDI-+
! ,-3+.12:32I5:23-3+7033O8-:.+/:-+
%21076707,1!&+!$1.0,7#)+H.12:3G-1.+Q)AM++,!
&+!%(8%,$.,+2J30C/-3+
! ,-3+.12:32I5:23-3+K/5+30:.+/J5K/53.-3+7-1I-..-:.+C2+3D:.PO3-+8-3+NN+:0:+-33-:.5-C3+"+I25:.5-:+8F/:+BK/5C5J1-+
-:.1-+C-3+85GGB1-:.3+NN+
! L1-I5O1-+B.27-+8/+92.2J0C53I-+8-3+NN+
! &C+D+2+2+(!&'α<01,#.07&+%+T+7D1/;2.-+H"+2C2:5:-M6+'NN+H"+23721.2.-M+-.++%%+),7+""+:+),!"'α<01,#9"(,.$.,++
H"4C/.2I2.-M+
! ;;!+%%+),7+"%!@!;;!&#),!".!0?.7)+!?=&$#0.$8#)1+A"'α<01,#.07&+!0#$$+%2#)&.),!)'+%,!2.%!%=),?1,7%.8"+!
+
<;)&$+.<!

!"#$%&'()&*&"+++$++,-+./.012.+-3.+412./5.6+.0/.-+1-7108/9.50:+0/+;-:.-+-3.+5:.-185.-+$+++</.012.+:5=053+>?#>@>?#A++++++++++++++
+ +
6"#725)'&()*&+(#+89,)*&:1
! L15:9572C-+1B29.50:+8-+8B32I5:2.50:+233/1B-+721+C2+9"(,.:.,+!&1%?=&$#91).%+#;<7="#T+-:SDI-+:7,#0?#)&$7."++K/5+
8B32I5:-+C-+4C/.2I2.-+-:+α$9B.04C/.212.-+H$1/+$%78"+M+
! UV)+"+-:SDI-+2CC03.B15K/-+T+
• ;0,7/1+!2.$!"';BC+HG01I2.50:+8F5:.-1IB85251-3+8/+(WM+
• D)?781+!2.$!"+!E5C+H71B3-1;-+C2++X4C/.2I2.-Y+:B9-33251-+R+C2+7108/9.50:+8/+Q$N9B.DC$4C/.2I2.-M+
>"#4/)(50+/*#0%)5')*&?-1#,15#@AB=CD
3"#710-&5#%15#*&55-5#02/&0E2/&?-15#;5)-F#%15#'-5G%15"
! 5$.)%2#$,!&+!F!G<HIJK!%#(%!6#$:+!&+!E"(,.:7)+!L)#)!,#>7M(+N!/+$%!"+!6#7+!+,!"+!$+7)!
! ,2+3D:.PO3-+8-+UC/.2I5:-+721+C2+4C/.2I5:-+3D:.P23-+)10+%%7,+!O!;5C+
! !:-+G053++82:3+C-3+I5.09P0:815-3+PB72.5K/-36+C2+4C/.2I5:-+HNN+C-+7C/3+71B3-:.+82:3+C-+32:4M+-3.+.12:3G01IB-+721+C2+
UC/.2I5:23-+-:+4C/.2I2.-+-.+2II0:529+H"+9D9C-+8-+CF/1B-M+
UC/.2I2.-+
UC/.2I5:-+3D:.P23-+
;5C!
;BC!P!C7!!
UC/.2I5:-+
Q)Z
[+
UC/.2I5:-+
UC/.2I2.-+
Q)Z
[+
IFQ+
+
UC/.2I5:23-+
\NQU+
57%%(%!21$72?1$7M(+%!
R7,#0?#)&$7+%!?12.,7M(+%!

!"#$%&'()&*&"+++$++,-+./.012.+-3.+412./5.6+.0/.-+1-7108/9.50:+0/+;-:.-+-3.+5:.-185.-+$+++</.012.+:5=053+>?#>@>?#A++++++++++++++
+
6"#710-&5#%15#'-5G%15
! >#'+91(5+T+
• UC/.2I5:-+T+58-I+K/-+70/1+C-3+2/.1-3+.533/3+7B157PB15K/-3+I253+71BGB1-:.5-CC-I-:.+2/+
1-703+921+90:30II2.50:+8FN<L+++
• ;".)7)++T+-33-:.5-CC-I-:.+921+2+$:+,!&'10#)#:7%+$!&+!"';5C+"+9D9C-+4C/903-@NC2:5:-++++++++
S+!0=0"+!2+$:+,!&'+>2#$,+$!"+!G<HIJK!/+$%!"+!6#7+!,#(,!+)!6#($)7%%.),!"+!:(%0"+!+)!9"(0#%++
S=0"+!9"(0#%+A;".)7)++T+,-+*/39C-+
G25.+C2+UCD90CD3-+-.+G01I-+8/+
LD1/;2.-+R+721.51+8/+UC/903-+"+
,-+LD1/;2.-+*/39/C251-+-3.+
.12:3G01IB-+-:+NC2:5:-+U1]9-+R+
N,N<+"+,FNC2:5:-+-3.+-:;0DB+2/+
^05-+"+,FNC2:5:-+PB72.5K/-+-3.+
<12:3G01IB-+-:+LD1/;2.-+41]9-+R+
N,N<+"+,-+^05-+G25.+C2+
QB04C/904-:O3-+-.+
^01I-+8/+UC/903-+R+721.51+8/+
LD1/;2.-+"+,-+UC/903-+7-/.+
1-.0/1:-1+;-13+C-+I/39C-+"_+
#
+
T'.".)7)+!,$.)%2#$,+!
%+("+:+),!O!G<HIJK!
,-+4C/.2I2.-+710;-:2:.+8-3+1B29.50:3+8-+.12:32I5:2.50:+9D.030C5K/-+7B:O.1-+82:3+C2+I5.09P0:815-+;52+C`B9P2:4-/1+
23721.2.-+@4C/.2I2.-++
!
C"#H/2+.1(I51
! U#7+!+>0"(%7/+:+),!?12.,#0=,.7$+!H&V!W!".!2$1%+)0+!()7M(+!&+!"'+)X=:+!#$)7,?7)+<0.$8.:="!,$.)%61$.%+M+K/5+
71-:8+-:+9P214-+CF2II0:529+710;-:2:.+8-+CFBC5I5:2.50:+8-3+410/7-I-:.3+2S0.B3+8-3+NN+HUC/.2I2.-6+UC/.2I5:-6+
NC2:5:-6+NN+C5J1-3M+70/1+80::-1+CF/1B-!
! a05-+&'.8#$&!:7,#0?#)&$7."+!H>+71-I5O1-3+B.27-3M+7/53+9D.030C5K/-+HA+8-1:5O1-3+B.27-3M!
J*&*#*/-G+T+K/2:8+C-+:0I+8F/:-++-:SDI-+8/+9D9C-+8-+CF/1B-+90II-:9-+721+b+214$c+"+-:SDI-+9D.030C5K/-+
! &C+D+2+BC5I5:2.50:+8-+>+I0CB9/C-3+8F2II0:529+721+I0CB9/C-+8F/1B-+HC-+921J0:-+710;5-:.+8-3+J5921J0:2.-3M+
<;)&$+.<!

!"#$%&'()&*&"+++$++,-+./.012.+-3.+412./5.6+.0/.-+1-7108/9.50:+0/+;-:.-+-3.+5:.-185.-+$+++</.012.+:5=053+>?#>@>?#A++++++++++++++
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
++
+
+
+
+
+
+
+
+
+
+
+
+
++
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
++
+
+
+
+
+
+
+
+
+
+
+
+
++
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+ +
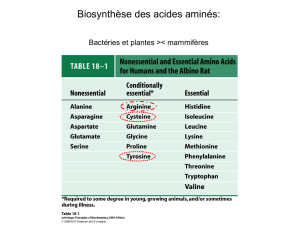
K2)G*&+(#!#;'&*+"+T++
! ,2+(21J2IDC$LP037P2.-+3D:.PB.23-+#+H(L\$#M+-3.+
.0,7/1+!2.$!.""#%,1$7+!2.$!"+!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
H<.01,="9"(,.:.,++H7108/5.+8-+C2+90:8-:32.50:+
8F/:+UC/.2I2.-+-.+8F/:+N9-.DC$(0NM+
! Y#$,+:+),!+>+$9#)7M(+!"!7$$1/+$%78"+!"!
?=&$#"=%+!&+!F!;5C!+)!F!;BC!
! Z1.0,7#)!6#$,+:+),!+>+$9#)7M(+!
(L\$#+
F!;5C!
++
F!;BC!P!C7!
)('A+
+
Q)A+
(21J2IDC$LP037P2.-+
+
K2)G*&+(#>#;'&*+"+T++
! dB29.50:+92.2CD3B-+721+"'#$)7,?7)+<0.$8.:="!
,$.)%61$.%+!L#(!Q$)7,?7)+!,$.)%0.$8.:=".%+N[!
+)X=:+!2$1%+),+!()7M(+:+),!&.)%!"+!6#7+!444+
! L/53+-E701.+8-+C2+(5.1/CC5:-+;-13+C-+9D.030C+-:+
B9P2:4-+8F/:-+'1:5.P5:-+41]9-+R+CF.),72#$,!
Q$)7,?7)+AS7,$(""7)++
!
'1:5.P5:-+
.12:3921J2IDC23-+
C7+
(21J2IDC$LP037P2.-+
!
'1:5.P5:-+
(5.1/CC5:-+
(5.1/CC5:-+
'1:5.P5:-!
N145:03/995:2.-+
3D:.P23-+
+
(5.1/CC5:-+
N3721.2.-+
N145:03/995:2.-+
!;5C+
!;RC!P!CC7!"!C7+
K2)G*&+(#L#;G9*+"+T++
! \=),?-%+!&';$97)7)+!
! C$#&(0,7#)!&+!Y(:.$.,+!L7),1$:1&7.7$+!&(!S]N!"!
"7+)!+),$+!($1#9+)-%+!+,!"+!0=0"+!&+!]$+8%!LS]N!!!!!!!!!!
"!:7)7:7%.,7#)!&(!0#(2!1)+$91,7M(+!&+!
"'($1#9+)-%+!
+
N145:03/995:2.-+
CD23-+
+
N145:5:-+
!
^/I212.-+
!
N145:03/995:2.-+
+
K2)G*&+(#C#;G9*+"+T++
! ,FN3721.2.-+710;5-:.+-33-:.5-C-I-:.+8-++C2+
I5.09P0:815-+271O3+K/-+CF'NN+25.+3/J5.+CF29.50:+8-+
CFN\N<!
! ^,7"7%.,7#)!&'()!;5C!:.7%!&+!F!"7.7%#)%!W!_!?.(,%!
2#,+),7+"%!1)+$91,7M(+%!`!
!
(5.1/CC5:-+
<;)&$+.<!

!"#$%&'()&*&"+++$++,-+./.012.+-3.+412./5.6+.0/.-+1-7108/9.50:+0/+;-:.-+-3.+5:.-185.-+$+++</.012.+:5=053+>?#>@>?#A++++++++++++++
+ +
N145:23-+
'1:5.P5:-+
N145:5:-+
+
K2)G*&+(#M#;G9*+"+T++
! Y#$:.,7#)!&'^$1+!
! ,F01:5.P5:-+1-.0/1:-+82:3+C2+I5.09P0:815-+
70/1+-:.1-1+82:3+/:+:0/;-2/+9D9C-+
+
!1B-+
+
6&%)(#-/2+.1(I51+T++++('>+[+Q)A+[+A+N<L+[+N3721.2.-+[+>+)>'+"+!1B-+[+>+NVL+[+>+L5+[+N*L+[+LL5+[+^/I212.-+
• >+2.0I-3+8F2S0.-3+8-+CF/1B-+710;5-::-:.+70/1+"'()!&'()!.::#)7.0!"'.(,$+!&'()!;%2.$,.,++
• J!;5C!(,7"7%1%!:.7%!a!"7.7%#)%!2?#%2?#.)?=&$+%+-:+.0/.+e+
+
K2.-%)*&+(#-/2+.1(I51+T+
! +!:+$197:+!$70?+!+)!2$#,7&+%!#(!()!*+()+!2$#"#)91!.(9:+),+!"'+>2$+%%7#)!&+%!9-)+%+9082:.+70/1+C-3+-:SDI-3+8/+
9D9C-+8-+CF/1B-+
! a52+SC\<O+K/5+-3.+.0,7/1+!2.$!"+!H<;01,="9"(,.:.,++H3D:.PO3-+29.5;B-+C013K/F5C+D+2+J-2/90/7+8-+UC/.2I2.-+928+
K/2:8+C2+710.B0CD3-+-3.+5I701.2:.-M+
+
!
N9G%1#O-')/)*1P350)/*)*1+T+G0/1:5.+8-+CFN3721.2.-+2/+9D.030C+70/1+G251-+8-+CF/1B04-:O3-+-.+8/+G/I212.-+H30/3+G01I-+8-+
*2C2.-M+R+C2+I5.09P0:815-+70/1+G251-+8/+(Wf+L-1I-.+C2+G01I2.50:+8F/:+QNV)+H"+A+N<LM+H/.5C53-+>+2:.5701.3+853.5:9.3M+
V2:3+C-+9D.030C6+/:+^/I212.-+-3.+7108/5.+721+CF2145:03/995:2.-+CD23-+"+&C+-3.+.12:3G01IB+-:+*2C2.-+HG/I2123-M+"+C-+*2C2.-+1-:.1-+82:3+
C2+I5.09P0:815-+-:+B9P2:4-+8F/:+α$9-.04C/+"+C-+^/I212.-+-3.+.12:3G01IB+-:+'NN+H(WM+2;-9+7108/9.50:+8F/:+QNV)+"+,F'NN+-3.+
.12:32I5:B+-:+N3721.2.-+"+,F23721.2.-+301.+8-+C2+I5.0+-:+B9P2:4-+8F/:+UC/.2I2.-+"+,F23721.2.-+1-:.1-+82:3+C-+9D9C-+8-+CF/1B-+"+_+
L"#71:1(&/#,-#5?-1%1**1#E9,/+AG)/Q+(21#,15#33
!
! ,-3+NN+80:.+C-+92.2J0C53I-+8/+3K/-C-..-+PD810921J0:B+6#$:+!&(!2=$(/.,+!#(!&+%!7),+$:1&7.7$+%!&(!S]!%#),!
9"(0#6#$:.,+($%+H0+(>!%#),!,#(%!"+%!.(,$+%!;;!M(+!0+(>!07,1%!07<&+%%#(%M!
! ,-3+NN+80:.+C-+92.2J0C53I-+8/+3K/-C-..-+PD810921J0:B+6#$:+!%#7,!&+!"'.01,="<S#;!#(!&+!"'.01,#.01,="<S#;!%#),!
01,#9-)+%A!01,#6#$:.,+($%+HT+(07)+!+,!T=%7)+M+
! ,-3+NN+K/5+7-/;-:.+g.1-+4C/90G01I2.-/[email protected]/13+30:.+8-3+NN+I5E.-3+HD%#"+(07)+[!,?$1#)7)+!+,!;;!
.$#:.,7M(+%!b!C?1)=".".)7)+[!5$=2,#2?.)+[!,=$#%7)+M++
+
M"#%+G)%&5)*&+(#,1#%R)G*&:&*2#E20)*&?-1
• =20)*+G9*15#02/&0+/*)-8#;&//&.-25#1(#!1/S#01(51/#T#0+/*1#,R1(*/21"#T+HEE[!β<#>[!01,#9+)-%+!+,!($1#9+)-%++H82:3+9-3+
PB72.09D.-36+C2+921J2IDC+7P037P2.-+3D:.PO.23-+2/12+/:-+G01.-+2GG5:5.B+70/1+3-3+3/J3.12.3Mf+"C5I5:2.50:+8F2II0:529+30/3+
G01I-+8F/1B-+
• =20)*+G9*15#02/&:1&(1-8#;&//&.-25#)0/I5#%15#02/&0+/*)-8"#T+E"(,.:7)#9+)-%++H82:3+9-3+PB72.09D.-36+C2+4C/.2I5:-+
3D:.PO.23-+2/12+/:-+G01.-+2GG5:5.B+70/1+CFNII0:529M++
,-3+I0CB9/C-3+8FNII0:529+2D2:.+B9P277B3+2/E+PB72.09D.-3+7B15701.2/E+;0:.+g.1-+.12:3G01IB3+-:+UC/.2I5:-+H25:35++
7"!)'=!.($.!2"(%!&';::#)7.0!W!".!%#$,7+!&(!6#7+Mf++
T.!E"(,.:7)+!/.!+)%(7,+!c,$+!+)/#=1+!.(>!$+7)%!2#($!=!%(87$!"'.::#)7#9+)-%+!$1)."++
+
<;)&$+.<!
 6
6
1
/
6
100%