La pénicilliose au Vietnam : une série de 94 - LIFE

La Revue de médecine interne 31 (2010) 812–818
Article original
La pénicilliose au Vietnam : une série de 94 cas
Penicilliosis in Vietnam: A series of 94 patients
V. Vu Haia,d,f,∗, A.T. Ngoa, V.H. Ngoa, Q.H. Nguyenb, P. Massipc, J. Delmontd,e, M. Strobelf, Y. Buissonf
aService des maladies infectieuses et tropicales, hôpital Viet Tiep, Haïphong, Vietnam
bHôpital Viet Tiep, Haïphong, Vietnam
cService des maladies infectieuses et tropicales, hôpital Purpan, CHU de Toulouse, 31095 Toulouse, France
dService des maladies infectieuses et tropicales, hôpital Nord, CHU Nord, 13915 Marseille, France
eAssociation Asie Horizon 2020/AVEC, 13008 Marseille, France
fInstitut de la francophonie pour la médecine tropicale, Vientiane, Laos
info article
Mots clés :
Pénicilliose
Penicillium marneffei
Infections opportunistes
VIH/sida
Vietnam
résumé
Propos. – Haïphong est la deuxième ville du Vietnam la plus touchée par l’infection par du VIH. La péni-
cilliose y représente la troisième cause d’infection opportuniste. Pourtant, cette mycose systémique,
spécifiquement asiatique, reste méconnue des praticiens. La présente étude a pour objectif d’en préciser
les aspects cliniques, diagnostiques et thérapeutiques.
Méthodes. – Il s’agit d’une étude descriptive, prospective et rétrospective, réalisée sur une période de trois
ans à l’hôpital Viet Tiep d’Haïphong.
Résultats. – Avec 94 cas, la pénicilliose représentait 11 % des infections opportunistes. Les patients
étaient jeunes (moyenne : 33 ans) et de sexe masculin (87 %). Les principaux symptômes étaient la
fièvre persistante (99 %), l’amaigrissement (88 %), les lésions cutanées (86 %), l’hépatomégalie (69%) et
la polyadénopathie (68 %). Une anémie était notée dans 77 % des cas. Le taux moyen de CD4 était de
29/L. La culture des biopsies de lésions cutanées et les hémocultures étaient positives pour Penicillium
marneffei dans respectivement 94 % et 90 % des cas. Malgré le traitement antirétroviral et antifongique,
le taux de mortalité était de 18 %. La monothérapie par itraconazole, administrée chez 53 patients suite
à l’indisponibilité de l’amphotéricine B, n’a pas affecté la survie de fac¸ on significative par rapport au
traitement de référence rec¸ u par les 41 autres patients.
Conclusion. – À Haïphong, la pénicilliose est une des infections opportunistes du sida les plus fréquentes et
les plus graves. Il faut y penser devant tout patient fébrile, immunodéprimé, ayant séjourné au Vietnam.
Le pronostic peut être amélioré par un diagnostic précoce grâce à l’hémoculture systématique et par une
bonne observance du traitement de référence.
© 2010 Société nationale française de médecine interne (SNFMI). Publié par Elsevier Masson SAS.
Tous droits réservés.
Keywords:
Penicilliosis
Penicillium marneffei
Opportunistic infections
HIV/AIDS
Vietnam
abstract
Purpose. – Haiphong is the second city of Vietnam most affected by HIV infection. Penicilliosis represents
the third leading cause of opportunistic infection. However, this systemic fungal infection remains poorly
knew by practitioners. This study aimed to clarify the clinical, diagnostic and therapeutic aspects of
penicilliosis.
Methods. – It is a descriptive study, prospective and retrospective, conducted over a 3-year period in Viet
Tiep hospital, Haiphong.
Results. – With 94 cases, penicilliosis represented 11 % of opportunistic infections. The patients were
young (mean: 33 years) and male (87 %). The main symptoms were persistent fever (99 %), weight loss
(88 %), skin lesions (86 %), hepatomegaly (69 %) and lymphadenopathy (68%). Anemia was noted in 77%
∗Auteur correspondant.
Adresse e-mail : [email protected] (V. Vu Hai).
0248-8663/$ – see front matter © 2010 Société nationale française de médecine interne (SNFMI). Publié par Elsevier Masson SAS. Tous droits réservés.
doi:10.1016/j.revmed.2010.07.019

V. Vu Hai et al. / La Revue de médecine interne 31 (2010) 812–818 813
of cases. The average CD4 count was 29/L. The culture of skin biopsies and blood culture were posi-
tive for Penicillium marneffei in 94 % and 90 % of cases, respectively. Despite antiretroviral and antifungal
therapy, the mortality rate was 18 %. Itraconazole monotherapy, administered in 53 patients due to the
unavailability of amphotericin B, did not significantly affect the survival compared to the recommended
treatment received by the 41 other patients.
Conclusion. – In Haiphong, penicilliosis is one of the most frequent and severe opportunistic infections of
AIDS. The diagnosis should be considered in all febrile and immunocompromised patients having spent
time in Vietnam. The prognosis can be improved by early diagnosis through the blood culture and a good
adherence to an appropriate antifungal therapy.
© 2010 Société nationale française de médecine interne (SNFMI). Published by Elsevier Masson SAS. All
rights reserved.
1. Introduction
La pénicilliose est une infection fongique systémique due à
Penicillium marneffei. Ce champignon dimorphique, endémique
en Asie du Sud-Est et en Chine du Sud, a été décrit pour la
première fois chez le rat de bambou en 1956 par Capponi et
Marneff à l’institut Pasteur de Dalat, Vietnam [1]. En 1973, les
premiers cas de pénicilliose humaine ont été décrits aux États-
Unis chez deux sujets immunodéprimés ayant séjourné en Asie
du Sud-Est [2]. Depuis 1988, de nombreux cas ont été rapportés
en Thaïlande, au sud de la Chine, à Hong-Kong, au Cambodge,
au Laos et au Vietnam chez des patients infectés par le virus
de l’immunodéficience humaine (VIH), représentant l’une des
toutes premières causes d’infection opportuniste (IO). Cette affec-
tion entraîne une morbidité et une mortalité élevées en Asie du
Sud-Est [3–8] mais aussi, à un moindre degré, hors de la région
endémique [4,6,9–16]. La maladie apparaît généralement en phase
d’immunodépression majeure, signant le passage au stade sida
[4,8,17–19].
Le mode de contamination par P. marneffei est mal élucidé. Le
rat de bambou (Rhizomys sp., Cannomys sp.) est le seul hôte naturel
connu de ce champignon mais son rôle de réservoir n’est pas établi.
L’infection se transmet probablement par voie aérienne à partir de
sols humides et contaminés surtout pendant la saison des pluies
de mousson [20,21]. Les manifestations cliniques sont peu spé-
cifiques, les signes les plus évocateurs étant la fièvre, la pâleur,
les lésions cutanées, l’amaigrissement, la lymphadénopathie et
l’hépatomégalie. Certains cas sont pauci-symptomatiques [4,8].
Le diagnostic repose sur la mise en évidence de P. marneffei à
l’examen direct ou en culture à partir des prélèvements cutanés,
sanguins, médullaires ou ganglionnaires. La sensibilité des cultures
varie de 50 % (expectoration) à 76 % (sang), 90 % (peau) et 100 %
(moelle) [8,22]. La sérologie et la PCR peuvent aussi être utilisées,
mais ces techniques sont coûteuses et difficiles à promouvoir dans
les pays émergents [4,7,8,23–29].
Le traitement de référence de la pénicilliose comporte
une phase d’attaque par l’amphotéricine B suivie d’un traite-
ment d’entretien par l’itraconazole [30,31]. Sans traitement,
l’évolution est habituellement fatale. La prophylaxie secondaire
par l’itraconazole à 200 mg/j est indiquée jusqu’à restauration
immunitaire attestée par un taux de CD4 stable et supérieur à
200 cellules/L[32,33]. L’efficacité du traitement dépend de la pré-
cocité du diagnostic [4,8,31].
Malgré sa prévalence élevée, la pénicilliose n’a pas encore fait
l’objet d’étude systématique au Vietnam [5,34]. Haïphong est la
deuxième ville du Vietnam en termes de prévalence de l’infection
VIH/sida avec 339 cas pour 100 000 habitants [35]. Dans une étude
pilote transversale réalisée à Haïphong en 2006, la pénicilliose
représentait 16 % des IO (données non publiées). La présente
étude y a été réalisée pour préciser la place de la pénicilliose
parmi les IO, en décrire les aspects cliniques, diagnostiques et
thérapeutiques.
2. Patients et méthodes
2.1. Site
L’étude a été conduite dans le service des maladies infectieuses
et tropicales de l’hôpital Viet Tiep, Haïphong.
2.2. Population étudiée
Tous les patients infectés par le VIH hospitalisés du 1er juillet
2005 au 30 juin 2008 ayant un diagnostic de pénicilliose confirmé
par le laboratoire ont été inclus. L’enquête était rétrospective pour
les cas hospitalisés jusqu’au 15 février 2008, reposant sur l’analyse
des dossiers et l’interview des patients, et prospective pour les cas
hospitalisés après le 15 février.
2.3. Définition des cas
La séropositivité pour le VIH était détectée par l’un des trois
tests rapides : SD Bioline HIV1/2 3.0 (Standard Diagnostics, Corée),
HIV1/2 Determine (Abbot Japon), HIV1/2 (Pharmatech, États-Unis).
Elle était confirmée par un autre test rapide et par le test Elisa
GenScreen HIV1/2 (Bio-Rad, France). L’examen direct des biop-
sies de lésions cutanées après coloration de Gomori-Grocott ou
Giemsa, révélait des éléments levuriformes, ovales, parfois septés,
typiquement intrahistiocytaires, mesurant 3 à 5 m de diamètre.
Le diagnostic de pénicilliose reposait sur la mise en culture des
biopsies cutanées et/ou l’hémoculture standard sur milieu de
Sabouraud-chloramphénicol (Bio-Rad, France). P. marneffei était
identifié par la diffusion de pigment rouge vif dans la gélose, visi-
ble après 24 heures de culture au revers de la boîte de Pétri, et sur
son caractère dimorphique, filamenteux à 24 ◦C et levuriforme à
37 ◦C. Afin d’éviter tout risque de contamination, en l’absence de
laboratoire de sécurité biologique de classe 3, les cultures étaient
examinées sans réouverture des boîtes dont le couvercle était fermé
à l’aide d’un ruban adhésif.
2.4. Protocole thérapeutique
Le traitement curatif des cas de pénicilliose comportait
l’amphotéricine B à la dose de 0,6 mg/kg par jour pendant deux
semaines, puis l’itraconazole à la dose de 400 mg/j pendant dix
semaines [31]. Il était suivi d’un traitement d’entretien en prophy-
laxie secondaire par l’itraconazole, à la dose de 200 mg/j, prolongé
à vie ou jusqu’à restauration immunitaire.
2.5. Suivi des patients
Les signes cliniques de pénicilliose et d’éventuelles infections
associées étaient enregistrés à l’entrée. L’évolution de la pénicil-
liose sous traitement antifongique a été évaluée selon les critères
suivants :

814 V. Vu Hai et al. / La Revue de médecine interne 31 (2010) 812–818
•disparition de la fièvre ;
•amélioration de l’état général : les patients peuvent reprendre
leurs activités quotidiennes ;
•régression des lésions cutanées : les lésions diminuent en taille
et en nombre, aucune nouvelle lésion n’apparaît ;
•guérison des lésions cutanées : aucune lésion en relief, la peau ne
présente plus que des cicatrices planes.
2.6. Considérations éthiques
Le projet s’est déroulé dans le cadre de la prise en charge
habituelle des patients infectés par le VIH, sans intervention sup-
plémentaire, sous la supervision du programme Esther (coopéra-
tion interhospitalière franco-vietnamienne) et avec l’agrément de
la direction de l’hôpital Viet Tiep. Les données recueillies ont été
rendues anonymes pour préserver la confidentialité.
2.7. Analyses statistiques
Les données ont été traitées par le logiciel EpiData 3.1 (The
EpiData Association ; http://www.epidata.dk) et analysées par
le logiciel Stata 9.2 (StataCorp LP ; http://www.stata.com). Les
comparaisons ont été faites par le test Khi2avec un seuil de sig-
nificativité égal à 0,05.
3. Résultats
3.1. Résultats globaux
Au cours des trois années d’étude, 1363 patients infectés par le
VIH ont été hospitalisés, dont 874 (64 %) pour des IO et 94 (6,9 %)
pour une infection à P. marneffei. Par sa fréquence, la pénicilliose
(11 %) se situait au troisième rang des IO classantes après la tuber-
culose (41 %) et la candidose oropharyngée et/ou œsophagienne
(36 %), avant la neurotoxoplasmose (9 %), la cryptococcose (9 %), les
infections à Mycobacterium avium (MAC) (8 %) et la pneumocystose
(5 %).
3.2. Profil général des patients
Les 94 patients, âgés de 23 à 67 ans (moyenne 33 ans), étaient
en majorité de sexe masculin (87 %), chômeurs (62 %), d’un niveau
d’éducation primaire ou secondaire (97 %), d’origine urbaine ou
périurbaine (83 %). Deux tiers avaient été hospitalisés en saison des
pluies, 46 % avaient eu un contact avéré avec le sol et 21 % se souve-
naientavoireudescontactsavecdesratsdebambou.Lesprincipaux
modes présumés d’infection par le VIH étaient l’utilisation de
drogues injectables avec partage des aiguilles (58 %) et les rapports
hétérosexuels non protégés (37 %). Dans 78 % des cas, la pénicil-
liose succédait tardivement à d’autres IO classantes : tuberculose
(49 %), candidose à prédominance oropharyngée (52 %), neurotox-
oplasmose (16 %), pneumocystose (11 %) et infection à MAC (11 %).
La prévalence des co-infections était de 46 % pour le VHC et de 30 %
pour le VHB.
3.3. Caractéristiques cliniques
Le motif d’hospitalisation le plus fréquent était la fièvre (99 %).
La température moyenne à l’admission était de 38,8 ◦C (extrêmes :
37,4–40 ◦C). Il s’agissait d’une fièvre persistante, évoluant depuis
trois à 90 jours (moyenne : 23,5 jours), à recrudescence nocturne
(40 %), accompagnée de frissons (86 %), de myalgies (67 %), de
sueurs (47 %). L’atteinte de l’état général était fréquente avec
fatigue (98 %), amaigrissement (88%) et anorexie (84 %). Des lésions
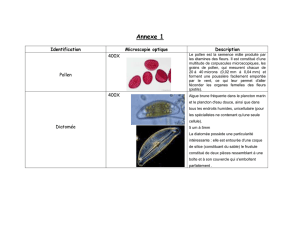
cutanées étaient présentes dans 86 % des cas (Tableau 1). Il s’agissait
de lésions papulopustuleuses, acnéiformes ou ulcérées, souvent
Tableau 1
Principaux symptômes et signes cliniques de 94 cas de pénicilliose à l’admission
(hôpital Viet Tiep, Haïphong, juillet 2005–juin 2008).
Symptômes Patients
n%
Fièvre 93 98,9
Fatigue 92 97,9
Amaigrissement 83 88,3
Lésions cutanées 81 86,2
Anorexie 79 84,0
Pâleur 72 76,6
Hépatomégalie et/ou splénomégalie 65 69,2
Polyadénopathie (à prédominance cervicale) 64 68,1
Diarrhée 43 45,7
Douleurs abdominales 43 45,7
Toux sèche 34 36,2
Ictère 25 26,6
Ascite 13 13,8
Dyspnée 5 5,3
Total 94 100
à centre ombiliqué (aspect dit de «pseudomolluscum contagio-
sum »), indolores et non prurigineuses, disséminées sur la face, le
tronc et les membres (Fig. 1). Parmi ces patients, trois patients ne
présentaient cliniquement que des douleurs abdominales.
Fig. 1. Lésions cutanées observées au cours de la pénicilliose.

V. Vu Hai et al. / La Revue de médecine interne 31 (2010) 812–818 815
Tableau 2
Co-infections des patients atteints de pénicilliose.
Co-infections Nombre de
patients
(n= 78)
Pourcentage (%)
Candidose (surtout buccale) 42 53,8
Tuberculose 19 24,4
Infection à MACa12 15,4
Pneumocystose 4 5,1
Zona 2 2,6
Infection à Herpes simplex 2 2,6
Autres infections bactériennesb10 12,8
aInfection à Mycobacterium avium.
bStaphylococcus aureus (deux cas), Streptococcus pneumoniae (deux cas), Staphy-
lococcus epidermidis (un cas), Samonella typhi (un cas), Samonella paratyphi (un cas),
Escherichia coli (un cas), rickettsiose (un cas), bacille à Gram négatif (un cas).
3.4. Caractéristiques biologiques, microbiologiques et
radiologiques
Le taux moyen de lymphocytes CD4 à l’admission était de
29/mm3(extrêmes : 2–196/mm3). La plupart des patients (87%)
avaient des lymphocytes CD4 inférieurs à 50/mm3.
Les autres perturbations biologiques étaient l’augmentation de
la protéine C-réactive (CRP) (fréquence : 94 %, moyenne : 36 mg/L),
une anémie modérée à sévère (fréquence : 77 %, taux moyen
d’hémoglobine : 9 g/dL), une atteinte hépatique avec élévation
des alanine-aminotransférases (ALAT) (fréquence : 72%, moyenne :
84 UI/L) et de la bilirubinémie (fréquence : 40 %, moyenne :
61 mol/L) ; une hypoprotidémie (fréquence : 27 %, moyenne :
51 g/L).
La radiographie thoracique et l’échographie abdominale ont été
pratiquées systématiquement. Les clichés thoraciques montraient
des lésions pulmonaires chez 29 % des patients, se répartis-
sant en infiltrats réticulonodulaires parenchymateux (67 %) et en
lésions interstitielles (33 %). L’échographie abdominale révélait une
hépatomégalie ou une hépatosplénomégalie (72 %), des ganglions
abdominaux (50 %), une ascite modérée (15 %).
Sur 80 patients présentant des lésions cutanées, 75 (94 %)
avaient des levures visibles à l’examen direct après coloration
de Giemsa ou de Gomori-Grocott, ou cultivables sur milieu de
Sabouraud. Les hémocultures étaient positives dans 90 % des cas.
3.5. Diagnostic et classification
Parmi les 94 patients avec une infection confirmée à P. marneffei,
85 avaient une forme disséminée, neuf une forme localisée cutanée.
Soixante-dix-huit patients (83 %) étaient au stade sida lors de
l’apparition de la pénicilliose, avec des IO dominées par les can-
didoses et la tuberculose (Tableau 2). Parmi les 16 autres cas
(17 %), la pénicilliose a révélé l’infection à VIH chez trois patients,
13 connaissant déjà leur séropositivité VIH.
3.6. Traitement et évolution
Sur ces 94 patients, 68 (72 %) ont bénéficié d’un traitement
antirétroviral, 22 avant l’apparition de la pénicilliose et 46 après.
Pour les patients déjà sous antirétroviraux, le délai moyen entre
le début du traitement antirétroviral et l’apparition de la pénicil-
liose était de 1,5 mois, 86 % des patients ayant débuté le traitement
depuis moins de trois mois. Il s’agissait d’un traitement de pre-
mière ligne (zidovudine ou stavudine + lamivudine + névirapine ou
éfavirenz) pour 67 patients et un traitement de deuxième ligne
(ténofovir + abacavir + lopinavir) chez un patient.
Le traitement curatif de la pénicilliose a pu suivre le schéma
de référence (amphotéricine B relayée par itraconazole) pour
41 patients. Une rupture d’approvisionnement en amphotéricine
B a contraint de traiter les 53 autres patients par l’itraconazole seul
à la dose de 400 mg/j pendant 12 semaines. Le taux de mortalité
était de 17 % et 19 % chez les patients traités respectivement par
amphotéricine B puis itraconazole ou par itraconazole seul. Il n’y
avait pas de différence de terrain entre les deux groupes, en ter-
mes d’âge, d’antécédents, de co-infections ou de profondeur de
l’immunodépression (Tableau 3).
Au total, 75 des patients (80 %) ont guéri et 17 (18 %) sont
décédés, dix de fac¸ on précoce dans les premiers jours suivant
l’admission et sept plus tardivement, dans les quatre à 12 mois
après le diagnostic de pénicilliose (deux patients ont été perdus
de vue). Parmi les 17 patients décédés, neuf avaient une co-
infection sévère (six infections respiratoires, deux encéphalites et
une septicémie à Staphylococcus epidermidis), trois avaient une mal-
adie associée (insuffisance rénale chronique, hémorragie digestive,
hépatite toximédicamenteuse). La mort des patients était directe-
ment attribuable à la pénicilliose dans deux cas et indirectement
dans un cas, le patient étant décédé à la suite d’une réaction de
type IRIS (syndrome de restauration immunitaire). Dans les deux
cas restants, aucune cause précise de décès n’a été identifiée.
Prescrit dans un contexte épidémiologique, clinique et par-
aclinique comparable, le traitement de référence a montré une
meilleure efficacité que la monothérapie par itraconazole en ter-
mes de reprise d’activité quotidienne, de disparition de la fièvre, de
régression et de guérison des lésions cutanées (Tableau 3).
Sur 75 patients qui ont bénéficié d’une prophylaxie secondaire
par itraconazole, quatre (5 %) ont eu une rechute et 11 (15 %) ont
pu arrêter le traitement prophylactique grâce à une restauration
immunitaire après huit à 32 mois de traitement antifongique et
antirétroviral, attestée par un taux de lymphocytes CD4 supérieurs
à 200/L pendant six mois.
4. Discussion
Avec 94 cas de pénicilliose documentés sur une période de trois
ans, cette série est numériquement la plus importante rapportée.
Ellea permis de confirmer la fréquence de cette mycosesystémique,
tropicale et quasi exclusivement asiatique qui se place à Haïphong
au troisième rang des IO au cours du sida, après la tuberculose et
la candidose, mais avant la cryptococcose, à la différence du Cam-
bodge et de la Thaïlande [7]. Elle confirme aussi la survenue tardive
de cette IO au cours du sida : 83 % des patients avaient en effet
déjà présenté une ou plusieurs IO antérieurement à la pénicilliose
et 87 % avaient moins de 50 lymphocytes CD4/mm3. Ces résultats
corroborent ceux d’une étude indienne réalisée en 2002 dans l’état
de Manipur où 25,3 % des patients hospitalisés infectés par le VIH
étaient atteints de pénicilliose, ainsi que des observations simi-
laires faites dans le Nord-Est de la Thaïlande [7,18]. Notons que,
au cours de cette période, aucun cas de pénicilliose n’a été observé
à Haïphong chez des patients non infectés par le VIH ni chez des
patients infectés par le VIH mais immunocompétents.
La recrudescence des cas au cours de la saison des pluies, égale-
ment constatée en Thaïlande, suggère que l’humidité pourrait être
un facteur favorable à la transmission de P. marneffei [20,21]. La plu-
part des patients vus à Haïphong habitent des arrondissements du
centre-ville où n’existent ni bambous, ni rats de bambou. Bien que
45 % d’entre eux aient eu des contacts avec la terre et 21 % avec les
rats de bambou, les sources de contamination par P. marneffei et les
voies de transmission restent pour une grande part inconnues.
Sur le plan clinique, la pénicilliose est en général disséminée
(90 % des cas de cette série). Trois éléments sont évocateurs sans
être spécifiques :

816 V. Vu Hai et al. / La Revue de médecine interne 31 (2010) 812–818
Tableau 3
Caractéristiques des patients et évolution comparée sous traitement de référence par amphotéricine B (amB) suivie par itraconazole (Itra) et sous monothérapie par
itraconazole.
Traitement antifongique p
amB + Itra (n= 39) Itra (n= 53)
Sexe Homme 33 47 0,57
Femme 6 6
Âge moyen (ans) 33,0 (30,6–35,3) 32,7 (31,3–34,1) 0,82
ATCD-ART Oui 11 10 0,29
Non 28 43
AZT/3TC/NVP Oui 8 3 0,05
Non 3 7
AZT/3TC/EFV Oui 1 4 0,10
Non 10 6
D4T/3TC/NVP Oui 1 2 0,48
Non 10 8
D4T/3TC/EFV Oui 1 1 0,94
Non 10 9
ATCD-IO Oui 34 42 0,32
Non 5 11
ATCD-TB Oui 15 20 0,76
Non 19 22
Co-infection à VHB Oui 14 14 0,33
Non 25 39
Co-infection à VHC Oui 21 20 0,12
Non 18 33
Fièvre Oui 39 52 0,39
Non 0 1
Fatigue Oui 37 53 0,10
Non 2 0
Amaigrissement Oui 34 47 0,83
Non 5 6
Lésions cutanées Oui 34 45 0,76
Non 5 8
Anorexie Oui 33 44 0,84
Non 6 9
Pâleur Oui 28 42 0,41
Non 11 11
Hépatomégalie Oui 20 37 0,07
Non 19 16
Splénomégalie Oui 7 18 0,09
Non 32 35
Polyadénopathie Oui 29 33 0,22
Non 10 20
Diarrhée Oui 21 21 0,18
Non 18 32
Douleurs abdominales Oui 15 28 0,17
Non 24 25
Toux sèche Oui 16 18 0,49
Non 23 35
Ictère Oui 10 15 0,78
Non 29 38
Ascite Oui 4 8 0,50
Non 35 45
Dyspnée Oui 2 3 0,91
Non 37 50
Lésions pulmonaires Oui 11 15 0,99
Non 28 38
Échographie abdominale anormaleaOui 30 47 0,13
Non 9 6
 6
6
 7
7
1
/
7
100%