1/10
GENERALITES SUR LA PHARMACOLOGIE
Objectifs :
1/ Définir la Pharmacologie
2/ Définir le médicament
3/ Citer les 3 catégories de médicaments
4/ Comparer les 3 différentes dénominations des médicaments
5/ Décrire les règles de prescription des médicaments appartenant aux substances
vénéneuses
6/ Classer les médicaments selon les résultats attendus lors de leur utilisation.
I/ DEFINITION DE LA PHARMACOLOGIE
Selon le Larousse Médical (1989), la pharmacologie est l’étude descriptive des
médicaments, de leur préparation, de leur emploi, de leur posologie et de leurs
indications.
Pour beaucoup d’auteurs, la pharmacologie est la science des médicaments.
Cependant, il est nécessaire de limiter davantage l’objet de la pharmacologie car
celle-ci ne saurait couvrir toutes les connaissances relatives aux médicaments.
Il a été ainsi proposé de définir la pharmacologie comme « la science qui étudie
les interactions de toute substance avec tout système biologique dans le but
d’applications thérapeutiques ou d’une meilleure compréhension de
physiologie ou de la physiopathologie ».
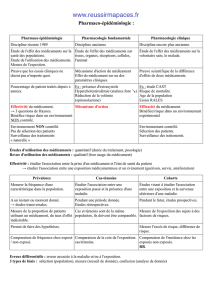
Ces interactions sont divisées en deux types :

2/10
- les actions du médicament sur l’organisme constituant la pharmacodynamie
(ce que le médicament fait sur l’organisme : diminution de la pression
artérielle, diminution de la glycémie, diminution de la température).
- Les actions de l’organisme sur le médicament représentant la
pharmacocinétique (ce que l’organisme fait sur le médicament, comment
par exemple le médicament est absorbé ou métabolisé).
La pharmacocinétique a pour objet l’étude descriptive et quantitative du devenir
d’un médicament dans l’organisme. Elle permet ainsi de déterminer grâce aux
processus d’Absorption, de Distribution, de Métabolisation et d’Elimination
(Système ADME), à quelle concentration et pendant combien de temps le
médicament sera présent au niveau de l’organe cible.
Elle permet ainsi d’établir la relation entre la dose administrée et la concentration
obtenue.
La pharmacodynamie, elle, établit la relation entre la concentration et l’effet.
C’est la concentration qui fournit le lien entre la pharmacocinétique et la
pharmacodynamie.
N.B. La pharmacologie clinique est une branche de la pharmacologie qui s’occupe
de la mise en évidence des effets thérapeutiques des médicaments chez l’Homme.
Elle repose sur la réalisation d’essais cliniques ou d’essais thérapeutiques.
La Pharmacovigilance est définie selon l’OMS comme « la science et les activités
relatives à la détection, à l’évaluation, à la compréhension et à la prévention des
effets indésirables ou de tout autre problème lié aux médicaments » ou aux autres
produits de santé.

3/10
II/ DEFINITION DU MEDICAMENT
Selon l’article L-511 du code de la Santé publique (1967) en France, « on entend
par médicament toute substance ou composition présentée comme possédant des
propriétés curatives ou préventives à l’égard des maladies humaines ou animales,
ainsi que tout produit pouvant être administré à l’homme ou à l’animal, en vue
d’établir un diagnostic médical (Iode) ou de restaurer (vitamines), corriger
(insuline) ou modifier leurs fonctions organiques (pilules).
III/ CATEGORIES DE MEDICAMENTS
III.1) Produits officinaux
Ce sont des produits que les pharmaciens doivent détenir dans leur officine, et
dont les caractéristiques monographiques sont décrites dans un livre, la
PHARMACOPEE. Ils comprennent
- des drogues (opium)
- des produits chimiques purs (exemple : codéine, Isoniazide)
- des préparations galéniques (de Galien) obtenues à partir d’une ou de
plusieurs drogues
Elixir BONJEAN® (extraits hydro-alcoolique de mélisse, d’orange amère,
d’anis vert etc.)
III.2) Préparations magistrales
Il s’agit de médicaments destinés à un seul malade et dont la composition est
indiquée par le médecin et qui sont préparés extemporanément par le pharmacien.
Les substances utilisées sont décrites dans la pharmacopée. Cette forme n’est
pratiquement plus utilisée en Afrique mais reviendrait petit à petit en Europe.

4/10
III.3) Spécialités pharmaceutiques
Selon le code de Santé Publique (1967) en France « on entend par spécialité
pharmaceutique, tout médicament préparé à l’avance, présenté sous un
conditionnement particulier et caractérisé par une dénomination spéciale.
Aucune spécialité ne doit être débitée à titre gracieux ou onéreux si elle n’a pas
reçu, au préalable, une autorisation de mise sur le marché (AMM) délivrée par le
Ministère chargé de la Santé en général ou des agences nationales de
réglementation (ANR) comme la FDA (Food and Drug Administration) aux
USA, au Ghana, l’ANSM (Agence Nationale de Sécurité du Médicament et des
produits de santé) en France, la NAFDAC ( National Agency for Food and Drug
Administration and Control) au Nigéria, Agence sénégalaise de Réglementation
pharmaceutique (ARP) créée en 2022 en remplacement de la Direction de la
Pharmacie et du Médicament et du Laboratoire national de contrôle des
Médicaments.
Cette AMM est, en principe, si elle est délivrée dans des conditions
appropriées, un label indiquant que le Médicament est de qualité, efficace et
sûr. N.B.
- Médicaments génériques
C’est une copie d’un médicament original ou médicament princeps dont le brevet
est tombé dans le domaine public. Il a la même composition qualitative et
quantitative en principe actif (on parle de plus en plus de substance active en lieu
et place de principe actif) et la même forme pharmaceutique que le médicament
original. De plus, il y a une bioéquivalence entre le générique et le médicament
original.
-Principales structures impliquées dans la gestion des médicaments au
Sénégal

5/10
Agence sénégalaise de Réglementation Pharmaceutique (ARP) (site internet :
www.dirpharm.sn)
Pharmacie nationale d’Approvisionnement : Approvisionnement du secteur
public en médicaments essentiels génériques. La PNA approvisionne aussi le
secteur privé pour une liste limitative et pour l’insuline via les grossistes
répartiteurs privés
Grossistes Répartiteurs privés qui approvisionnement le secteur privé en
médicament (Laborex, Ubipharm Sénégal, Duopharm, Sodipharm)
Centre anti poison
IV/ ORIGINES DES MEDICAMENTS
IV.1) Naturelle :
On désigne sous le nom de drogues les produits naturels employés tels qu’ils
existent pour leurs propriétés thérapeutiques, ou à partir desquels il est possible
d’extraire des médicaments. Il est donc impropre d’utiliser le mot « drogues »
pour désigner les médicaments eux-mêmes.
On retire des drogues des médicaments dont la synthèse est encore impossible ou
d’un prix de revient trop élevé.
Exemple : du Pancréas, on extrayait de l’insuline, du Penicillium (champignon)
de la Pénicilline et de l’opium, on extrait la morphine.
IV. 2) Artificielle
A l’heure actuelle, de très nombreux médicaments sont obtenus par synthèse, soit
on reproduit ainsi à moindre prix des substances naturelles (exemple : codéine),
soit on prépare des molécules de structure apparentée ou totalement différente
(Paracétamol).
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%