M DIOUF LJST 1°S
www.juufpc.jimdo.com Page | 1
Leçon n°1 : HYDROCARBURES SATURES : LES ALCANES
DUREE : 06H CLASSE:1°S
INTRODUCTION
Une molécule organique comporte un squelette carboné et, éventuellement, des groupes
caractéristiques. Ces groupes caractéristiques seront étudiés dans les prochains chapitres.
Nous introduirons ici la notion de squelette carboné en partant des molécules organiques les
plus simples qui ne font intervenir que les éléments carbone et hydrogène. Pour cette raison on
les appelle hydrocarbures. On évoquera dans cette leçon les hydrocarbures insaturés très
utilisés comme carburants que l’on rencontre dans les pétroles et les gaz naturels.
Cette leçon comporte quatre (04) paragraphes.
1. DEFINITION ET STRUCTURE SPATIALE
1.1. DEFINITION
Un alcane est un hydrocarbure dont la molécule ne comporte que des liaisons covalentes
simples. On dit que la molécule est saturée. Ainsi tous les atomes de carbone sont tétraédriques
et tétragonaux. Les alcanes possèdent une formule générale de la forme R-H (R- est un groupe
alkyle). La formule brute d'un alcane non cyclique peut s'écrire CnH2n+2 où n est un entier non
nul.
1.2. STRUCTURE SPATIALE
1.2.1. LE CARBONE TETRAEDRIQUE
Exemples : Représentation de Lewis et de Cram des molécules de CH4 et de C2H6.
1.2.2. NOTION DE CONFORMATION.
La liaison C-C de l’éthane, appelée liaison « sigma », mesure 110 picomètre pm (1pm =10-12m).
Les liaisons autour de chaque atome de carbone font entre elles des angles de 109°28’ au
maximum
La libre rotation autour des liaisons C-C permet à la molécule d’avoir plusieurs représentations
spatiales appelées conformations dont deux qui présentent une symétrie particulière (la
conformation éclipsée et la conformation décalée).
Ces dernières sont données ci-dessous par la représentation de CRAM et de NEWMAN dans
laquelle la molécule est regardée suivant la liaison C-C.

M DIOUF LJST 1°S
www.juufpc.jimdo.com Page | 2
A. CAS DE L’ETHANE
Ethane : Prenons comme solide de référence un groupe méthyle et faisons tourner, par rapport
à ce référentiel, l’autre groupe méthyle autour de l'axe carbone-carbone. Cette rotation est
possible car elle ne demande pas beaucoup d’énergie. Les chocs dus à l’agitation thermique à la
température ordinaire suffisent.
B. CAS DU BUTANE
Le butane CH3 - CH2 - CH2 - CH3 possède trois liaisons simples C - C et présente une infinité de
conformations résultant de la rotation possible des divers groupes les uns par rapport aux
autres autour de chacune de ces liaisons simples. Parmi celles-ci, les plus intéressantes à
étudier sont celles que l'on observe par rotation autour de la liaison simple existant entre les
carbones Cβ et Cγ (les 4 atomes de carbone sont repérés par les lettres α, β, γ, δ).
La projection de Newman montre que les conformations éclipsées, qui étaient identiques pour
l'éthane sont, ici, différentes.
CRAM NEWMAN

M DIOUF LJST 1°S
www.juufpc.jimdo.com Page | 3
De même les trois conformations décalées sont, ici, différentes (elles étaient identiques dans le
cas de l'éthane).
2. NOMENCLATURE DES ALCANES
2.1. LES ALCANES A CHAINE CARBONEE LINEAIRE
Un alcane est linéaire si , dans sa molécule, chaque atome de carbone est lié au plus à deux
atomes de carbone. Les atomes de carbone se trouvent les uns à la suite des autres. Il n'y a pas
de ramifications.
Exemple: CH3-CH2-CH2-CH2-CH3 et
Les quatre premiers alcanes portent des noms usuels. Les alcanes suivants portent des noms
qui indiquent en préfixe grec le nombre d'atomes de carbone suivi de la terminaison « ane »
soit de la forme préfixe grec + suffixe ane.
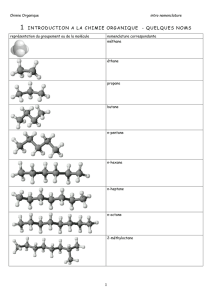
Formules semi-développées planes et nomenclature de quelques molécules usuelles.
méthane
CH4
éthane
CH3 - CH3
propane
CH3 - CH2 - CH3
butane
CH3 - CH2 - CH2 - CH3
pentane
CH3 - CH2 - CH2 - CH2 - CH3
hexane
CH3 - CH2 - CH2 - CH2 - CH2 - CH3
heptane
CH3 - CH2 - CH2 - CH2 - CH2 - CH2 - CH3
Pour aller plus loin
octane
nonane
décane
undécane
pentadécane
cétane
eicosane
triacontane ou tricosane
dodécane
C8H18
C9H20
C10H22
C11H24
C15H32
C16H34
C20H42
C30H62
C12H26
׀ ׀
CH2 - CH2
CH3 CH2 - CH3

M DIOUF LJST 1°S
www.juufpc.jimdo.com Page | 4
2.2. LES ALCANES A CHAINE CARBONEE RAMIFIEE
Une molécule possédant n atomes de carbone et (2n+2) atomes d'hydrogène, si n > 3, peut
présenter une squelette carboné non linéaire c’est à dire à partir de quatre atomes de carbone
le squelette peut compter des ramifications.
Un alcane est ramifié si, dans sa molécule, il existe des atomes de carbone qui sont directement liés
au moins à trois atomes de carbone.
Exemple :
On nomme un alcane ramifié en considérant qu'il est formé d'une chaîne principale sur laquelle
se fixent des groupes qui peuvent être des atomes ou des groupes alkyles.
LA CHAINE PRINCIPALE : La chaine principale est la chaine carboné la plus longue
LE GROUPE ALKYLE : Lorsqu’on enlève un atome d’hydrogène à un alcane on obtient un
groupe alkyle.
A. NOMENCLATURE DES GROUPEMENTS ALKYLES LES PLUS COURANTS
Pour nommer un groupe alkyle linéaire non ramifié, on remplace la terminaison « ane » de
l’alcane par « yle ».
Exemple :
CH3 - est le groupe méthyle
CH3 - CH2 - est le groupe éthyle
CH3 - CH2 - CH2 - est le groupe propyle
CH3 - CH2 - CH2 - CH2 - est le groupe butyle
CH3 - CH2 - CH2 - CH2 - CH2 - est le groupe pentyle
CH3 - CH2 - CH2 - CH2 - CH2 - CH2 - est le groupe hexyle
Remarque: Lorsque le groupe alkyle est ramifié, l’atome de carbone dont l’atome d’hydrogène
est enlevé porte le numéro 1.
Exemples : CH3 – CH(CH3) – : 1-méthyléthyle ;
CH3 – C(CH3)2 – : 1,1-dméthyléthyle;
CH3 –C(CH3)2- CH2 -: 2,2-diméthylpropyle
Cependant, on peut utiliser une appellation plus simple lorsque le groupe alkyle est ramifié,
voir tableau ci – dessous :
H- CH-CH2- CH – CH3
| |
CH3 CH3

M DIOUF LJST 1°S
www.juufpc.jimdo.com Page | 5
Radical
Formule brute
Formule semi-développée
Méthyle
CH3 -
CH3 -
Ethyle
C2H5 -
CH3 - CH2-
Propyle
C3H7 -
CH3 - CH2 - CH2 -
Isopropyle
C3H7 -
CH3 - CH (CH3) -
Butyle
C4H9 -
CH3 - CH2 - CH2 - CH2 -
Isobutyle
C4H9 -
CH3 - CH (CH3) - CH2 -
Tertiobutule
C4H9 -
(CH3)3C - ter-butyle
Pentyle
C5H11 -
CH3 - CH2 - CH2 - CH2 - CH2 -
Néopentyle
C5H11 -
(CH3)3C - CH2 -
B. REGLE DE NOMENCLATURE DES ALCANES RAMIFIES
La nomenclature d’un alcane ramifié s’effectue en quatre étapes successives suivant les règles
de l’IUPAC (International Union of Pur and Applied Chemistry) ou UICPA (Union Internationale
de la Chimie Pure et Appliquée) :
Etape 1 : On cherche la chaîne carbonée la plus longue. C'est elle qui donne son nom à l'alcane.
Si une molécule présente deux ou plusieurs chaînes d'égale longueur, on choisit comme
principale la chaîne qui porte le plus grand nombre de substituant.
Etape 2 : En préfixe, on ajoute le nom (sans le e final) du groupe fixé sur la chaîne principale.
On repère sa position en numérotant la chaîne principale afin de donner le plus petit nombre
au carbone qui porte le groupe. Ce numéro est placé devant le nom du groupe.
Si la chaîne du substituant est elle même ramifiée la même règle s’applique: on recherche
d'abord la chaîne la plus longue puis on nomme toutes les annexes.
Etape 3 : Lorsqu'il y a plusieurs groupes identiques, on place le préfixe di-, tri-, tétra- devant le
nom du groupe.
Etape 4 : Lorsqu'il y a des groupes différents, on les nomme dans l'ordre alphabétique. Le plus
petit nombre étant affecté au groupe placé en tête dans l'ordre alphabétique.
NB : Deux chiffres sont séparés par une virgule et on met un tiret entre un chiffre et une lettre.
Exemples :
5-éthyl-3,4-diméthyloctane
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%