Chimie des Solutions : Rappels sur les Réactions Acido-Basiques
Telechargé par
jina lm

Chimie des Solutions – SMPC– S2
1
Rappels de cours – N°2
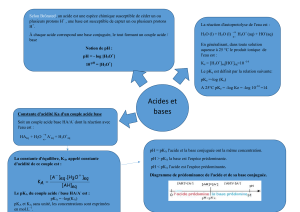
Les réactions chimiques par échange de protons Les réactions acido-basiques.
1.1. Théorie de Bronsted
Un acide : Espèce chimique qui peut libérer un ou plusieurs protons H+.
Ex : HCO2H + H2O HCO2- + H3O+
Une base : Espèce chimique qui peut capter un ou plusieurs protons H+.
Ex : NH3 + H2O NH4+ + OH-
1.2. Couple acide-base
On considère la réaction suivante :
HF + H2O H3O+ + F-
Le couple acide-base considéré est HF/F- avec F- est la base conjuguée de HF.
1.3. Le caractère amphotère
- L’eau peut jouer le rôle d’un acide ou d’une base, elle présente donc un caractère ampholyte
(deux rôles).
Ex : H2O est l’acide du couple H2O/OH-
H2O est la base du couple H3O+/ H2O
- Les acides aminés possèdent à la fois un hydrogène libérable et un doublet non liant ce qui
leur donnent un caractère amphotère.

Chimie des Solutions – SMPC– S2
2
1.4. Réaction des acides et des bases avec l’eau
- Un acide fort se dissocie totalement dans l’eau :
Acide Base
HCl + H2O ➞ H3O+ + Cl-
- Un acide faible se dissocie partiellement dans l’eau :
Acide Base
CH3CO2H + H2O CH3CO2-+ H3O+
- Une base forte est partiellement dissociée dans l’eau :
Base Acide
NaOH + H2O ➞ Na+ + OH-
- Une base faible est partiellement dissociée dans l’eau :
Base Acide
CH3CO2- + H2O CH3CO2H + H3O+
1.5. La réaction d’autoprotolyse de l’eau :
2H2O H3O+ + OH-
La constante d’équilibre de cette réaction est appelée produit ionique et se présente sous la
forme :
Ke = [H3O+].[ OH-] = 10-14
1.6. Relation entre le pKa et pKb d’un couple acide-base
Nous avons :
Avec : pKb= - log(Kb)
Et : pKa= - log(Ka)
Cette relation pKa + pKb =14, révèle que pour tout couple acide-base, plus l’acide sera fort plus
sa base conjuguée sera faible et réciproquement.
1.7. Forces des acides et des bases
a) Forces des acides
Comparer la force de deux acides faibles revient à comparer leur pKa. Ainsi, celui qui a le pKa
le plus petit (Ka plus grand) est relativement le plus fort.
Ex : Comparaison de la force des deux acides CH3CO2H et NH4+

Chimie des Solutions – SMPC– S2
3
= 10-4,8
= 4,8
= 10-9,2
= 9,2
Sachant que :
>
Ou également :
<
4,8 < 9,2
L’acide faible le plus fort des deux acides est celui qui a le Ka le plus grand et le pKa le plus
petit. Dans ce cas, l’acide faible le plus fort est CH3CO2H.
b) Force des bases
Comparer la force de deux bases faibles revient à comparer leur pKb. Ainsi, celle qui a le pKb
le plus petit est relativement la plus forte.
Ex : Comparaison de la force des deux bases CH3CO2- et NH3.
= 4,8
= 9,2
Nous avons :
On aura donc :
= 10-9,2
= 9,2
= 10-4,8
= 4,8
Sachant que :
>>
Ou également :
<
4,8 < 9,2
La base faible le plus fort des deux bases est celle qui a le Kb le plus grand et le pKb le plus
petit. Dans ce cas, la base faible la plus fort est NH3.
1.8. Echelle des pka
- L’eau est un solvant nivelant pour toutes les bases fortes et les acides forts qui sont totalement
dissociés dans l’eau.
Dans l’eau, Les acides plus forts que H3O+ et les bases plus fortes que OH- sont totalement
dissociés et ne peuvent pas être classés. Dans ce cas l’eau est dite solvant nivelant.
AH + H2O ➞ H3O+ + A-
B + H2O ➞ BH+ + OH-
Ces bases fortes et acides forts n’ont pas de Kb ni Ka puisqu’on a une dissociation totale.
- L’eau est un solvant différenciant pour toutes les bases faibles et les acides faibles puisqu’ils
sont partiellement dissociés dans l’eau.
AH + H2O H3O+ + A-
B + H2O BH+ + OH-

Chimie des Solutions – SMPC– S2
4
Dans ce cas chaque équilibre est caractérisé par son constant ka ou kb.
On peut classer les couples acide-base selon les valeurs de leurs pKa par rapport à celles des
couples H3O+/H2O et H2O/OH- de l’eau et établir l’échelle suivante :
pKa pKb
NaOH, KOH
H2O 14------0 OH-
NH4+ 9,2------4,8 NH3
CH3COOH 4,8------9,2 CH3COO-
HF 3,2------10,8 F-
H3O+ 0------14 H2O
HCl, HNO3, HClO4 et H2SO4
Dans l’eau, CH3COOH existe. En effet, cet acide est situé à l’intérieur du domaine délimité
par les deux couples H3O+/ H2O et H2O/OH-. Donc, l’acide se dissocie partiellement dans l’eau.
CH3COOH + H2O CH3COO- + H3O+
La basse NaOH ne peut pas exister dans l’eau : c’est une basse forte qui se dissocie totalement.
NaOH + H2O → Na+ + HO- + H2O
Cette échelle de pKa, permet de prévoir la réaction acido-basique spontanée qui se produit entre
l'acide le plus fort du 1er couple avec la base la plus forte du 2ème couple.
L’acide CH3COOH est plus fort que l’acide NH4+ et la base NH3 est plus forte que la base
CH3COO-.
γ
Acidité croissante
Basicité croissante
Les acides forts
Les bases fortes
ka (CH3COOH / CH3COO-) = 10-4,8
ka (NH4+/NH3)= 10-9,2
CH3COOH
CH3COO-
NH4+
NH3
-

Chimie des Solutions – SMPC– S2
5
Lorsqu’on mélange deux couples acide-base la réaction qui a lieu est celle de l’acide le plus
fort avec la base la plus forte. C’est la règle de gamma.
La réaction prévisible dans les conditions standard entre les couples (CH3CO2H/CH3CO2-) et
(NH4+/NH3) est :
La constante d’équilibre :
Si l'on considère la dissociation de NH4+ dans l’eau :
NH4++ H2O NH3 + H3O+
Si d'autre part on établit l’équation de dissociation de CH3CO2H dans l’eau :
CH3CO2H + H2O CH3CO2-+ H3O+
K =
K ˃ 1: la réaction est fortement déplacée dans le sens 1.
1
1
/
5
100%