-1-
Révisions 1BCPST
Partie VIII - Cinétique
TP6 – Cinétique d’une saponification
Réalisation préalable d’un bilan de matière
• Une réaction pour modéliser la transformation de l’ester…
Le protocole met en jeu une solution d’ester (l’acétate d’éthyle) et une solution d’hydroxyde de sodium. D’après le cours,
l’hydrolyse basique d’un ester est modélisée par la réaction dont l’équation s’écrit :
• … afin de pouvoir effectuer un bilan de matière :
L’outil du bilan de matière est le tableau d’avancement, ici dressé en concentration (mol.L-1) :
Introduit
En cours
Mélange 50 mL d’une solution aqueuse à la concentration « 2C0 » en ester avec 50 mL
d’une solution aqueuse à la concentration « 2C0 » en hydroxyde de sodium revient à
opérer une dilution par 2. La concentration initiale dans le mélange pour l’ester
comme pour l’hydroxyde de sodium est C0.
En particulier, on remarque qu’à un instant t quelconque,
Rappel sur la détermination d’ordres cinétiques par la méthode intégrale
La méthode la plus utilisée pour déterminer l’ordre d’une réaction est la méthode intégrale.
Sa mise en œuvre suppose s’effectue toujours en plusieurs étapes :
1. Formuler une hypothèse sur la valeur de cet ordre,
2. Intégrer la loi de vitesse dans cette hypothèse pour obtenir une loi modèle d’évolution de la concentration en réactif,
3. Mesurer au cours du temps la valeur de cette concentration par une méthode physique (fréquent) ou chimique (rare
car fastidieux),
4. Confronter, au moyen d’une construction graphique, les prévisions du modèle et les mesures réalisées pour valider ou
infirmer l’hypothèse sur l’ordre de la réaction.
5. Si l’hypothèse d’ordre s’avère non valide, il convient soit de questionner le protocole d’acquisition et la précision des
mesures effectuées, soit de formuler une nouvelle hypothèse sur l’ordre recherché.
Choix de conditions opératoires
La loi cinétique proposée pour l’hydrolyse basique des esters est de la forme :
Premier point d’attention : la dépendance de la « constante » de vitesse avec la température oblige à opérer à température fixée
afin de traiter k(T) comme une constante, et ainsi diminuer le nombre de variables à prendre en compte.

-2-
En pratique, le réacteur est immergé dans un grand volume d’eau afin de limiter les variations de sa température : plus
le volume d’eau est important, plus le transfert thermique entraînant une variation de sa température devra être
important… ce qui devrait prendre plus de temps.
Second point d’attention : lorsque la loi de vitesse imaginée s’écrit au moyen de plusieurs concentrations, il convient de réaliser
un mélange des réactifs qui permette de simplifier l’écriture de la loi de vitesse. Deux méthodes expérimentales sont possibles :
• Dégénérescence de l’ordre : consiste à introduire en grand excès l’un des réactifs afin de considérer sa concentration
comme constante au cours de la transformation. En pratique, sa concentration dans le mélange doit être au minimum
10 fois supérieure à celle des autres réactifs intervenant dans la loi de vitesse),
• Travail dans les proportions stœchiométriques : consiste à introduire les réactifs dans les attendues par l’équation de la
réaction. Ainsi, celles-ci restent, quel que soit l’avancement de la réaction, dans les proportions stœchiométriques.
Dans l’activité proposée, l’ester et l’ion hydroxyde sont introduits en même concentration afin de travailler dans les
proportions stœchiométriques. Les conditions de travail retenues permettent de simplifier l’écriture de la loi de vitesse :
Le choix d’opérer dans les proportions stœchiométriques permet seulement de
déterminer l’ordre global de la réaction.
Élaboration du modèle cinétique
Dans l’activité proposée, il est proposé d’envisager un ordre global égal à 2 :
Expression issue de la définition de la vitesse
Loi modèle postulée
Égalisation des expressions de v
Séparation des variables
Intégration
La validation de la loi cinétique passe par une construction graphique. Si l’évolution temporelle de l’hydrolyse basique de l’ester
peut être modélisée par une réaction d’ordre global 2, alors le tracé de
doit être une droite de :
• Coefficient directeur positif dont la valeur est celle de la constante de vitesse k à la température de l’expérience,
• Ordonnée à l’origine positive
.
Choix d’une méthode de suivi
Afin de valider la loi cinétique, il est nécessaire de construire un tableau des valeurs de à différents instants .
La mesure de par une méthode chimique obligerait à opérer périodiquement des prélèvements du milieu réactionnel, à
stopper l’évolution du système par trempe, puis à déterminer la concentration par titrage. La méthode s’avère lourde si l’on
souhaite obtenir au moins une dizaine de valeurs de concentrations.
Il est préférable d’opter pour une méthode physique consistant en la détermination d’une grandeur physique (absorbance,
conductivité, pH, pression, etc.) dont la valeur renseigne, directement ou indirectement, sur la concentration recherchée.

-3-
Sur le plan de la composition ionique du système, l’hydrolyse basique de l’ester revient à consommer un ion hydroxyde HO- et à
créer un ion acétate. La conductivité de la solution varie donc à mesure que la transformation avance. La conductimétrie s’avère
ici une méthode intéressante.
Dans le cas d’un suivi de l’évolution du système chimique par une méthode physique,
il convient d’exprimer la grandeur physique en fonction de l’avancement de la réaction
au moyen des lois modèles disponibles :
• Kollrausch pour la conductivité,
• Beer-Lambert pour l’absorbance,
• Relation d’état des gaz parfaits pour la pression totale.
Conductivité à un instant quelconque
Les valeurs des conductivités ioniques n’étant pas connues dans les conditions de
réalisation de l’expérience, il faut trouver un moyen de les déterminer.
A cet effet, il est utile d’exprimer la grandeur physique aux limites temporelles de
l’évolution du système (instant initial et au bout d’un temps infini en faisant
l’hypothèse d’une transformation totale).
Ce conseil s’applique aux suivis par spectrophotométrie et par mesure de pression.
A l’état initial C(t) = C0
Au bout d’un temps infini
(en faisant l’hypothèse d’une
transformation totale)
C(t) = C∞ = 0
Conclusion
La mesure périodique de la conductivité permet de connaître la concentration en ions hydroxyde à chaque instant, à
condition de disposer de valeurs pour les conductivités aux limites, et .

-4-
Mesure des conductivités aux limites
Conductivité initiale :
C’est une détermination impossible ! L’instant initial correspond à la mise en contact des réactifs. Or, l’homogénéisation
du milieu après mélange des deux solutions n’est pas instantanée… Au moment du mélange, le capteur du conductimètre
trempe donc nécessairement dans une zone plus riche en une solution que l’autre.
Le tableau d’avancement permet de retrouver la composition de l’instant initial. Les
seuls ions présents y sont les ions sodium et hydroxyde, tous deux à la concentration
C0. Par conséquent, pour obtenir la valeur de σ0, il suffit de diluer par 2 la solution
« mère » d’hydroxyde de sodium de concentration 2C0 et de mesurer sa conductivité.
Il est également possible de mesurer la conductivité de la solution mère et de la diviser
par 2 puisque celle-ci est proportionnelle aux concentrations.
Conductivité au bout d’un temps infini dans l’hypothèse d’une transformation totale :
Cette détermination est facile, mais l’hypothèse de transformation totale peut être non vérifiée. L’hydrolyse basique des
esters est réputée lente mais quasi-totale. En laissant le mélange des réactifs évoluer pendant plusieurs jours, on peut
espérer obtenir une valeur approchée de .
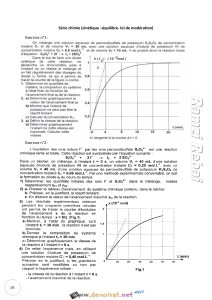
Validation du modèle à partir des mesures réalisées
Les points du tracé de
paraissent alignés ce qui autorise à réaliser une régression linéaire.
Regressi fournit les résultats suivants pour la régression linéaire :
Validation :
• Le coefficient directeur et l’ordonnée à l’origine sont positifs comme cela était attendu.
• Les résidus ne font pas apparaître une répartition aléatoire des points expérimentaux de part et d’autre de la droite de
régression : ils sont d’abord touts en-dessous, puis tous au-dessus, puis tous en-dessous : il est donc raisonnable de ne
pas conclure à une adaptation parfaite du modèle pour rendre compte des résultats expérimentaux.

-5-
Pourquoi le coefficient de corrélation n’est-il pas un argument robuste pour la
validation d’un modèle affine ?
Le coefficient de corrélation est un indicateur de l’éloignement des points
expérimentaux à la droite de régression obtenue par la méthode des moindres carrés.
A ce titre, le coefficient ne permet pas de dire que des points expérimentaux peuvent
être considérés comme alignés.
En effet, deux répartitions très différentes peuvent conduire à des coefficients de
corrélation identiques :
Il est donc important, avant de réaliser une régression linéaire sur la calculatrice, de
s’assurer visuellement du caractère raisonnablement affine de la distribution.
Regressi fournit un critère de validation plus robuste : les résidus, c’est-à-dire les écarts
en ordonnée entre un point expérimental et la droite de régression. En complément
d’une pré-validation visuelle,
• si le signe des résidus est aléatoire, alors le modèle affine peut être validé,
• s’il existe des tendances dans les signes des résidus, alors le modèle ne peut
être raisonnablement accepté.
Pour aller plus loin…
En admettant que le modèle d’une cinétique d’ordre 2 soit accepté, alors le coefficient directeur de la droite est
assimilable à la constante de vitesse à la température de l’expérience, soit .
En reproduisant l’expérience à une autre température, et grâce à la loi d’Arrhénius, il est possible d’obtenir une
évaluation de l’énergie d’activation.
1
/
5
100%