INTERROGATION DE CHIMIE : 2020-2021
Nom : ……………………… Prénom : ………………. Classe : ………
Moyenne de classe : ……… Note + : …… Note - : ……..
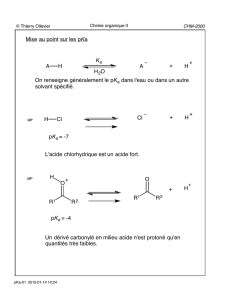
Le vinaigre qui assaisonne nos salades peut être considérée en simplifiant un peu comme une
solution aqueuse d’acide acétique à 8%. La formule brute de l’acide acétique est C2H4O2.
Données : Masses des atomes :
De carbone : mc = 2,00 x 10-26 kg
D’hydrogène : mH = 1,67 x 10-27 kg
D’oxygène : mO = 2,67 x 10-26 kg
vinaigre = 1,0 kg/L
1. Combien d’atomes d’hydrogène contient la molécule d’acide acétique ? (1 pt)
……………………………………………………………………………………………………………………………
2. Donner la masse d’une molécule d’acide acétique. (1,5 pt)
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
3. Calculer la masse de l’acide acétique contenu dans une bouteille de 1,0 L de vinaigre à 8,0 % en
masse. (1,5 pt)
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
4. En déduire le nombre de molécules d’acide acétique contenues dans une bouteille de 1,0 L de ce
vinaigre. (2 pts)
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
5. On peut aussi utiliser l’acide acétique pour laver les vitres. Lors d’un nettoyage de printemps on
utilise 1,52 x 1024 molécules d’acide acétique.
a. Quel est le volume de vinaigre utilisé. (2 pts)
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
b. Quelle quantité de matière d’acide acétique a-t-on utilisé ? (2 pts)
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….

INTERROGATION DE CHIMIE : 2020-2021
Nom : ……………………… Prénom : ………………. Classe : ………
Moyenne de classe : ……… Note + : …… Note - : ……..
Le vinaigre qui assaisonne nos salades peut être considérée en simplifiant un peu comme une
solution aqueuse d’acide acétique à 8,0 %. La formule brute de l’acide acétique est C2H4O2.
Données : Masses des atomes :
De carbone : mc = 2,00 x 10-26 kg
D’hydrogène : mH = 1,67 x 10-27 kg
D’oxygène : mO = 2,67 x 10-26 kg
vinaigre = 1,0 kg/L
1. Combien d’atomes d’hydrogène contient la molécule d’acide acétique ? (1 pt)
Elle contient 4 atomes d’hydrogène
2. Donner la masse d’une molécule d’acide acétique. (1,5 pt)
m(C2H4O2) = 2 x mc + 4 x mH + 2 x mO = 2 x 2,00 x 10-26+ 4 x 1,67 x 10-27+ 2 x 2,67 x 10-26
m(C2H4O2) = 1,00 x 10-25 kg
3. Calculer la masse de l’acide acétique contenu dans une bouteille de 1,0 L de vinaigre à 8% en
masse. (1,5 pt)
m(1L de vinaigre) = vinaigre x V = 1,0 x 1,0 =1,0 kg
m(acide acétique) = 1,0 x 8/100 = 0,080 = 8,0 x 10-2 kg
4. En déduire le nombre de molécules d’acide acétique contenues dans une bouteille de 1,0 L de ce
vinaigre. (2 pts)
N(C2H4O2) = 𝒎
𝒎𝐚𝐜 𝐚𝐜é𝐭𝐢𝐪𝐮𝐞 = 𝟎,𝟎𝟖𝟎
𝟏,𝟎𝟎×𝟏𝟎−𝟐𝟓 = 8,0 x 1023 molécules d’acide acétique
5. On peut aussi utiliser l’acide acétique pour laver les vitres. Lors d’un nettoyage de printemps on
utilise 1,52 x 1024 molécules d’acide acétique.
a. Quel est le volume de vinaigre utilisé. (2 pts)
On sait qu’il y a 8 x 1023 molécules d’acide acétique dans 1,0 L de vinaigre donc on utilise un
tableau de proportionnalité :
V = 𝟏,𝟎×𝟏,𝟓𝟐×𝟏𝟎𝟐𝟒
𝟖×𝟏𝟎𝟐𝟑
V = 1,9 L
b. Quelle quantité de matière d’acide acétique a-t-on utilisé ? (2 pts)
n = 𝑵
𝑵𝑨 = 𝟏,𝟓𝟐×𝟏𝟎𝟐𝟒
𝟔,𝟎𝟐×𝟏𝟎𝟐𝟑 = 2,52 mol d’acide acétique
Nombre de molécules
d’acide acétique
8 x 1023
1,52 x 1024
Volume de vinaigre en L
1,0
V
1
/
2
100%