TP 2 : Les enzymes digestives.
Animation : Enzymes
Ils existent des milliers d’enzymes qui interviennent simultanément dans des réactions chimiques.
Problèmes : Comment les enzymes agissent-elles sur leur substrat ? Comment font-elles pour « s’y
retrouver » ?
Hypothèse : il existe une spécificité enzyme-substrat. Elles reconnaissent leur substrat et s’y lient.
Activité 1 : Expérimenter le mode d’action des enzymes. (Noté)
La pepsine est une enzyme digestive active dans l’estomac où le pH est acide. Elle catalyse l’hydrolyse de liaisons
chimiques, en particulier celle des liaisons peptidiques entre acides aminés des protéines.
Ainsi, une solution trouble d’ovalbumine (protéine du blanc d’œuf) devient limpide après ajout de pepsine, ce qui
traduit l’hydrolyse de l’ovalbumine.
Problème à résoudre : On cherche à tester si la pepsine est également capable de catalyser l’hydrolyse de
liaisons glucidiques
Matériel : Verrerie (pipettes, tubes à essais, béchers) ; bain marie à 37°C, eau iodée, eau distillée, solution de
pepsine (5g/ 100mL), solution d’HCl ( 1mol/L), solution d’amidon (1%), solution d’ovalbumine, marqueur.


A. Une mutation de l’amylase.
Thème 3 CORRECTION : TP 2 : Les enzymes digestives. Activité 1 : Expérimenter le mode d’action des enzymes.
Nom/prénom :
Réponses attendues
Barème
1. Protocole et justification :
Pour tester si la pepsine peut catalyser l’hydrolyse des liaison glucidiques, il faut la mettre en
présence d’un glucide complexe (l’amidon) dans les conditions de son action ( 37°C, pH acide)
Si l’amidon est hydrolysé, on veut être sûrs que c’est bien grâce à la pepsine, donc il faut un tube
témoin avec amidon, sans pepsine.
Il faut aussi vérifier que la pepsine est efficace sur son substrat, il faut donc un tube avec de
l’ovalbumine et de la pepsine dans les conditions de son action ( 37°C, pH acide) et un tube témoin
sans pepsine pour vérifier l’action de cette dernière.
On prépare donc 4 tubes : T1 (témoin) : Ovalbumine + HCl ; T2 : Pepsine + ovalbumine + HCl ;
T3 (témoin) : Amidon + HCl ; T4 : Pepsine + amidon + HCl
On les place au bain marie à 37°C pendant 30 min puis on réalise les tests à l’eau iodée pur vérifier la
présence d’amidon sur T2 et T3 et on observe l’aspect des tubes T1 et T2 (laiteux ou limpide)
2
1
1
2
2
2. Résultats attendus :
- Si la pepsine ne peut catalyser l’hydrolyse des liaisons glucidiques les tests à l’eau iodée
seront positifs pour T3 et T4
- Si la pepsine peut catalyser l’hydrolyse des liaisons glucidiques les tests à l’eau iodée sera
positif pour T4 et négatif pour T3 (témoin)
1
1
3. Manipulations : soin, organisation, précision
2
Tableau de résultats des tests :
Contenu des
tubes
Résultats
T1 (témoin) :
Ovalbumine +
HCl
T2 : Pepsine +
ovalbumine +
HCl
T3 (témoin) :
Amidon + HCl
T4 : Pepsine +
amidon + HCl
Aspect des tubes
Laiteux
Plus limpide
Test à l’eau
iodée
Positif
positif
3
(titre/1 ;
construction/1 ;
résultats /1
4. Exploitation des résultats
Dans le Tube 1 sans pepsine, l’ovalbumine n’a pas été hydrolysée contrairement au tube 2 où la
pepsine était présente.
Dans les tube 3 et 4, avec ou sans pepsine, l’amidon n’a pas été hydrolysé.
Donc la pepsine n’est pas capable de catalyser ’hydrolyse des liaisons glucidiques. Elle ne peut
catalyser que celle des liaisons peptidiques.
La pepsine est spécifique d’un substrat (protéine) et d’une réaction (hydrolyse)
1
1
6. Gérer et ranger
1
TOTAL
20

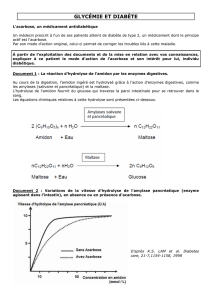
Activité 2 : Visualiser le mode d’action des enzymes
La structure de certaines enzymes est connue. Par la technique de la cristallographie aux rayons X, les scientifiques ont élaboré
des modèles moléculaires de l’enzyme seule ou de l’enzyme avec son substrat.
Problème à résoudre : On cherche à comprendre les modalités de l’action de l’enzyme sur le substrat en étudiant un
modèle présentant l’amylase et un petit fragment d’amidon.
Ouvrir le fichier « amylase_amidon » avec le logiciel RasTop (situé dans le dossier commun-SVT-spécialité-TP2 enzyme)
Colorer par chaîne puis afficher en Ruban pour observer la structure de la protéine (l’amylase apparaît en bleu, l’amidon en
rouge).
Afficher le fichier de la molécule pour visualiser sa composition.
1. Décrire brièvement la structure et la composition de l’amylase.
L’amylase a une forme ovale. C’est une protéine constituée d’une chaine d’acides aminés.
Choisir la représentation en bâtonnets.
Dans le cadre ‘Propriétés’, choisir ‘Protéiques’ et sélectionner (bouton avec un carré blanc sur un carré bleu).
Sélectionner ensuite la représentation en sphères (seule la protéine est affectée).
En utilisant l’éditeur de commandes, sélectionner les acides aminés n°197, 300, 233 ; sélectionner ce choix dans la fenêtre
« sélection des atomes » puis les afficher en sphère de couleur distincte.
Appeler le professeur.
Réaliser une capture écran puis réaliser un document légendé et titré du complexe enzyme-substrat dans un traitement de
texte ou d’image de votre choix.
Mettre en page de façon à obtenir 2 représentations du complexe sur une même page.
Appeler le professeur.
Imprimer.
2. Indiquer la position de l’amidon et expliquer le fonctionnement de l’amylase en prenant en compte l’ensemble de
votre travail.
Image du complexeAmylase – Amidon avec Rastop
Matériel :
Logiciel Rastop avec fiche technique.
Molécule : « Amylase_amidon » : Amylase en complexe avec son substrat, l’amidon.

Activité 3 : Etudier une mutation de l’amylase.
Des chercheurs ont réalisé des mutations contrôlées du gène contrôlant la synthèse de l’amylase.
Ils ont obtenu une Amylase pancréatique humaine mutée où l'acide aspartique en position 197 est remplacé par une
alanine
Ils ont ensuite mesuré l’activité de cette enzyme. Ces essais expérimentaux ont montré une diminution par un
facteur 100 000 de l'activité enzymatique par cette mutation, ce qui correspond à une disparition quasi totale de la
catalyse.
Expliquer l’inefficacité de l’enzyme mutée.
L’acide aminé muté fait partie des 3 acides aminés du site catalytique de l'enzyme, responsables de la réaction
d'hydrolyse des liaisons glucidiques entre unités de glucose de l'amidon. (Les autres acides aminés sont Glu233 et
Asp300).
La mutation de cette acide aminé doit modifier la structure spatiale (forme) du site de liaison de l’enzyme avec
son substrat (= site actif). Ainsi, l’enzyme se lie difficilement au substrat et ne peut donc agir efficacement sur
celui-ci.
Ceci explique l’inefficacité de l’enzyme.
Exercice : l’influence des facteurs du milieu.
A partir de l’étude des docs 1 et 2 p 154 et du doc 4 p 155, expliquer l’influence de la température et du pH
sur l’activité de l’amylase.
Observation : Doc 1 : Le test à la Liqueur de Fehling est positif uniquement pour le tube 1 où la température est de
37°C (= température du corps).
Déduction : L’amylase ne peut catalyser l’hydrolyse de l’amidon qu’à une certaine température.
Observation : Doc 2 : A Ph 6 et 7 correspondant au pH de la cavité buccale, les tests à l’eau iodée sont négatifs.
Déduction Plus le pH est acide plus les tests sont positifs.
L’amylase ne peut hydrolysée l’amidon que dans des valeurs de pH comprise entre 6 et 7.
Explication : Doc 4 : Un pH acide et une température trop basse ou trop élevée modifient la structure de l’amylase
qui ne peut être efficace.
L’amidon est entouré par l’amylase, elle
est située au niveau de certains acides
aminés. Grâce à cette fixation, l’amylase
peut agir sur l’amidon : elle catalyse
l’hydrolyse des liaisons glucidiques.
 6
6
1
/
6
100%