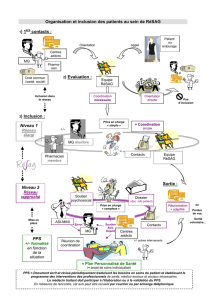
1
Introduction à la recherche clinique et épidémiologique
J. Warszawski, Faculté de médecine Paris-Sud
Synthese
B. Falissard
https://youtu.be/PxEevvWLlRw
Illustration vidéo sur les types d’enquêtes en épidémiologie (5 mn)
POUR VOUS ENTRAINER : Quizz en ligne
Les 6 quizz ci-dessous portent sur les différents types d'études.
Ils ont été commentés en cours 5 et 6.
Vous pouvez faire et refaire ces quizz à volonté.
Vous recevrez par mail une note avec les réponses commentées.
Le but est de vous auto-évaluer.
Les notes ne seront pas prises en compte pour l'examen.
Quizz 1a Quizz 1b Quizz 1c
Quizz 1d Quizz 1e Quizz 1f

2
Types d’objectifs en épidémiologie
•Mesurerl’ampleur,l’évolution aucoursdutempsetladistribution
géographique dephénomènesliésàlasantéauseindespopulationshumaines
•Décrirel’histoirenaturelled’unemaladieetsonpronostic
Epidémiologiedescriptive
•Identifierlesdéterminantsdesmaladies (étiologie,facteursderisque)etdes
comportementsdesanté
•Identifierles facteurspronostiquesd’unemaladie(dontlestraitementsreçus
danslecadredusoins)
Epidémiologieanalytique
•Evaluerl’efficacitéet/oulasécuritéd’interventionsensituationexpérimentale
–Enpopulation(programmesdeprévention…)
–Auprèsdepersonnesmalades (diagnostic,pronostic,thérapeutique,préventiondes
complications…)
Epidémiologieévaluative
La terminologie n’est pas
toujours consensuelle
(mais les approches
méthodologiques sont
communes) :
• on parle quelquefois
d’épidémiologie
clinique ou de
recherche clinique
pour les études
portant sur des
sujets malades
•Les essais
thérapeutiques et
les études
diagnostiques sont
plutôt considérées
comme de la
recherche clinique
1
Objectifs descriptifs
-Fréquence, distribution d’un indicateur M
-Répartition de l’indicateur dans l’espace
-Evolution de l’indicateur dans le temps
-Corrélation écologique entre plusieurs indicateurs
-Pronostic M (= survie par ex) d’une pathologie
Objectifs analytiques : recherche d’associations à visée
explicatives entre Met E
-Etiologie (causes) et facteurs de risque de maladie
-Facteurs pronostiques
-Déterminants de comportements
Enquêtes observationnelles sur échantillon
d’individus
•Enquête de cohorte RR, HR, OR
dont étude exposés/non exposés
•Enquête cas-témoins OR
•Enquête transversale : moins optimale OR,RR
Etudes expérimentales
•Essai contrôlé randomisé (OR, RR, HR, RRR)
Etudes quasi-expérimentales
•Etude avant/après (transversale répétée ou cohorte
interventionnelle)
•Etude ici/ailleurs
Objectifs évaluatifs (1) : évaluer l’efficacité M/ la
sécurité M d’une intervention E:
-Traitement
-Stratégie médicale
-Programme de prévention
-Stratégie diagnostique / dépistage
Objectifs sources de données
Etudes diagnostiques interventionnelles (si la méthode à évaluer ou la
méthode de référence est administrée pour l’étude) ou observationnelles
•Etude transversale avec étalon-or
Objectifs évaluatifs (2) : performances d’une méthode
de classement
-Méthode diagnostique, questionnaire …
Sur données groupées / surveillance épidémiologiques
Taux d’incidence brut et standardisé
Étude de corrélation écologique
Sur données individuelles / enquête observationnelle
•Enquête de cohorte taux d’incidence
•Enquête transversale prévalence
Hypothèseséventuellespour
menerdesétudesobservationnelles
àviséeexplicative
Lacausalitédesassociations
entreEetMmisesenévidencene
peutêtreaffirméeparl’étude
Apportelapreuvedelanature
causaled’uneassociation
significativeentreEetlecritèrede
jugementprincipalM
Niveaudepreuveplusfaible
Causaliténondémontrée

3
UNITES D’ANALYSE
Recueildeparamètrescaractérisantdesgroupesd’individus(ex:pays,régions,…)
‐ Tauxdemortalitécardio‐vasculairedechaquepays
‐ Tauxd’incidencedecancerduseindechaquepays
‐ Consommationmoyennedecigarettesparhabitantsdechaquepays
‐ Prévalencedemalformationcongénitaledechaquepays
Recueildedonnéerecueilliesauniveaudechaqueindividud’unéchantillon
‐ Statutvitalindividuel
‐ Survenueounondelamaladie(éventuellementdatedesurvenue,etc…)
‐ Consommationdecigarettes(nombreparjour,durée,âgeaudébut,etc…)
‐ Existenceounond’unemalformationcongénitale
U
nité de recueil = groupe d’individu (PAYS par ex) Données collectives
Unité de recueil = individu (personnes par ex) Données individuelles
3
Utilisationdedonnéesgroupéesissusdessystèmesd’enregistrementcontinue
Sourcesdedonnéesdesanté:donnéesd’enregistrementcontinue
•SURVEILLANCEEPIDEMIOLOGIQUEetSTATISTIQUESVITALES
Utilisationdesdonnéesgroupées
•Estimationdetauxd’incidence(approximation)
•Etudedesvariationsgéographiqueoutemporelles
•Etudedecorrélationécologiquepasdeconclusioncausale
Evolution des systèmes de surveillance de la grippe dans le monde The number of viruses from which sequence data have been
uploaded to the GISAID platform between 1967 and 2016
https://www.who.int/
3
Unité de recueil de M et
d’autres indicateurs =
groupe d’individu (PAYS par
ex) Données collectives

4
Utilisationdedonnéesindividuellesissues d’enquêtesobservationnellessuréchantillon
Sourcesdedonnéesindividuelles:enquêtesobservationnelles
‐ ENQUETEDECOHORTES
‐ ENQUETESCAS‐TEMOINS
‐ ENQUETESTRANSVERSALES
Utilisationdesdonnéesindividuelles
•EstimationdemesuresdefréquencedeMcaractérisantlapopulationdontestissul’échantillon
•ComparaisondesmesuresdefréquencedeMentreplusieursgroupesdel’échantillonpour
identifierdesfacteursassociésaurisquedesurvenuedeM
Les enquêtes sur échantillon d’individus permettent :
de recueillir des informations individuelles sur la maladie et les expositions :
de sélectionner une population cible et des indicateurs adaptés aux objectifs
d’intégrer la dimension chronologique des événements
d’étudier des associations au niveau individuel
de prendre en compte des facteurs de confusion
3
Unité de recueil de M +/- E = individu
M=phénomèneétudié
•Critèredejugement/Outcome (enanglais)
• Notation:M(=maladie)/D(=disease)
E=Facteur(exposition)susceptible
d’influencerlerisquedesurvenueoude
modificationdeM
•Facteursétiologiques,causesdemaladie
•Facteurspronostiques
•Facteurssocio‐démographique
•Déterminantsdecomportements
•stratégiethérapeutique,stratégiedepriseencharge
‐ Décès
‐ Décèspourunecausespécifique
‐ Etatdesanté:
‐ Maladies
‐ Signes/anomaliecliniqueoubiologique
‐ Paramètresbiologiquesougénétique
‐ Comportementsenrelationaveclasantéou
l’accèsauxsoins
‐ Stratégiemédicale
‐ Stratégiedeprévention
‐ Etatdesanté:
‐ Maladies
‐ Signes/anomaliecliniqueoubiologique
‐ Paramètresbiologiquesougénétique
‐ Comportementsenrelationaveclasantéou
l’accèsauxsoins
‐ Stratégiemédicale
‐ Stratégiedeprévention

5
Définitiondesvariablesd’intérêt
•Critère(s)dejugementM:principal/secondaires
•Expositionsouintervention(E)
•Méthode(s)diagnostique(s)T àévaluer
Définitiondelapopulationcible(critèresd’éligibilitésX)
=populationàlaquelleonsouhaiteappliquerlesrésultats
Objectifsàvisée
•Descriptive
•Explicativeenapprocheobservationnelle
•Evaluativedel’effetd’uneinterventionexpérimentale
•Evaluativedesperformancesd’uneméthodedeclassement
Approche:Observationnelleouexpérimentale/interventionnelle
Unitéd’analyse:Individuougroupe(donnéesagrégées)
Définitionopérationnelledesobjectifs
Etudes descriptives
= observationnelle Etudes analytiques à visée explicative
= observationnelle sur données individuelles
Études expérimentales
‐ Rechercherun(des)FACTEUR(s)deRISQUEdeM
=expositionsE(nonattribuéespourl’étude) associées
statistiquementaurisquedeM, recueillispourchaqueindividu
‐ Estimationpourunepopulationcible
‐ Descriptiondesévolutionsdansletempset
comparaisonentreplusieurszonesgéographiques
‐ Corrélationsécologiquesentreplusieurs
indicateurscollectésauniveaudesmêmesunités
groupées
générerdeshypothèses
‐ Evaluerl’effet(positifounégatif)surunparamètreMd’uneinterventionE
réaliséepourl’étude(=situationexpérimentale)
Objectifs
Recherche d’associations au niveau d’individus
(comparaison)
« Fréquence » ou « niveau »
d’indicateurs M en lien avec la santé
L’étude est dite « descriptive » même si on
effectue des comparaisons ou recherche des
corrélations entre indicateurs qui
caractérisent des groupes de sujets
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%