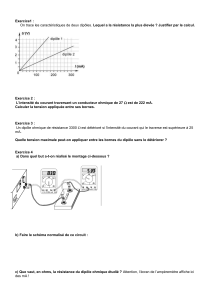
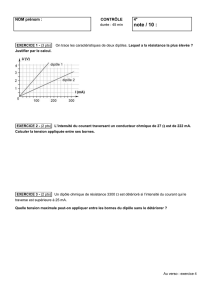
Bensad salaheddine Page 2
SOMMAIRE
Electricité
Courant électrique
Tension électrique..
Conducteurs ohmiques
Caractéristiques de quelques dipôles passifs
Caractéristiques de quelques dipôles actifs
Chimie
La quantité de matière
La concentration molaire
Transformations chimiques et Avancement d'une réaction
chimique

Bensad salaheddine Page 3
Le courant électrique continu
I. Phénomène d’électrisation
I. Expériences
Experience 1
Le bâton d’ébonite frotté devient capable d’attirer la boule légère : on dit qu’il est électrisé
ou chargé d’électricité
Le frottement est la cause de l’électrisation.
2. Deux espèces d électricité
2-1. Expérience
on électrise un baton en ébonite par frottement contre une peau de chat
on électrise un baton en verre par frottement contre un morceau de soie
2-2. Conclusion
On distingue deux types des charges électriques : des charges positives et des charges
négatives
Par convention, l’électricité qui apparaît sur le bâton de verre est notée positivement (+) et
celle qui apparaît sur le bâton d ébonite est notée négativement (-).
Deux corps chargés d électricité de même signe se repoussent;
Deux corps chargés d électricité de signes contraires s attirent
II. courant électrique
1. Nature du courant électrique
1-1. Nature du courant électrique dans les conducteurs métalliques
Dans les métaux les électrons libres se déplaçant. Ils circulent de la borne moins vers la
borne plus à l'extérieur du générateur.
Ce mouvement d’électrons constitue le courant électrique.
1-2. Nature du courant dans les solutions électriques
a. Experience

Bensad salaheddine Page 4
On réalise l’expérience suivante
b. Observation
Les ions cuivre Cu2+, de couleur bleue, se sont déplacés dans le sens du courant, vers la
borne – du générateur.
Les ions permanganate MnO4-, de couleur violette, se sont déplacés dans le sens opposé à
celui du courant, vers la borne +
c. Conclusion
Dans un électrolyte il n’y a pas d’électrons libres. La circulation du courant électrique est
expliquée par un double déplacement des ions.
Les ions positifs se déplacent vers l’électrode reliée à la borne négative de la pile appelée
cathode
les ions négatifs vers l’électrode reliée à la borne positive de la pile ou anode
Remarque
Un conducteur est un corps dans lequel les charges électriques peuvent se déplacer
(exemple: les métaux).
Un isolant est un corps dans lequel les charges électriques ne peuvent pas circuler
(exemple: verre, matière plastique).
2. Définition du courant électrique
Le courant électrique est un mouvement de porteur de charges. Dans les métaux les porteurs
mobiles sont les électrons, dans les solutions électrolytes, les porteurs mobiles sont des ions
(positifs et négatifs).
3. Intensité du courant électrique
3-1. quantité d’électricité
La quantité d’électricité Q (grandeur positive) est la valeur absolue de charges électriques déplacées
par les porteurs mobiles des charges.
Q : quantité d’électricité s’exprime en coulombs (C)
n : Le nombre de porteurs de charge
: Le nombre de charge élémentaire pour chaque porteur de charge
e : La charge élémentaire e =1,6.10−19C =
Remarque.
La charge élémentaire est La quantité d’électricité élémentaire
3-2. Intensité du courant électrique
l'intensité du courant est la quantité d'électricité (La charge) qui traverse la section du
conducteur par unité de temps
L’intensité du courant est la charge transportée par seconde à travers une section d’un
conducteur.

Bensad salaheddine Page 5
a. Formule pour calculer l’intensité du courant
L’intensité est égale à la quantité d’électricité qui circule pendant l’unité de temps :
I=
b. Sens conventionnel du courant électrique
Par convention le courant électrique circule de la borne positive à la borne négative à l’extérieur
du générateur. Il est représenté par une flèche
3-3. Mesure de l intensité du courant
Pour mesurer l’intensité du courant électrique, on utilise un ampèremètre
Symbole normalisé d’un ampèremètre
On distingue deux types d ampèremètres:
les ampèremètres à aiguille
les ampèremètres à affichage numérique ou multimètre
Pour mesurer l’intensité du courant qui circule dans une branche de circuit électrique on
branche l’ampèremètre en série avec l’appareil électrique. Le courant doit pénétrer l’ampèremètre
par sa borne positive. (A)
Pour éviter d’Endommager l’ampèremètre. on commence donc par le calibre le plus grand.
On baisse le calibre, si possible, pour obtenir un affichage suffisamment précis.
plus la valeur mesurée est proche de la valeur du calibre utilisé, plus la mesure est précise.
Remarque
Le calibre C correspond la valeur maximale de l’intensité de courant mesuré par l’ampèremètre
a. Mesure par ampèremètre analogique ou à aiguille
L’intensité du courant mesurée par l’ampèremètre est
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
1
/
50
100%