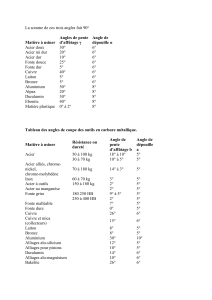
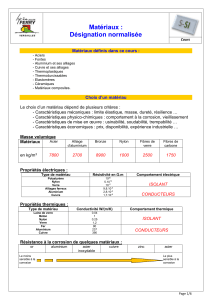
Matériaux Métalliques : Élaboration et Désignation Normalisée
Telechargé par
yadis2040

1 | P a g e I S E T K é b i l i D é p a r t e m e n t G é n i e M é c a n i q u e
Chap.1 Elaboration et désignation normalisée des matériaux
métalliques
I. Introduction :
En chimie, les métaux sont des matériaux dont les atomes sont unis par des liaisons métalliques. Il
s’agit de corps simples ou d’alliages le plus souvent durs, opaques, brillants, bons conducteurs de
chaleur et d’électricité, ils sont généralement malléables, c’est-à-dire qu’ils peuvent être martelés
ou pressés pour leur faire changer de forme sans les fissurer ni les briser. Les métaux possèdent
de nombreuses applications courantes, et leur consommation s’est fortement accrue depuis les
années 80.
II. Liaison métallique et structures cristallines des métaux :
1. Structure des métaux :
On peut se représenter un métal comme un réseau tridimensionnel des cations métalliques
baignant dans un fluide d’électrons délocalisés très mobiles (fig.1). Ces cations sont liés entre eux
par des liaisons métalliques.
Une liaison métallique se caractérise par la mise en commun des électrons de valence qui ne sont
plus localisés entre les atomes (liaison covalente) ou sur un ion (liaison ionique), mais qui sont
répartis dans l’ensemble du réseau d’ions.
La nature électronique particulière d’une liaison métallique est responsable de plusieurs
propriétés macroscopiques des métaux.
Le champ d’électrons libres est responsable de plusieurs propriétés :
Il assure une conductivité électrique et une conductivité thermique élevées ;
Il rend compte de la ductilité, de la malléabilité et de la plasticité des métaux ;
Il confère aux métaux leur éclat par son interaction avec les ondes électromagnétiques ;
Il est responsable de la température de fusion et d’ébullition élevées ;
A l’état solide, les métaux se présentent sous forme d’un assemblage de grains microscopiques
dont chacun constitue un cristal (la disposition des atomes à l’intérieur du cristal).
Les trois structures cristallines les plus fréquentes dans les métaux sont la structure cubique
centrée (c.c), suivie de la structure hexagonale compacte (h.c) et de la structure cubique à faces
centrées (c.f.c). (fig.2)
Fig.1 liaison métallique de
sodium, les ions positifs
baignent dans un nuage
d’électrons délocalisés.

2 | P a g e I S E T K é b i l i D é p a r t e m e n t G é n i e M é c a n i q u e
Fig.2 : structures cristallines les plus courantes des métaux : a) C.F.C, b) C.C, c) H.C
Dans une structure cubique centrée, chaque atome est situé au centre d’un cube formé par ses
huit atomes voisins. Parmi les métaux cristallisant dans le CC : le fer α, le Chrome, Molybdène,
Tungstène et Vanadium.
Le cube élémentaire d’une structure CFC possède un atome à chaque sommet et un atome au
centre de chacune de ses 6 faces. Parmi les métaux cristallisant dans le CFC : Le fer γ, Nickel, Cuivre,
Aluminium, Or.
Dans une structure H.C , les atomes occupent les sommets et le centre des 3 prismes triangulaires
composants un prisme hexagonal de hauteur varie de 1.6 à 1.9 fois le côté représentant la maille
élémentaire. Parmi les métaux cristallisant dans le HC : Manganèse, Zinc, Cadmium et le titane.
2. Eléments chimiques métalliques :
Dans le tableau périodique des éléments, les métaux occupent la gauche, le centre et une partie
de la droite du tableau, séparés des non métaux par les métalloïdes. Parmi les 110 éléments, on
dénombre 86 métaux et 7 métalloïdes.
De point de vue chimique, le caractère métallique est d’autant plus marqué qu’on se déplace vers
la gauche et vers le bas du tableau. Ainsi, les éléments les plus métalliques sont les métaux alcalins,
tandis que les moins métalliques sont les non métaux diatomiques.
De point de vue pratique, il existe une grande variété de termes désignant des familles d’éléments
métallique et d’alliages. On parle des métaux ferreux et non ferreux selon qu’on considère les
alliages contenant ou dépourvus de ferrite. On parle de métaux nobles pour désigner les éléments
métalliques résistants à la corrosion et à l’oxydation : ruthénium, l’argent, le platine, le rhodium,

3 | P a g e I S E T K é b i l i D é p a r t e m e n t G é n i e M é c a n i q u e
l’osmium, l’iridium et l’or. On parle de métaux précieux pour désigner les métaux les plus rares et
dont la valeur marchande est la plus élevée : l’or, l’argent, le platine et le palladium. On parle des
métaux réfractaires pour désigner les métaux particulièrement résistants aux températures
élevées et à l’usure : niobium, le molybdène, le tantale, le tungstène.
Fig3 : tableau périodique
III. Propriétés des métaux :
1. Propriétés physiques :
Parmi les principales propriétés physiques on peut citer :
Conductivité électrique : l’argent est le meilleur conducteur électrique (6,3 107 S/m), suivi par le
cuivre (5,96 107 S/m) et l’aluminium (3,5 107 S/m). La conductivité électrique du fer est de 107 S/m,
tandis que celle de l’acier au carbone est seulement 6,99 106 S/m, ce qui illustre l’effet des
impuretés sur la conductivité électrique.
Masse volumique : bien que la plupart des métaux aient une masse volumique supérieure à celle
de la plupart des non métaux, celle-ci est très variable selon les matériaux considérés. Parmi les
corps simples métalliques le lithium est le moins dense tandis que l’osmium est le plus dense.

4 | P a g e I S E T K é b i l i D é p a r t e m e n t G é n i e M é c a n i q u e
Température de fusion : La température de fusion d'un métal pur est toujours identique (la
même). Les métaux alcalins ont un point de fusion particulièrement bas : ils sont tous liquides à
100 °C.
2. Propriétés mécaniques :
Les métaux sont généralement caractérisés par une bonne malléabilité et une grande ductilité qui
leur permettent de se déformer sans se briser, ainsi le cuivre pur peut être étiré pour former des
fils électriques, des tuyaux, être mis en plaque et martelé en forme de casseroles. L’or pur peut
également être mis sous forme de feuilles très fines. A l’inverse, certains élements d’alliage
permettent de durcir le métal : c’est par exemple le carbone qui durcit le fer pour donner de l’acier,
de l’étain qui durcit le cuivre pour donner le bronze, ou encore de l’argent et du cuivre durcissent
l’or.
3. Propriétés magnétiques :
Quelques métaux présentent des propriétés magnétiques remarquables comme le
ferromagnétisme. Ce sont notamment, le fer, le cobalt et le nickel.
4. Propriétés chimiques :
La Résistance à la corrosion sous l'action de l'Oxygène :
Fer : s’oxyde rapidement
Aluminium ; Zinc ; Etain : oxydation superficielle
Nickel ; Chrome ; Or : aucune oxydation
IV. Les alliages :
Un alliage est un mélange de deux élements chimiques ou plus dont le principal élément constituant
est un métal. La plupart des métaux purs sont trop mous, trop fragiles ou trop réactifs pour pouvoir
être utilisés tels quels. Il est possible de moduler les propriétés des alliages en faisant varier les
proportions relatives de leurs différents constituants. Il s’agit généralement de les rendre moins
fragiles, plus durs, plus résistants à la corrosion, ou encore de leur donner une couleur et un éclat
plus attirants.
De tous les alliages métalliques utilisé de nos jours, ceux de fer (acier, acier allié, acier à outils, acier
au carbone, acier inoxydable, fonte) en représentent l’essentiel de la production. Le fer allié au
carbone donne des aciers de moins en moins ductiles et résistants à mesure que le taux de carbone
augmente. L’addition de chrome, de nickel et de molybdène à des aciers au carbone (à plus 10 %)
donne de l’acier inoxydable.

5 | P a g e I S E T K é b i l i D é p a r t e m e n t G é n i e M é c a n i q u e
Outre les alliages de fer, ceux de cuivre, d’aluminium, de titane et de magnésium sont également
important de point de vue économique. Les alliages de cuivre sont connus sous forme de bronze
depuis l’âge de bronze. De nos jours le bronze désigne un alliage de cuivre et d’étain, tandis que le
laiton est un alliage de cuivre et de zinc, et que le maillechort est un alliage de cuivre, de zinc et de
nickel. Les alliages d’aluminium, de titane et de magnésium ont été développés plus récemment, et
ils sont intéressants en raison de leur grande résistance mécanique pour une masse volumique
plutôt faible ; leur cout de revient est cependant élevé, ce qui restreint leur utilisation aux
applications de haute technologie pour lesquelles les performances sont plus importantes que le
coût. Parmi les différents alliages d’aluminium, on peut citer ceux de corroyage (transformés par
des techniques de forge : laminage, filage). Le Zamak est formé de zinc allié à l’aluminium, le
magnésium et le cuivre.
Outre les propriétés mécaniques remarquables, les alliages permettent également de faciliter la
fusion des métaux, notamment les eutectiques. C’est par exemple le cas de l’alliage étain plomb
Sn63Pb37 qui fond à 183 °C à comparer aux points de fusion respectifs de l’étain et de plomb, qui
sont de 232 °C et
V. Etats métallurgiques :
Corroyage : opération consistant à déformer plastiquement un métal afin d’obtenir une forme
désirée. Le forgeage, le laminage et le filage sont des exemples de corroyage. Le corroyage peut
être réalisé à chaud ou à froid. Le métal subit généralement un écrouissage plus ou moins accentué
(le métal est dit écroui)
Durcissement structural : durcissement du métal provoqué soit par un phénomène de trempe
uniquement (aciers) soit par une trempe suivie d’une maturation (alliages d’aluminium) soit encore
par un traitement mécanique (écrouissage…). Au cours du durcissement, la résistance à la rupture
Rr, la limite élastique Re, la dureté augmentent et l’allongement pour cent A%(la malléabilité)
diminue.
Ecrouissage : modification de la structure d’un métal par déformation plastique à une température
et à une vitesse telles que le métal durcisse. Amène une augmentation de la résistance mécanique
et de la dureté mais aussi une perte de la ductilité (A% diminue).
Maturation : Pour certains alliages, on effectue une trempe, mais pas de revenu. Dans ce cas, il y a
« maturation » (exemple : 5 jours à 20°C pour les Alliages d’aluminium), c'est-à-dire que l'on
considère que l'alliage atteint ses caractéristiques mécaniques seulement après cette période.
Tout essai de dureté ou de résistance mécanique avant ces 5 jours n'est pas significatif.
Recuit : dans le cas des métaux non ferreux, traitement thermique destiné à adoucir le métal en
éliminant l’écrouissage (relaxation des contraintes). Par exemple, le laminage à froid d'un matériau
provoque son écrouissage ce qui se traduit par une perte de ductilité et un durcissement. Un recuit
est alors nécessaire pour lui redonner les propriétés mécaniques sensiblement identiques à celles
qu'il avait avant déformation.
Revenu : traitement thermique qui permet d'adoucir les effets de la trempe en produisant
la martensite dite revenue sans trop altérer les effets fondamentaux de la trempe.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%