Telechargé par
Saliha Bend
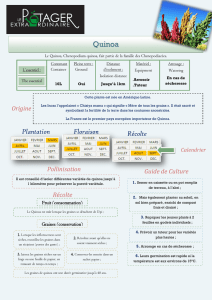
Stress salin et germination du Quinoa : Étude Agrobiotechnologique
publicité

الجمهورية الجزائرية الديمقراطية الشعبية Ministère de l'Enseignement Supérieur et de la Recherche Scientifique Université Ibn Khaldoun -Tiaret Faculté des Sciences de la Nature et de la Vie Département des Sciences de la Nature et de la Vie Mémoire en vue de l’obtention du diplôme de Master académique Domaine: Sciences de la Nature et de la Vie Filière : Sciences Agronomiques Spécialité: Agrobiotechnologie THÈME Étude des effets du stress salin sur la germination du Quinoa (Chenopodium Quinoa). Présenté et soutenu publiquement le : 15-06-2016 par : - BOUSSOUAR Fatna - DZIRI Khadra JURY: Président : M. TAIBI K MCB Faculté SNV Tiaret Promoteur : M. BOUFARES K MAA Faculté SNV Tiaret Examinateur : M. BOUSSAADA D MAA Faculté SNV Tiaret Année universitaire: 2015 - 2016 Remerciements Nous remercions en premier lieu Dieu le tout puissant de nous avoir accordé la puissance et la volonté pour terminer ce travail. Nous exprimons nos sincères et chaleureux remerciements et notre profonde gratitude à M. BOUFARES K. pour nous avoir encadré qui nous a suivi tout le long de ce travail, et dont les nombreux et fructueux conseils nous ont permis de mener à bien ce travail. Merci pour sa lecture attentive, les conseils et les encouragements prodigués lors de la rédaction de ce manuscrit dont il est rapporteur. Nous remercions vivement les membres du jury Monsieur TAIBI K d’avoir, accepté de présider le jury de ce travail et Monsieur BOUSSAADA A, qui nous a fait l’honneur de s’intéresser à notre étude et de juger ce travail, qu’il soit vivement remercié. Nous tenons à remercier Monsieur HASSANI A, Monsieur KHAN qui nous ont facilité la tâche pour réaliser ce travail. Également, nous tenons à remercier les enseignants, les responsables, nos amis, les bibliothécaires de la faculté des Sciences de la Nature et de la Vie. Dédicace Je dédie ce modeste travail à mon très cher Père, aucune dédicace ne saurait exprimer l’amour, l’estime, le dévouement et le respect que j’ai toujours pour vous., À la plus belle créature que Dieu a créée sur terre, À cet source de tendresse, de patience et de générosité,,, À ma mère ! À mes frères, ma sœur À tous mes amis et collègues À tous les étudiants de la promotion 2015/2016 En reconnaissance de leurs aides, gentillesse et leur agréable compagnie. Khadra Dédicace Je dédie ce modeste travail à mon père, qui peut être fier et trouver ici le résultat de longues années de sacrifices et de privations pour m'aider à avancer dans la vie., À ma mère ma source de tendresse et de courage À mes frères, mes sœurs A tous ceux qui, par un mot, m’ont donné la force de continuer … Fatna Table des matières Liste des figures et planches........................................................................................................i Liste des tableaux........................................................................................................................ii Liste des abréviations................................................................................................................iii Introduction ................................................................................................................................ 1 CHAPITRE I: Généralités sur le Quinoa ................................................................................... 3 I. La plante « Quinoa ».............................................................................................................. 3 1. Biogéographique de la plante ............................................................................................. 3 1.1. Origine et répartition géographique ............................................................................. 3 1.2. Systématiques de la Chenopoduim Quinoa ................................................................. 4 2. Écologie de Chenopoduim Quinoa ................................................................................... 15 2.1. Conditions climatiques .............................................................................................. 16 3. Intérêt Agro-économique.................................................................................................. 18 3.1. Propriété..................................................................................................................... 18 3.2. Propriété médicinale .................................................................................................. 18 3.3. Usage ......................................................................................................................... 19 4. Maladies et ravageurs ....................................................................................................... 20 4.1. Contrôle des mauvaises herbes .................................................................................. 20 4.2. Maladies..................................................................................................................... 21 4.3. Insectes et ravageurs .................................................................................................. 22 CHAPITRE II: Stress abiotiques .............................................................................................. 23 I. La salinité .............................................................................................................................. 23 1. Genèse des sols sodiques ou halomorphes ....................................................................... 23 2. Origines et causes de la salinité ........................................................................................ 24 2.1. Origine primaire ........................................................................................................ 24 2.2. Origine secondaire ..................................................................................................... 24 3. Principaux sels responsables de la salinité ....................................................................... 25 4. Classification et caractérisation des sols sales .................................................................. 25 5. Caractéristiques des eaux salées ....................................................................................... 27 II. Stress abiotiques................................................................................................................... 29 1. Définition d‟un stress........................................................................................................ 29 2. Types de stress .................................................................................................................. 29 2.1. Stress hydrique .......................................................................................................... 29 2.2. Stress thermique ........................................................................................................ 29 2.3. Stress ionique ............................................................................................................. 30 2.4. Stress salin ................................................................................................................. 30 3. Conséquences de la salinité sur la plante.......................................................................... 30 3.1. Action des sels sur les propriétés physico- chimiques du sol .................................... 31 3.1. Action sur l‟absorption .............................................................................................. 31 3.3. Action de la CE sur les plantes .................................................................................. 31 3.4. Effet sur la germination ............................................................................................. 32 3.5. Effet sur les composantes du rendement ................................................................... 32 3.6. Action du sel sur la croissance et le développement ................................................. 32 3.7. Effet de la salinité sur la photosynthèse .................................................................... 33 3.8.Effets toxiques de NaCl sur la plante ......................................................................... 34 4. Mécanismes de résistance à la salinité ............................................................................. 34 4.1. L‟exclusion ................................................................................................................ 35 4.2. Inclusion et compartimentation des ions ................................................................... 35 4.3. Ajustement osmotique ............................................................................................... 36 5. Mécanismes d‟adaptation biochimique à la salinité ......................................................... 37 5.1. Accumulation des sucres solubles sous stress ........................................................... 37 III. La germination.................................................................................................................... 38 1. Définition de la germination ............................................................................................. 38 2. Notion de graine ............................................................................................................... 38 3. Dormance des graines....................................................................................................... 38 4. Phases de germination ...................................................................................................... 38 5. Importance adaptative des graines .................................................................................... 39 CHAPITRE III : Matériel et méthodes ..................................................................................... 40 1. Protocole expérimental ..................................................................................................... 40 1.1. Le dispositif expérimental ......................................................................................... 40 2. Matériel végétal ................................................................................................................ 41 3. Préparation de la culture ................................................................................................... 41 3.1. Germination des graines ............................................................................................ 41 3.2. Préparation des alvéoles et rempotage....................................................................... 43 3.3. Paramètres étudiés ..................................................................................................... 43 4. Analyse statistique ............................................................................................................ 48 CHAPITRE IV : Résultats et discussion .................................................................................. 49 I. Résultats et discussion ........................................................................................................... 49 1. Effets de la salinité sur les paramètres physiologiques .................................................... 49 1.1. Paramètres d‟évolution du taux d‟imbibition ............................................................ 49 1.2. Taux final de germination.......................................................................................... 51 1.3. Précocité de germination ........................................................................................... 52 1.4. Vitesse de germination .............................................................................................. 53 2. Effets de la salinité sur les paramètres morphologiques................................................... 55 2.1. Longueur moyenne de la radicule ............................................................................. 55 3. Effets de la salinité sur les paramètres biochimiques ....................................................... 56 3.1. Effet de la salinité sur la teneur en chlorophylles ...................................................... 56 3.2. Effet de salinité sur la teneur en sucres solubles ....................................................... 59 II. Discussion ............................................................................................................................ 61 Conclusion ................................................................................................................................ 63 Références bibliographiques..................................................................................................... 66 Liste des annexes ...................................................................................................................... 70 Liste des figures et planches Figure 1 : Distribution géographique de la culture traditionnelle de Quinoa en Amérique du Sud. ............................................................................................................................................. 3 Figure 2 : Zone de production du Quinoa d‟exportation au sud de la Bolivie. .......................... 4 Figure 3 : Caractéristiques morphologiques du Quinoa (source Wikipedia., 2016) .................. 5 Figure 4 : Caractéristiques de la racine ...................................................................................... 5 Figure 5 : Caractéristiques de la tige. ......................................................................................... 6 Figure 6 : Différents types de ramification de la tige. ................................................................ 7 Figure 7 : Caractéristiques de la feuille. ..................................................................................... 8 Figure 8 : Caractéristiques de l'inflorescence. ............................................................................ 9 Figure 9 : Structure interne de la graine du Quinoa. ................................................................ 10 Figure 10 : Morphologie externe et formes des graines du Quinoa. ........................................ 10 Figure 11 : Quinoa en champ paysan montrant une grande diversité de couleurs et de formes des panicules. ............................................................................................................................ 13 Figure 12 : Différentes variétés de Quinoa. ............................................................................. 14 Figure 13 : Évolution des phases de croissance du Quinoa. .................................................... 18 Figure 14 : Produit alimentaire du Quinoa ............................................................................... 20 Figure 15: plante Quinoa gravement touchée par le mildiou ................................................... 21 Figure 16: taches typiques causées par Peronospora qui varient en fonction de la couleur de la plante Quinoa ........................................................................................................................... 21 Figure 17: Effets toxiques du NaCl sur la plante (Jabnoune, 2008) ......................................... 34 Figure 18: Courbe théorique d‟imbibition d‟une semence selon Côme (1982). ...................... 39 Figure 19 : Protocole expérimental. ......................................................................................... 40 Figure 20: Disposition des graines du Quinoa dans la boite de Pétri. ...................................... 41 Figure 21 : Répartition des boites de Pétri dans l‟étuve. .......................................................... 42 Figure 22 : Germination des premières graines. ....................................................................... 42 Figure 23: Transplantation des plantules vers des plaques alvéolées. ...................................... 43 Figure 24 : Courbe étalon du dosage des sucres solubles......................................................... 48 Figure 25: Évolution moyenne du taux d‟imbibition de la variété Chucara en fonction du traitement appliqué. .................................................................................................................. 49 Figure 26 : Évolution moyenne du taux d‟imbibition de la variété Sajama en fonction du traitement appliqué. .................................................................................................................. 50 i Figure 27 : Évolution moyenne du taux d‟imbibition de la variété Sandoval en fonction du traitement appliqué. .................................................................................................................. 50 Figure 28 : Évolution du taux de germination en fonction des différents traitements de NaCl. .................................................................................................................................................. 51 Figure 29: Précocité de la germination des graines après le 2e jour de semis ......................... 52 Figure 30 : Coefficient de vélocité (CV) et temps moyen (TMG) de germination pour la variété Chucara. ........................................................................................................................ 53 Figure 31 : Coefficient de vélocité (CV) et temps moyen (TMG) de germination pour la variété Sajama........................................................................................................................... 54 Figure 32 : Coefficient de vélocité (CV) et temps moyen (TMG) de germination pour la variété Sandoval. ...................................................................................................................... 54 Figure 33 : Variation de la longueur de la radicule de différentes variétés en fonction de la concentration en sel. ................................................................................................................. 55 Figure 34 : Variation de la teneur en pigment chlorophyllien (a). ........................................... 57 Figure 35 : Variation de la teneur en pigment chlorophyllien (b). ........................................... 57 Figure 36 : Variation de la teneur en pigments chlorophylliens (a+b). .................................... 58 Figure 37 : Variation de la teneur en sucres solubles au niveau de la feuille en fonction des variétés et du traitement salin. .................................................................................................. 59 ii Liste des tableaux Tableau 1: Les importateurs UE de Quinoa du Pérou, Adex (2010). ...................................... 15 Tableau 2: Production mondiale du Quinoa. ............................................................................ 15 Tableau 3:Teneurs en macronutriments du Quinoa et d'autres aliments (pour 100 gramme de poids sec). ................................................................................................................................. 20 Tableau 4: Caractéristiques principales des sols salins et sodiques (Maillard, 2001). ............. 26 Tableau 5: Classe de la salinité des sols (Maillard, 2001)........................................................ 27 Tableau 6: Classification de l'eau selon Maillard, 2001. .......................................................... 28 Tableau 7: Relation entre la C.E., la pression osmotique et la croissance des plantes. ............ 32 Tableau 8: Quantité de sels utilisés lors de la préparation des solutions salines. ..................... 41 Tableau 9: Les variétés étudié et leurs origines ........................................................................ 41 Tableau 10: Analyse de la variance du taux de germination des trois variétés sous différents stress salins. .............................................................................................................................. 52 Tableau 11: Analyse de la variance de la précocité de germination des trois variétés sous différents stress salins ............................................................................................................... 53 Tableau 12: Analyse de la variance de la longueur des racines des trois variétés sous différents traitements salin. ....................................................................................................................... 56 Tableau 13 : Analyse de la variance des pigments chlorophylliens des trois variétés sous différents traitements salins. ..................................................................................................... 58 Tableau 14 : Analyse de la variance de la teneur en sucres solubles des trois variétés sous différents stress salins. .............................................................................................................. 60 i Liste des abréviations Abréviation Signification (unités) al Collaborateurs APG Classification Phylogénétique °C Degré Celsius cm Centimètre CEC Capacité d‟échange cationique CE Conductivité électrique Chl. a La teneur de la chlorophylle a Chl. b La teneur de la chlorophylle b Chl. a+b La teneur de la chlorophylle a+b Chl. (a/b): Le rapport de chlorophylle a sur la chlorophylle b CV Coefficient de vélocité dS.m-1 Déci-Siemens par mètre E Exponentiel FAO Organisation des Nations Unies pour l‟Alimentation et l‟Agriculture Ha Hectare LMR Longueur moyenne de la radicule MADR Ministère de l‟Agriculture et du Développement Rural meq Milliéquivalent MF Matière fraiche ml Millilitre min Minute mm Millimètre m.s. Matière sèche μ Micromètre µg/g Microgramme par gramme mmhos/cm Millimhos par centimètre n° Numéro NaCl Chlorure de sodium qx Quintaux pH Potentiel hydrogène P Probabilité P.O Pression osmotique i SAU Surface agricole utile S.m-1 Siemens par mètre TDS Exprime la masse de sel dissoute dans un litre d'eau. C'est donc le nombre de particules pour 1000 ou ppm (parties pour mille) ou simplement mg/L TMG Temps moyen de germination ii Introduction Introduction Introduction La céréaliculture occupe dans l'agriculture algérienne une place dominante, tant par la superficie, trois millions d'hectares emblavés annuellement, représentant 40 % de la superficie agricole utile (SAU), que par l'importance que représentent les produits céréaliers dans le régime alimentaire de l'Algérien, une consommation annuelle moyenne par habitant de 211 kg (MADR 2008). En réponse à cette demande, les programmes d'intensification des céréales n'ont permis d'atteindre que des rendements moyens de 17 qx/ha sur la dernière décennie.(Chehat 2016). Cette faiblesse de la productivité des céréales est largement, expliquée par le fait qu'elle est soumise aux conditions climatiques prévalentes, une agriculture pluviale. Dans les régions à vocation céréalière en Algérie, surtout les hauts plateaux caractérisés par un climat semi-aride, la pénurie et la variabilité de la pluie et la forte évaporation affectent l‟eau et l‟équilibre des sels dans le sol entraînant la salinisation de ces sols. Cette situation a rendu la production des céréales très aléatoire d'une année à une autre et qui ne permet pas de satisfaire la demande croissante de la population, une situation qui fait qu'on soit un pays dépendant, en permanence, des conditions des marchés mondiaux et surtout des fluctuations que connaissent les productions des pays exportateurs de céréales. Ce handicap au développement de la céréaliculture, que représente le stress salin, appelle le recours à de nouvelles espèces céréalières telles que le Quinoa ; dont l'intérêt de pour l'Algérie réside dans sa capacité de résistance face à des conditions climatiques extrêmes (sécheresse, pauvreté des sols, salinité) ; elle pourrait être, de ce fait, utilisée dans la lutte contre la désertification d'autant plus que le Quinoa se développe dans un milieu aride où elle pourrait donner des rendements acceptables à 100 millimètres de pluviométrie (FAO 2013). Aussi, du fait qu'il croit sur des sols salés, le Quinoa pourrait également être cultivé en Algérie où ce genre de sols occupe de grandes étendues, notamment à l'ouest et au sud du pays. La mise en valeur des terres salées pour la céréaliculture ou tout autre système de production est un objectif agronomique national. Il résulte de cette situation que la recherche de nouvelles espèces résistantes au sel présente un intérêt certain. La compréhension des mécanismes physiologiques, biochimiques et morphologiques impliqués dans la tolérance au sel est une étape déterminante pour établir des critères de tri d'espèces et de variétés intéressantes. 1 Introduction La diversification des espèces cultivées s‟inscrit aujourd‟hui comme le meilleur moyen pour garantir une autosuffisance alimentaire et de valoriser les terres non exploitées ou insuffisamment exploitées à cause de leur salinité. Mais cette diversification des cultures doit aussi permettre le maintien de la compétitivité de l‟agriculture algérienne dans le cadre d‟une économie de marché mondialisée. Elle doit, en outre, réduire nos importations, cette réduction répond à l‟objectif du gouvernement « rationaliser nos importations d‟ici 2019 » C‟est dans cette optique, que nous avons jugé intéressant d‟étudier cette nouvelle espèce pour l‟Algérie, pour tirer un meilleur parti de ses potentialités de production dans le but de maitriser sa culture et appeler l‟attention de la communauté scientifique sur le rôle que joue le Quinoa, grâce à sa diversité biologique et sa valeur nutritive, dans la sécurité alimentaire, la nutrition et la lutte contre la pauvreté. L'objectif de notre travail est d‟évaluer la réponse de trois variétés de Quinoa à l'effet de stress salin, ainsi que de mettre en évidence les potentialités de sa tolérance Ce travail est structuré en deux parties, la première partie représente des rappels bibliographiques sur le Quinoa, et la salinité. La deuxième partie présente le matériel et les méthodes utilisées, les essais réalisés, ainsi que les résultats obtenus et leurs interprétations. 2 ère 1 Partie Éléments bibliographiques Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa CHAPITRE I: Généralités sur le Quinoa I. La plante « Quinoa » 1. Biogéographique de la plante 1.1. Origine et répartition géographique " Quinoa " est un mot d'origine quechua désignant une plante annuelle à feuilles triangulaires et panicules composées. Selon les traces archéologiques découvertes dans les grottes d'Ayacucho au Pérou, cette Chénopodiacée aurait été domestiquée il y a 6.400 à 7.800 ans (Brack Egg, 2003). Elle est cultivée et consommée depuis des siècles par les populations indigènes de Colombie, Équateur, Pérou, Bolivie et Chili (Gandarillas, 1979) (Fig.1). Figure 1 : Distribution géographique de la culture traditionnelle de Quinoa en Amérique du Sud. (d'apres Geerts S., 2008). Dans les hauts plateaux du sud de la Bolivie, autour du salar d‟Uyuni (fig. 2), le Quinoa (Chenopodium Quinoa Willd.) cultivé traditionnellement dans des communautés paysannes indigènes aymaras et quechuas est devenu, depuis une quarantaine d‟années, un produit agricole pour l‟exportation (Vassas, 2010). 3 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa Figure 2 : Zone de production du Quinoa d‟exportation au sud de la Bolivie. (d'apres Geerts S., 2008). 1.2. Systématiques de la Chenopoduim Quinoa 1.2.1. Présentation de l’espèce Quinoa est issu de l‟espagnol « quinua », lui-même dérivé du quechua « kinwa ». En français, l'usage du masculin s'est imposé, contrairement à l'espagnol et au quechua. Les Incas appelaient le Quinoa « chisiyamama », qui signifie en quechua « mère de tous les grains » (Z. Caceres, 2007) (fig.3). Si le Quinoa est qualifié de "pseudo-céréale", c'est parce que ses qualités nutritives et ses modes de consommation les plus courants le rapprochent de ceux des graminées (qui regroupe l'essentiel des céréales cultivées), plutôt que de sa famille botanique exacte (les chénopodiacées) comprenant aussi la betterave et les épinards (S. Padulosi, 2013). 4 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa Inflorescence : panicule Feuille : lobée Graine Système racinaire : pivotant Figure 3 : Caractéristiques morphologiques du Quinoa (source Wikipedia., 2016) 1.2.2. Description botanique Le Quinoa (C. Quinoa) est une dicotylédone herbacée, autogame, annuelle, de la famille des Chénopodiacées. Dans des conditions optimales de température et d'humidité, les grains germent en une dizaine d'heures environ (Bois et al., 2006) (fig.3) et, au champ, les cotylédons apparaissent généralement vers le 7 e jour après l'émergence. Racine Le système racinaire est pivotant, vigoureux, profond, bien ramifie et fibreux, ce qui lui confère résistance à la sécheresse et bonne stabilité. La croissance racinaire est en rapport étroit avec celle de la partie aérienne, et des plantes exceptionnelles atteignant 1,70 m de hauteur ont développé des racines de 1,50 m (Tapia et al., 1979 ; Izquierdo et al., 2001). Figure 4 : Caractéristiques de la racine 5 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa Tige La tige, cylindrique au niveau du collet et anguleuse plus haut, contient une moelle de texture tendre chez les jeunes plantes, devenant spongieuse et creuse à maturité, avec une écorce ferme et compacte, dont la résistance à la grêle semble dépendre de la variété. La tige à une taille comprise entre 0,5 et 1,5 m selon la variété et les conditions de croissance, les Quinoas des vallées ou des zones fertiles étant plus grandes que celles qui poussent au-delà de 4.000 m ou dans les zones arides et froides (Gandarillas, 1979b ; Caceres, 1993 ; Mujica et al.,1999). La couleur de la tige est caractéristique de la variété : verte, orangée, rouge foncé ou pourpre, uniforme ou tachetée. Le développement de l'architecture de la plante peut être partiellement modifié par la densité de semis de la culture. (Rojas et al, 2013) Figure 5 : Caractéristiques de la tige. 6 Éléments Bibliographiques 1 2 C h a p i t r e I : Généralités sur le Quinoa 3 4 Figure 6 : Différents types de ramification de la tige. 1 Simple, 2 ramifiées au tiers inférieur, 3 ramifié deuxième tiers et 4 ramifie à la base. (Rojas et al, 2013) Feuilles Les feuilles d'une même plante sont nettement polymorphes, celles de la tige principale étant plus longues que celles des ramifications. Les feuilles, alternes, ont un limbe en forme de losange, de triangle ou lancéolé, plat ou onduleux, charnu et tendre (celles de jeunes plantes se consomment comme légume). Le nombre de dents ou de lobes des feuilles serait une caractéristique variétale, les feuilles des Quinoas de Bolivie et du sud du Pérou comptant peu de dents (Tapia et al., 1979). La couleur prédominante de la plante est verte, mais chez les plantes adultes, les couleurs de base sont rouges pourpres et vertes, selon la variété. L'endroit et l'envers des jeunes feuilles ainsi que les tiges et les jeunes inflorescences sont couverts de minuscules vésicules qui sont des excroissances épidermiques de forme sphérique et de couleur blanche, pourpre ou rouge, riches en oxalate de calcium et en pigments divers. 7 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa (Rojas et al, 2013) (a) lancéolé ; (b) losange ; (c) triangle(b, Figure 7 : Caractéristiques de la feuille. c) limbe lobé. fleurs Le Quinoa présente des fleurs hermaphrodites disposées en inflorescences en grappes, considérées comme de faux épis (une panicule). Dans l'étape reproductrice du cycle du Quinoa, l'inflorescence est terminale et de longueur variable. Il en existe deux types principaux : glomériforme et amaranthiforme et, selon Gandarillas (1968), le type glomériforme serait la forme ancestrale ayant donné le second type par mutation. Les fleurs incomplètes (apétales) et très petites (3 mm au maximum) peuvent être hermaphrodites en position apicale, ou pistillaires dans la région inférieure de la panicule, dans des proportions diverses selon la variété (Tapia et al., 1979 ; Izquierdo et al., 2001). En général, le Quinoa est une espèce autogame, avec environ 10 % de pollinisation croisée (Rea, 1969). Cependant, dans quelques variétés, l'allogamie atteint jusqu'à 80 %, ce qui est expliqué par la rareté des fleurs pistillaires (Izquierdo et al., 2001). Les descendants de deux générations d'autofécondation complète ont montré la même vigueur et productivité que leurs parents, c'est pourquoi l'on considère que ce type de reproduction n'affecte pas la culture et permet l'utilisation de techniques basées sur les plantes autogames pour l'amélioration génétique (Tapia et al., 1979 ; Izquierdo et al., 2001). 8 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa A Formes d'inflorescence : A : Glomérulaire B : Intermédiaire C : Amarante B C (Rojas et al, 2013) Figure 8 : Caractéristiques de l'inflorescence. Fruits Le fruit est un akène, de forme cylindrique à lenticulaire, dans lequel l'embryon périphérique entoure le périsperme central (tissus de réserve) et se trouve couvert par le péricarpe et deux assises tégumentaires (Prego et al., 1998). Le péricarpe contient de la saponine en plus ou moins grande quantité et, bien que chez certaines variétés (formes cultivées), il soit séparé facilement, dans d'autres (formes sauvages), il reste difficile à éliminer. La combinaison des couleurs du péricarpe et du tégument de la graine donne la vaste gamme de couleurs que peuvent présenter les panicules. Il existe trois formes de grain : conique, cylindrique et ellipsoïde. Les bords du grain sont d'une grande valeur taxonomique, car ils sont communément marqués chez les formes cultivées, et plus arrondis chez les sauvages (Tapia et al., 1979 ; Izquierdo et al., 2001 ; Bruno, 2006). 9 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa Coupe longitudinale Coupe transversale Figure 9 : Structure interne de la graine du Quinoa. 1 2 3 4 Figure 10 : Morphologie externe et formes des graines du Quinoa. + Les graines de Quinoa n‟ont pas besoin d‟être traitées pour être cultivées, c‟est pourquoi il est presque toujours commercialisé sous le label « agriculture biologique ». 1.2.3.Croissance et développement Selon Tapia et al. (1979), le cycle de croissance du Quinoa peut être différencié en cinq périodes (fig.10) : - du semis à l'émergence, 11-57 jours - de l'émergence à l'apparition de la première paire de feuilles, 5-9 jours - de la première paire de feuilles à l'apparition des panicules, 45-56 jours - des panicules à la floraison, 11-31 jours - de la floraison à la maturation, 60-109 jours. Différents auteurs ont proposé des échelles pour décrire le développement phénologique du Quinoa. Espindola (1986) considère les phases phénologiques suivantes : - émergence. 10 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa - deux feuilles véritables. - quatre feuilles véritables. - six feuilles véritables. - ramification. - début de formation de la panicule. - formation de la panicule. - début de la floraison. - floraison ou anthèse. - grain laiteux. - grain pâteux. - maturité physiologique. 1. Germination 2. Emergence (levée) 3. Stade de deux feuilles 8. Maturité 7. Formation des panicules et floraison 4. Stade de quatre feuilles 6. Ramification 5. Stade de six feuilles Figure 10 : Évolution des phases de croissance du Quinoa (Phénologie). 11 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa D'autre part, Espindola (1992) distingue 9 étapes morpho-anatomiques pour le Quinoa, qui sont : - étape d'émergence. - étape cotylédonaire. - étape des 2 feuilles de base. - étape de 5 feuilles alternes (différenciation paniculaire). - étape de 13 feuilles alternes (pré-émergence paniculaire). - étape d'émergence de la panicule. - étape de floraison. - étape de grain laiteux. - étape de grain pâteux. - étape de grain dur (maturité physiologique). 1.2.4. Génétique et diversité du Quinoa Le genre Chenopodium est divisé en de nombreuses sections, les trois espèces domestiquées appartenant à la section Chenopodium. Les relations entre espèces domestiquées et espèces sauvages sont encore mal connues. Certaines hypothèses font intervenir C. hircinum Schrad. (Du Brésil et de l'Argentine) parmi les progéniteurs possibles des Chenopodium cultivés. Quinoa polyploïdie, la polyploïdie est un facteur important à considérer dans la sélection végétale en raison de son influence sur la compatibilité de la reproduction, la fertilité et l'expression de traits phénotypiques et le degré de variabilité. Le nombre de chromosomes dans le Quinoa cultivé (Chenopodium Quinoa Willd) est 2n = 4 × = 36 (Cárdenas et Hawkes, 1948; Gandarillas et Luizaga, 1967; Gandarillas, 1986). Gandarillas (1979) ont rapporté que le Quinoa a 36 chromosomes somatiques avec quatre ensembles de chromosomes X = 9, le numéro de base pour le genre Chenopodium, ce qui signifie que le Quinoa est une allotétraploïde. Des études menées par Simmonds (1971) et Gandarillas (1986) ont montré que les deux génomes diploïdes provenant d'espèces participent à la allotetraploidy de Quinoa pour créer un hybride interspécifique stérile. Le Quinoa a été domestiqué dans les Andes il y a 5.000 à 7.000 ans (Brack Egg, 2003) et soumis à un processus d'amélioration de plusieurs de ses caractéristiques dans une vaste gamme d'environnements, allant des hauts plateaux semi-arides aux vallées tropicales et au littoral du Pacifique. La Quinoa cultivée présente ainsi une grande variabilité génétique qui se traduit par une diversité de couleur des tiges, des inflorescences et des graines, de 12 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa forme et de taille des inflorescences (Figure 11), de teneur en protéines, de contenu en saponine et dans la présence ou non de cristaux d'oxalate de calcium sur les feuilles. Figure 11 : Quinoa en champ paysan montrant une grande diversité de couleurs et de formes des panicules. (Wikipedia 2016) 1.2.5. Taxonomie Nom binominal : Chenopodium Quinoa (Willd., 1798) *Classification de Cronquist (1981) Règne Plantae Sous-embranchement Tracheobionta Division Magnoliophyta Classe Magnoliopsida Sous-classe Caryophyllidae Ordre Caryophyllales Famille Chenopodiaceae Genre Chenopodium *Classification APG III (2009) Ordre Caryophyllales Famille Amaranthaceae Les Chenopodium appartiennent à la famille des Chenopodiaceae. Le genre Chenopodium comprend trois espèces céréalières, qui n'ont pratiquement jamais été cultivées en dehors de leur région d'origine. Ce sont : - le Quinoa, la plus importante des trois espèces, des régions montagneuses andines (Chenopodium Quinoa WILLD) 13 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa - le canihua, également des Andes (Chenopodiumpallidicaule AELLEN) - le huantzontle, du Mexique (ChenopodiumberlandieriMoQ. subsp. nuttaliae (SAFF.) WILSON et REISER). Ce dernier est parfois cultivé pour la graine, mais c'est le plus souvent comme plante légumière qu'il en est fait usage, les infrutescences non mûres fournissant un légume ressemblant au brocoli. Les deux autres espèces, par contre, sont exclusivement céréalières. 1.2.6. Variétés cultivées On distingue principalement deux grandes familles de Quinoa : le quinua "amarga" (=amer) et "dulce" (=doux). La première, traditionnellement cultivée dans les Andes depuis plus de 5 000 ans nécessite le lavage et la scarification des grains à cause de la teneur en saponine de l'enveloppe (amère et présentant un certain taux de toxicité). Il s'agit de la variété majoritairement exportée en occident par le biais du commerce équitable. La "dulce", issue de sélections variétales plus récentes, contient peu ou pas de saponine (Geerts S et al., 2008). Il existe plusieurs variétés comme : Bear, Cherry Vanilla, Cochabamba, dave 407, Gossi, Isluga, Kaslala, Kcoito, Linares, Rainbow, Red faro, Redhead (bonne adaptabilité en climat pluvieux), Temuco (Geerts S et al., 2008). Figure 12 : Différentes variétés de Quinoa. (Wikipedia 2016) 1.2.7. Production dans le monde Le Pérou et la Bolivie sont les deux premiers producteurs mondiaux de Quinoa. En Bolivie, les surfaces ont doublé entre 2005 et 2012, atteignant environ 70 000 hectares pour 44 000 tonnes. L‟association nationale des producteurs de Quinoa (ANAPQUI), créée en 1983, est le principal producteur de Quinoa du pays (Geerts S et al., 2008). 14 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa Le Pérou est le premier exportateur mondial devant la Bolivie et l'Équateur. Plus de la moitié de la production est exportée vers les États-Unis, un peu moins d'un tiers vers l'Union européenne et 6 % vers le Canada (Geerts S et al., 2008). Depuis 2009, la culture du Quinoa a été introduite en France, de l'Anjou jusqu'au Poitou : elle est passée de 100 à 200 hectares entre 2009 et 2010. Tableau 1: Les importateurs UE de Quinoa du Pérou, Adex (2010). Pays Importations (%) Allemagne 55 % Suède 14 % Pays-Bas 13 % Espagne 7.3 % Royaume-Uni 7.2 % France 2.5 % Italie 0.9 % Selon la FAO (2015), la production mondiale de Quinoa est de 111 541 tonnes par an, le Pérou et la Bolivie produisent 92% du Quinoa mondial, avec respectivement 52 129 et 50 489 tonnes par an,et par conséquence ces deux pays sont les premiers producteurs et premiers exportateurs mondiaux. Tableau 2: Production mondiale du Quinoa. Pays Production (tonne) Pourcentage Pérou 52 129 50 % Bolivie 50 489 48,82 Autres pays 8 923 8% Total 111 541 100 % Source : FAO (2015) 2. Écologie de Chenopoduim Quinoa Le Quinoa est une plante de type C3, parfois considérée à tort comme peu efficace dans la fixation du carbone (Tapia et al., 1979). Au contraire, sous des températures modérées à froides comme celles de l'Altiplano bolivien, la photosynthèse de type C3 s'avère plus efficace que celle de type C4, les plantes C4 ne pouvant pas maintenir des niveaux de Rubisco aussi élevés que des plantes C3, ce qui limite leurs capacités photosynthétiques (Cabido et al., 1997 ; Kubien et al., 2004). 15 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa 2.1. Conditions climatiques 2.1.1. Température La culture de Quinoa nécessite une photopériode courte et une température basse pour une bonne croissance. Le Quinoa est cultivé sur des sols marginaux peu fertiles, tolère le déficit hydrique, le gel (-1 à 0°C) et s'adapte bien aux hautes altitudes de 2000 à 3000 mètres. Le Quinoa est par contre très sensible aux fortes températures au stade floraison; celles supérieures à 35°C causent la dormance et la stérilité du pollen. Avant son introduction sur de grandes superficies dans une région, le Quinoa doit être essayé (Belhabib, 2005). La plante supporte jusqu'à -5 °C durant la phase de ramification, selon l'écotype et la durée de la température minimale. Sa résistance ontogénique au froid et à la sécheresse est très variable: il existe des écotypes qui résistent -8°C et survivent pendant 20 jours (température moyenne mensuelle). 2.1.2. Type de sol Le Quinoa pousse bien sur des sols limono-sableux à sablo-limoneux.En Amérique du Sud, le Quinoa est cultivé sur des sols peu ou trop drainés, de faibles fertilités, très acides (pH 4,8) ou alcalins (pH 8,5) (Belhabib, 2005). Si l'humidité du sol diminue trop, la plante arrête sa croissance, la tige devient fibreuse et le système radiculaire se fortifie, permettant à la plante de résister jusqu'à trois mois de sécheresse. Dans ces mêmes conditions, le développement de la plante devient plus asynchrone, une partie de la panicule produisant des grains, tandis que d'autres fleurs continuent à se former ou entrent en anthèse (Mujica et al., 1999). La quantité d'eau requise par la plante dans l'Altiplano central de Bolivie est approximativement de 385 mm pour 5 mois et demi de vie physiologique (Tapia et al., 1979). Cette quantité correspond plus ou moins aux précipitations de la période d'été, ce qui démontre que le Quinoa est adapté au régime moyen des pluies dans cette zone. 2.1.3. Culture de Quinoa Le Quinoa est une culture annuelle que les producteurs sèment entre les mois de septembre et novembre et récoltent de mai à juillet (Belhabib, 2005). La plante pousse jusqu‟à une hauteur moyenne de 1à 1,5m. Les couleurs de la plante sont très variées, du rose au rouge, en passant par le jaune et le noir. La plante nécessite de 90 à 120 jours de culture avant d‟arriver à maturité. Les grains de Quinoa sont généralement beiges ou roses, mais certaines variétés produisent des grains noirs, oranges ou blancs. 16 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa La plante a besoin de journées courtes et de température fraiche pour pousser, d‟où sa culture principalement en altitude. Des températures supérieures à 30° rendent la plante stérile, alors qu‟elle résiste bien au gel léger (pas mois de -5°C). De même, la plante résiste bien à la sécheresse ou à des précipitations faibles (Belhabib, 2005). Le Quinoa est semé, comme toutes les cultures d‟automne, il nécessite un lit de semis bien ameubli et une profondeur inférieure à 5 cm, vu la taille réduite des graines. La culture une fois établie peut tolérer le manque d‟eau. C‟est une culture assez rustique, mais un apport en engrais de fond et de couverture améliore le rendement (Belhabib, 2005). Concernant les interventions au cours de cycle de culture, il s‟agit essentiellement de fertilisation, réalisée au moment du semis le cas échéant. Si le Quinoa suit un cycle de pomme de terre, alors la fertilisation est apportée au moment du semis de la pomme de terre. C‟est une fertilisation principalement organique (fumier), mais également parfois accompagnée de fertilisation chimique (« 1/2 ou 1 sac » d‟urée par hectare). Si le Quinoa suit une jachère, alors aucune fertilisation n‟est apportée. Il peut également y avoir un contrôle des parasites (larves) (Lebonvallet, 2008). L‟irrigation complète du Quinoa n‟est pas une bonne option. Cependant avec un apport d‟irrigation limité, le rendement en graines du Quinoa pourra être stabilisé en 60 à 70 % de son potentiel (Geerts, 2008). La culture du Quinoa tolère le stress hydrique et s‟adapte bien aux régions où la pluviométrie annuelle avec irrigation se situe entre 250 à 400 mm/an (Belhabib, 2005). La récolte commence généralement quand le grain est mûr lorsqu‟il casse sous la dent(Castillo et al., 2008). - Besoin en eau (précipitation) 250 ~ 400 mm/an. - Dose de semis 5 ~ 10 kg/ha. - Profondeur de semis : 2 ~ 5 cm. - Eloignement entre ligne 15 ~ 60 cm. - Rendement : potentiel 110 qx/ha optimum 60 qx/ha Moyen 8.5 ~ 35 qx/ha (selon les conditions de la culture). 17 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa Phénologie : 1. Semis 2. Emergence 3. Deux feuilles véritables 4. Quatre feuilles véritables 5. Six feuilles véritables 1 2 3 4 7~12 45~56 90~100 5 6. Ramification 7. Formation des panicules 8. Floraison 9. Maturité 6 7 8 9 100 130 grain laiteux 130 160 grains pâteux Figure 13 : Évolution des phases de croissance du Quinoa. (rapport FAO 2016) 3. Intérêt Agro-économique 3.1. Propriété Le Quinoa a un potentiel nutritif important. Elle se caractérise par une teneur élevée en protéines : 14 à 21 %, contre 7 à 12 % chez la plupart des céréales (blé, riz, maïs, orge, etc.) (Ayala et al., 2001 ; Bhargava et al., 2006). La teneur en protéine n‟est pas seulement plus haute, mais le Quinoa est aussi une des meilleures sources de protéine parce que les graines contiennent les neuf acides aminés essentiels et peuvent pour cette raison être facilement assimilées par le corps. Beaucoup de minéraux essentiels comme le calcium, le fer, le zinc, le magnésium et le phosphore, des vitamines importantes comme A, C, B1 B, et E se trouvent tous dans cette «graine miracle». Elle est également riche en acides gras non saturés essentiels et contient de l‟acide gras Omega-3 comme on le trouve aussi dans le poisson. Un autre avantage décisif par rapport aux céréales est que ces graines ne contiennent pas de gluten et ont ainsi un potentiel allergique plus faible que le blé et autres céréales (Roscher A, 2013). 3.2. Propriété médicinale Les propriétés curatives de l'échantillon ou de certaines de ses parties (racine, tige, feuille ou grain), type de pathologie soignée, formes de préparation et noms traditionnels. Exemples de quelques maladies : Anémie, Diarrhée, Tuberculose, Rhumatisme, Mal d'altitude, Fatigue, Fracture, Hypocalcémie, Diurétique, Antifébrile,… (FAO, 2013). 18 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa 3.3. Usage Le goût du Quinoa a une personnalité à part entière,que l‟on pourrait décrire comme « typée » ou « corsée».Il peut être accommodé aussi bien en salé qu‟en sucré (Jason A, 2009). Avant d‟utiliser le Quinoa dans la consommation humaine ou animale, les grains sont soit lavés ou polis pour éliminer la saponine du péricarpe. Le polissage est fait à l‟aide de machines de polissage du riz ou de blé. Pour l’alimentation humaine Le Quinoa est un aliment très nutritif, étant cultivé pendant plusieurs milliers d'années en Amérique du Sud, avec une qualité exceptionnelle en protéines et une teneur élevée d'une gamme de vitamines, d‟oligo-éléments, et surtout acides gras insaturés. Le Quinoa contient plus de protéines que n'importe quelle autre céréale. D'autres aspects positifs de Quinoa sont les saponines (une résine amère qui éloigne naturellement les oiseaux) trouvées dans la coque de la graine et l'absence de gluten. Les personnes intolérantes au gluten peuvent donc en consommer et ainsi remplacer le blé, il est toutefois important de noter qu'il est déconseillé aux enfants de moins de deux ans, car il contient de la saponine. On a beaucoup des utilisations comme (fig.14) : - flocons de Quinoa. Ils sont très pratiques à utiliser : il suffit de les réhydrater dans un peu de lait végétal pour qu‟ils soient transformés en galettes végétales bien moelleuses. Tels quels, on peut très bien les incorporer à des crumbles, muffins… - „lait‟ de Quinoa. sa saveur est très typée et ne convient pas pour toutes les préparations. - farine de Quinoa, un concentré de Quinoa très savoureux. Du fait de son absence de gluten, cette farine ne lève pas. On peut néanmoins l‟utiliser en petite quantité dans la pâte à pain, et surtout dans des recettes de gâteaux rustiques ou de fondants, comme le fondant au chocolat, qui nécessite peu de farine - crème de Quinoa, la farine précuite. Attention, il ne s‟agit pas d‟une crème liquide, mais d‟une poudre permettant de lier des sauces ou de réaliser des entremets. - flakes de Quinoa, comme des flakes de maïs. A consommer au petit déjeuner pour changer. -Quinoa soufflé nature ou enrobé de sirop de maïs. C‟est la version « riz soufflé » du Quinoa ! Génial pour parsemer sur les tartes, les crumbles, les compotes ou les yaourts. 19 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa - pâtes au Quinoa et au blé dur. Elles sont délicieuses et permettent de changer des pâtes lambda (Jason A, 2009). Tableau 3:Teneurs en macronutriments du Quinoa et d'autres aliments (pour 100 gramme de poids sec). Quinoa Maïs Riz Blé Energie (Kcal/100g) 399 408 372 392 Protéines (g/100g) 16,5 10,2 7,6 14,3 Lipides (g/100g) 6,3 4,7 2,2 2,3 Glucide totaux (g/100g) 69 81,1 80,4 78,4 Source : FAO d'après Koziol (1992) Figure 14 : Produit alimentaire du Quinoa Pour l’alimentation animale Le Quinoa peut être utilisé comme une plante fourragère, servant à la nourriture et à l'entretien du bétail, Il s'agit des parties végétatives de la plante (feuilles, tiges), ou des sous-produits de battage (résidus, cosses, broussaille), Farine (FAO, 2013). 4. Maladies et ravageurs 4.1. Contrôle des mauvaises herbes Le contrôle des mauvaises herbes n‟est pas sans difficulté puisque le Quinoa pousse très lentement pendant les deux premières semaines et que la majorité des espèces adventice sont des dicotylédones. Les herbicides de réémergence sont les plus préconisés. Le semis tardif favorise la compétition entre espèces. Le semis précoce est par contre un moyen plus efficace pour lutter contre plusieurs espèces puisque la culture de Quinoa est déjà bien établie à leur émergence (Belhabib, 2005). 20 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa 4.2. Maladies Les maladies et ravageurs peuvent apparaître rapidement après introduction du Quinoa dans une région, car celle-ci a des agents pathogènes en commun avec la betterave et les épinards. Plusieurs virus sont transmis par les pucerons. Les maladies comme la sclérotiniose (Sclerotiumrolfsii), le mildiou (Peronosporafarinosa), le phoma (Phomaexigua), les taches foliaires (Ascochytahyalospora), la pourriture gris (Botrytis cinerea) et une bactériose (Pseudomonas sp) causent de sérieux dégâts dans les pays d‟origine d‟Amérique du Sud, en Amérique de Nord et en Grande-Bretagne (Belhabib, 2005), et aussi des nématodes,(Nacobbussp) nématodes du nœud,(Heteroderasp) nématodes à kystes (FAO, 2013). Figure 15: plante Quinoa gravement touchée par le mildiou (rapport FAO 2016) Figure 16: taches typiques causées par Peronospora qui varient en fonction de la couleur de la plante Quinoa (rapport FAO 2016) 21 Éléments Bibliographiques C h a p i t r e I : Généralités sur le Quinoa 4.3. Insectes et ravageurs Plusieurs insectes et ravageurs peuvent attaquer la culture de Quinoa du stade germination jusqu‟à la récolte et le stockage des grains comme les altises et les chenilles. La meilleure méthode de lutte conte les pucerons est d‟irrigation quand la forme aillée apparaît sur les galles des pétioles des feuilles. Les dégâts causés par les oiseaux sont aussi à craindre, mais les variétés riches en saponine sont moins exposées (Belhabib, 2005). 22 Chapitre II Stress abiotiques Éléments Bibliographiques C h a p i t r e II : Stress abiotiques CHAPITRE II: Stress abiotiques I. La salinité La salinité est une caractéristique naturelle des sols, mais la salinisation est particulièrement causée par l‟activité de l‟homme. La salinité est par définition l‟accumulation des sels solubles dans le sol ou sur sa surface. Au-delà d‟une certaine concentration, elle a par conséquent la dégradation des sols réduisant ainsi leurs rendements. La salinité et la sécheresse constituent des contraintes majeures limitant considérablement la production végétale sur 40% de la surface terrestre, notamment en région méditerranéenne (FAO, 1988 in Lemzeri, 2006). Actuellement, 800 millions d‟hectares de terres à travers le monde sont affectés par la salinité ; 397 millions ha sont salins et 434 ha sont salins et sodiques (FAO, 2005 in Diedhiou, 2006). En région méditerranéenne, la salinité constitue une contrainte dans beaucoup de périmètres de grandes cultures où la qualité de l‟eau joue un rôle majeur et où la recherche de plantes adaptées à des seuils élevés de salinité devient un impératif pour la production agricole et ligneuse. L‟Algérie, dont une grande partie des régions agricoles se caractérise par un climat aride et semi-aride, est touchée par le problème de salinité. Selon Szabolcs (1994), un milliard d‟hectares est menacé dans le monde, dont 3,2 millions d‟hectares dans ce pays (Belkhodja et Bidai, 2004). La salinité élevée cause plusieurs types de stress à la plante comprenant l‟altération de l‟absorption des éléments nutritifs, spécialement des ions K et Ca ainsi que l‟accumulation des ions toxiques, particulièrement Na, stress osmotique et oxydatif (Belkheiri, 2009). 1. Genèse des sols sodiques ou halomorphes La genèse des sols halomorphes est conditionnée par la présence de sel. L‟ion sodium exerce une influence sur leur évolution qu‟il se trouve à l‟état de chlorure dans les 23 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques solutions, ou bien à l‟état d‟ion sodium absorbé par le complexe absorbant (Duchaufour, 1968 in Bidai, 2002). 2. Origines et causes de la salinité Bien que l‟altération des roches et les minéraux primaires soit la principale source de tous les sels, les sols salés sont rarement formés par accumulation de sels in situ. Plusieurs causes sont à l‟origine de ce phénomène (Maillard, 2001). 2.1. Origine primaire Près de 80 % des terres salinisées ont une origine naturelle, on qualifie alors la salinisation de «primaire». Dans ce cas, celle-ci est due à la formation des sels pendant l'altération des roches ou à des apports naturels externes : - Dans les régions côtières, intrusion de l‟eau salée ou submersion des terres basses. - Inondation périodique par de l‟eau de mauvaise qualité. - Remontée d‟une nappe phréatique salée près de la zone racinaire (Mermoud, 2006) 2.2. Origine secondaire Près de 20% des terres salinisées ont une origine humaine ou anthropique et sont qualifiées de «secondaires». L'irrigation est la principale cause anthropique de la salinisation des sols (Anonyme, 2006) Dans environ la moitié des situations, le développement de l‟irrigation s‟est accompagné de l‟apparition de processus de salinisation, sodisation ou alcalinisation des sols d‟importance variable. Si les situations apparaissent très diverses en raison des caractéristiques du milieu naturel, des pratiques agricoles ou de la gestion de l‟eau, ces dégradations ne sont pas inéluctables et apparaissent pour l‟essentiel comme la résultante de mode de gestion inappropriée des ressources en sol et en eau. L‟irrigation altère le bilan hydrique du sol en générant un apport d‟eau supplémentaire; cet apport est toujours associé à un apport de sels. En effet, même une eau douce de la meilleure qualité contient des sels dissous et, si la quantité de sels apportée par cette eau peut sembler négligeable, les quantités d‟eau apportées au fil du temps entraînent un dépôt cumulé de sels dans les sols qui peut s‟avérer considérable (Marlet, 2005). 24 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques 3. Principaux sels responsables de la salinité Les sels proviennent de la combinaison des bases (cations) et des acides (anions).Parmi ces sels, ce sont surtout Na Cl, Na2So4, NaHCo3, CaSo4, CaCl2, MgSo4, MgCl2que l‟on rencontre dans les sols salifères. Tous les ions peuvent participer à la salinisation ; en pratique certains sont susceptibles de s‟accumuler et d‟être à l‟origine d‟une salinité excessive des terres. En effet, ce sont le sodium (Na +), le calcium (Ca++), le magnésium (Mg++), ainsi que le chlorure (Cl-), sulfate (SO4-), carbonate (CO3-), et les bicarbonates (HCO3-) (Benkhetou, 2003).(Annexe 6) 4. Classification et caractérisation des sols sales La formation des sols salés est en relation étroite avec la présence de l‟ion sodium Na + sous l‟une ou l‟autre de ses formes: saline (NaCl, Na2SO4) ou échangeable, parfois les deux. Les sols salés sont riches en sels solubles (Sols salins) ou en sodium adsorbé (sols sodiques ou alcalins) : - Les sols salins (Solontchaks) ont pour principales caractéristiques leur richesse en sels de sodium neutres (NaCl chlorure de Sodium, Na2SO4 sulfate de sodium), mais contenant également des quantités appréciables d'ions chlorites et de sulfates de sodium, calcium et magnésium. Ces sols sont généralement dominants dans les régions arides et semi arides. - Les sols alcalins (Solonetz) sont riches en sodium échangeable et en revanche pauvres en sels solubles (sels alcalins, carbonates et bicarbonates de sodium, Na 2CO3 principalement). Les sols alcalins se trouvent plutôt dans les zones semi-arides et subhumides. Ces deux types de sols ont en fait des propriétés chimiques et physiques distinctes, d'où des effets sur les plantes, des traitements pour leur remise en valeur, une distribution géographique et une qualité des aquifères adjacents différents (Maillard, 2001). 25 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques Tableau 4: Caractéristiques principales des sols salins et sodiques (Maillard, 2001). Caractéristiques Sols salins Sols sodiques (alcalins) - Peu de sels solubles neutres, mais Chimiques - Dominés par des sels solubles généralement des quantités neutres : chlorures et sulfates de appréciables de sels capables sodium, calcium et magnésium. d‟hydrolyse alcaline telle que les carbonates de sodium (Na2CO3). Physiques - Le pH de l‟extrait de sol saturé - Le pH de l‟extrait de sol saturé de généralement de moins de 8,2(8,7 plus de 8,2 (ou 8,7) et atteignant dans d‟autres ouvrages). souvent 9 ou 10. - Conductivité électrique à 25°C ; - Conductivité électrique à 25°C CE >4 Ms/cm. CE<4 Ms/cm. En présence excessive de sels Un excès en sodium échangeable solubles neutres, la fraction couplé à des valeurs de pH élevées argileuse est floculée et le sol est rend l‟argile dispersée et une stable. instabilité structurale du sol. La perméabilité à l‟eau et à l‟air de ces sols est généralement comparable à ceux des sols « normaux ». La perméabilité à l‟eau et à l‟air est restreinte. Les propriétés physiques de ces sols s‟aggravent avec l‟augmentation du pH et du sodium échangeable. La croissance des plantes est Effet sur la affectée par l‟action des sels La croissance des plantes est affectée solubles sur la pression osmotique par l‟action de dispersion du sodium de la solution du sol résultant en échangeable dégradant les propriétés une diminution de disponibilité en physiques du sol. eau. croissance des À travers le pH élève du sol causant plantes des déséquilibres nutritionnels Toxicité des ions tels que les ions incluant notamment une déficience Na, Cl, B, etc. en Calcium. À travers la toxicité d‟ions tels que les ions Na, CO3, Mo, etc. Amélioration du sol L‟amélioration des sols salins se L‟amélioration des sols alcalins se fait par le lessivage des sels fait essentiellement par solubles dans la zone racinaire du remplacement du Sodium sur le 26 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques sol. L‟application d‟amendements complexe échangeable du sol par du n‟est généralement pas nécessaire. Calcium à travers des amendements, le lessivage et le drainage des sels après réaction avec l‟amendement et le Sodium échangeable. Distribution Les sols salins dominent dans les géographique régions arides à semi-arides. Les sols alcalins se trouvent principalement dans les régions semiarides et sub humides. Tableau 5: Classe de la salinité des sols (Maillard, 2001). Classe Conductivité de l’extrait de sol saturé (dS/m) Non salins 0~2 Légèrement salins 2~4 Modérément salins 4~8 Fortement salins 8 ~ 16 Très fortement salins > 16 5. Caractéristiques des eaux salées Toutes les eaux naturelles contiennent des minéraux dissous et des matières gazeuses. (Moughli, 2004 in Ghodbène, 2006). L‟accumulation des sels dans une eau dépend de son origine d‟eau de pluie, l‟eau de surface (la géologie du bassin versant, le climat, l‟évaporation) et l‟eau souterraines : en général, leur composition est assez variable d‟une année (ou saison) à l‟autre s‟il n‟y a pas d‟interventions notables de l‟homme. 27 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques Tableau 6: Classification de l'eau selon Maillard, 2001. CE en Classe -1 Ds.m Concentration en sels totaux en mg/l Type d’eau Non saline < 0.7 < 500 Eau potable et irrigable Légèrement saline 0.7 ~ 2 500 ~ 1500 Eau d‟irrigation Modérément saline 2 ~ 10 1500 ~ 7000 Très saline 10 ~ 25 7000 ~ 15 000 25 ~ 45 15 000 ~ 35 000 Eau souterraine très salée >45 >45 000 Eau de mer Très fortement saline Saumure Première eau de drainage et eau souterraine Seconde eau de drainage et eau souterraine 28 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques II. Stress abiotiques 1. Définition d’un stress Le stress est l‟ensemble des perturbations physiologiques ou pathologiques provoqué dans un organisme par des agents biotiques (parasites, pathogènes) ou abiotiques (salinité, sécheresse, température, pollution,…etc.) (Maarouf et Raynaud, 2007). Il existe des milieux particulièrement secs soit au niveau du sol (sol sableux, sols salés de bord de mer) soit au niveau du climat (climat méditerranéen, déserts, etc.).Les plantes qui vivent dans ces milieux ont développé des adaptations morphologiques ou physiologiques très particulières. Les stress peuvent également affecter le fonctionnement de la plante en perturbant les flux ioniques (Langridge et al., 2006) ou en altérant les parois ou membranes cellulaires (Zhu, 2001 ; Wang et al ., 2003). Parmi les contraintes environnementales, on peut distinguer suivant leur nature plusieurs types de stress. 2. Types de stress 2.1. Stress hydrique Le stress hydrique a été définit comme une baisse ou un excès de la disponibilité de l'eau dans le milieu d‟installation de telle culture, traduisant par une réduction de la croissance de la plante et/ou de sa reproduction par rapport au potentiel de la variété. La contrainte hydrique est le facteur ou l'ensemble de facteurs ayant pour conséquence le stress (Lamaze et al., 1994) 2.2. Stress thermique Dans lequel on distingue les basses températures, gélives ou non gélives, et le shautes températures. En réalité les contraintes environnementales subies par la plante associent le plus souvent, plusieurs types de stress. la salinité par exemple, comprend des stress ionique (toxicité des ions Na+ et Cl-) et osmotique ; la sécheresse quant à elle, recouvre souvent à la fois des stress thermiques et hydriques (ces derniers induisant des stress ioniques) (Belhassen et al.,1995). 29 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques 2.3. Stress ionique Lié à la composition en éléments du sol (carences ou toxicité en certains ions) un déficit en N, P, MO, Cu, Zn, Fe, B,… peut avoir des conséquences importantes sur le développement des plantes. Un excès de minéraux AL, Na, Cl,… peut avoir des effets toxiques (Monneveux et This, 1997). La présence de sels dans les sols est l‟un des problèmes majeurs affectant les contraintes. La salinité couvrant de larges superficies est amplifiée par le manque d‟eau (Abbad et al., 2004). 2.4. Stress salin L‟eau est un élément important pour les plantes, mais parfois cet élément est difficile à être assimilé suivant le milieu naturel. En effet, en cas de stress salin le végétal rencontre un problème en absorbant le sel qui affecte les activités physiologiques des cellules d‟une part et l‟abaissement du potentiel hydrique du sol, ce qui a un impact sur l‟alimentation en eau d‟autre part. Le stress salin est un excès d'ions en particulier, mais pas exclusivement, aux ions Na +et Cl-(Hopkins, 2003). Le stress salin peut directement ou indirectement affecter le statut physiologique des plantes en changeant leur métabolisme, leur croissance et leur développement (Ajmal. K, 2000 ; Gard et al., 2002). Les plantes ont des réponses différentes à cette contrainte, les glycophytes leur croissance est réduite. Par contre les halophytes ont développé des réponses physiologiques vis-à-vis de ce problème (Derkaoui. k, 2011). 3. Conséquences de la salinité sur la plante La salinité est l'un des facteurs limitant pour la croissance des plantes. Les effets de la salinité sont surtout l'arrêt de la croissance, le dépérissement des tissus sous forme de nécroses marginales, suivies par une perte de turgescence, par une chute des feuilles et finalement par la mort de la plante (Zid, 1982). 30 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques 3.1. Action des sels sur les propriétés physico- chimiques du sol Par son pouvoir gonflant et dispersant de l‟argile, le Na+ réduit la macroporosité donc la perméabilité d‟où inhibition de certains oligo-éléments nécessaires aux plantes ou mobilisation d'ions toxiques, tel l‟ion al +++ (Chamayou et Legros, 1989) et dispersion des colloïdes par le Na + (Daoud, 1993; Suarez, 2001, Shaggs et al., 2001). L‟augmentation de la pression du sol rend l‟alimentation en eau des plantes difficile malgré l‟humidité des sols en saison sèche qui est du à leur richesse en éléments hygroscopiques (Halitim, 1985; Chamayou et Legros, 1989; Saidi et al., 2004). 3.1. Action sur l’absorption Selon Halitim en 1973, l‟absorption d‟eau par les racines est conditionnée par le potentiel osmotique. En effet, quand il élevé entrave l‟assimilation d‟eau par les racines. L‟augmentation de la pression osmotique dans un sol salé est liée à la concentration de la solution du sol (Daoud, 1988).D‟après (Djamel, 1993), la capacité de rétention d‟eau régresse selon les cations dans l‟ordre suivant ; NA+ >Mg>Ca++>K+. La concentration de la solution dans un sol salé entraine une augmentation de la pression osmotique, la disponibilité en eau devint impossible (Daoud, 1988). 3.3. Action de la CE sur les plantes La conductivité électrique (CE) permet de mesurer la salinité des eaux et du sol qui est évaluer à partir de l‟extrait de pâte saturée ou diluée (U.S.S.L, 1954; Douaoui, 2004). Elle s‟exprime en décisiemens par mètre (dS/m) ou en millimhos par centimètre (mmho/cm). La CE est proportionnelle à la pression osmotique, (tableau 7). L'eau de mer a une CE=50 mmhos/cm. L‟influence d‟un cation, sur la production, n‟est pas la même selon la nature de l‟anion accompagnateur (Ottowet al, 2005). Le Na+ déprime moins la productivité de certains glycophytes s‟il est en forme de sulfates plutôt que des chlorures. 31 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques Tableau 7: Relation entre la C.E., la pression osmotique et la croissance des plantes. Taux de sel P.O (atm) C.E Effet sur croissance du (mmhos) Végétal g/l % <2 < 0,1 0 ,72 2 Négligeable 2~4 0,1~ 0,3 0,72 ~ 1,44 2~4 Cultures sensibles affectées 4~8 0,3~ 0,5 1,44 ~ 2,88 4~8 Effet sur toutes cultures 8 ~ 15 0,5~ 1,0 2,88 ~ 4,66 8 ~ 16 les espèces tolérantes résistent 1 4,66 16 15 et plus les espèces très adaptées résistent Source : Dogar ,1980. 3.4. Effet sur la germination Le sel inhibe la germination en empêchant l‟absorption d‟eau par l‟embryon ou par son empoisonnement, dû à la toxicité de certains ions. Les graines soumises au stress salin présentent un retard de germination ( Bajji et al.2002). La germination des graines est le stade le plus sensible aux stress salin et hydrique (Boulghalagh et al, 2006). 3.5. Effet sur les composantes du rendement Le stress salin. réduit le poids et le nombre d'épis/m 2, (Bajji et al.,2002); Mais, ce dernier, augmente parfois probablement par l‟utilisation du Na+ comme osmoticum engendrant un potentiel hydrique bas leur permettant de continuer l'absorption d'eau. 3.6. Action du sel sur la croissance et le développement La salinité est une contrainte majeure qui affecte la croissance et le développement des plantes (Bouaouina et al., 2000). La salinité des sols et des eaux demeure, pour les régions arides et semi-arides, un obstacle majeur à la croissance des végétaux. Les effets de la salinité sur la croissance des plantes varient en fonction du type de salinité, de la concentration du sel, de l‟espèce, de la variété, de l‟organe de la plante, ainsi que de son stade végétatif (Levigneron et al., 1995). 32 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques Les effets de la salinité se manifestent principalement par une diminution de la croissance de l‟appareil végétatif, caractérisé par la faible ramification, le faible diamètre des organes, le nombre réduit des nœuds et les réductions du nombre de feuilles et de la longueur de la tige et par conséquent l‟augmentation du rapport racine/tige. Une baisse des poids de matières fraîches et sèches est aussi démontrée (Rush et Epstein,1981). Cette inhibition de la croissance des plantes se fait selon trois manières principales : par une toxicité ionique (surtout de Na+ et Cl-), un stress osmotique et une perturbation nutritionnelle (Greenway et Munns, 1980 ; Levigneron et al, 1995). Une réduction de la croissance de la partie aérienne est la première réponse observée des glycophytes à l‟augmentation de la salinité au niveau des racines. Il s‟agit de l‟effet destructif le plus significatif en cas d‟une exposition prolongée à la salinité. 3.7. Effet de la salinité sur la photosynthèse La salinité réduit la croissance et la photosynthèse de la plante. Cette réduction est due aux effets complexes d'interactions osmotiques, ioniques, et nutritionnelles (Binaire, 1997 in Rasanen, 2002). La présence du chlorure de sodium dans le sol a généralement pour effet de réduire l‟intensité de la transpiration des glycophytes et de nombreux halophytes en l‟absence de toute diminution de la turgescence. Greenway et Munns (1980) suggèrent que la salinité affecte en premier lieu la croissance de la plante puis la photosynthèse, causant suite aux phénomènes de « Feed-back » une réduction de la capacité photosynthétique. Particulièrement chez les glycophytes, la présence continue de Na Cl dans le milieu de culture entraîne une augmentation d‟une part de l‟épaisseur des limbes (ce qui deviendrait un élément limitant dans la porosité stomatique) et d‟autre part des vitesses d‟ouverture des stomates. La photosynthèse étant réduite chez les plantes cultivées en milieu salin. Munns (1993) a tout d‟abord pensé que cet effet dépressif serait à l‟origine de la diminution de la croissance. Toutefois, comme cette croissance diminue plutôt que la photosynthèse et, à long terme, elle décline davantage que cette dernière ; il a alors considéré que l‟accumulation de carbone par les plantes serait affectée par la salinité à cause d‟une réduction de l‟indice foliaire plutôt que du taux de la photosynthèse. 33 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques Le sel peut également provoquer la modification de la densité des stomates, du nombre et du diamètre des vaisseaux du xylème chez les halophytes, ou accélérer le cycle biologique avec changement de la voie métabolique de fixation du carbone (Levigneron et al.,1995). 3.8.Effets toxiques de NaCl sur la plante Certains sels peuvent être toxiques pour les plantes et peuvent en affecter la balance nutritionnelle s‟ils sont présents en concentration excessive ou en proportion anormal. 1) Hyperosmotic stress Stress de salinité (NaCl) Na+ Na+ exclusion Na+/K+ uptake Na+ Water deficit (Plasmolysis) K+H+ + 2) Na toxicity (lonic stress) 3) Biosynthesis of compatible solute 4) Regulation of cytosolic Na+ homeostasis Cytosol Na+ compartmentalization Vacuole Cell wall Figure 17: Effets toxiques du NaCl sur la plante (Jabnoune, 2008) 4. Mécanismes de résistance à la salinité Une plante cultivée sur sol riche en sel doit faire face à sa pénétration dans ses tissus celui-là est rejeté ou accumulé par les différents organes, tissus, cellules et compartiments cellulaires. Les ions chlorure (Cl-) et sodium (Na+) pénètrent via les racines, transportés par la sève xylémique jusqu‟aux tiges et feuilles. Là ils se trouvent soit stockés (plantes de type includer), les feuilles sont riche en (Na +) que les tiges et les racines et le mécanisme de tolérance au sel est dû à la compartimentation des ions toxiques en particulier l‟ion sodium dans la vacuole ; soit au contraire ils sont très peu retenus dans leurs feuilles ( plantes de type excluder) et cette accumulation décroît selon la séquence racines-tiges 34 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques feuilles et ces ions sont alors revéhiculés par la sève phloèmique jusqu‟aux racines (Levigneon et al.,1995). 4.1. L’exclusion La plante empêche le sel de remonter dans la sève jusqu‟aux feuilles. La présence de l‟endoderme dans les racines ainsi que le transport sélectif, leur permet d‟absorber les ions nutritifs utiles et de ré excréter les ions Na+(Genoux et al.,2000). Quelques halophytes peuvent empêcher l‟absorption excessive du sel par son exclusion du sel au niveau des racines et de la partie inférieure de la tige. Dans ce cadre, la sortie de Na+des vaisseaux du xylème en échange d'une entrée de K+venant des cellules parenchymateuses du xylème et du parenchyme avoisinant, joue un rôle important dans la tige et les racines (Luttge et al., 2002). 4.2. Inclusion et compartimentation des ions La compartimentation des ions entre les organes (racines/parties aériennes), les tissus (épiderme/mésophile), ou encore entre les compartiments cellulaires (vacuole/cytoplasme) est l‟un des mécanismes d‟adaptation à la contrainte saline (Ouerghi et al., 1998). L‟inclusion et la compartimentation sont la stratégie la plus efficace pour éviter la toxicité de Na+ sur des sites métaboliques dans le cytoplasme (Jebnoune, 2008 in Bouchoukhi., 2010). La plante utilise en effet le sel pour ajuster la pression osmotique de ses cellules. Elle capte le sel qui parvient aux feuilles, au même titre que l'eau, par le mouvement ascendant de la sève dans les vaisseaux. A l'intérieur des cellules, le sel est alors stocké dans les vacuoles grâce à des systèmes de "pompes" moléculaires. Les vacuoles étant des compartiments fermés au sein de la cellule, le sel est ainsi isolé des constituants cellulaires vitaux (Sentenac et Berthomieu, 2003).Aussi, la vacuole se chargerait-elle en sodium grâce à l‟action d‟un antiport sodium-proton Na+/H+, lequel serait entretenu par le fonctionnement accéléré des pompes à proton Na+/H+. L‟existence d‟un système d‟échange Na+/H+ est largement signalée. Il est alors admis que c‟est la performance de stocker le sel dans les parties aériennes qui est déterminante dans le niveau de tolérance au sel des espèces. 35 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques 4.3. Ajustement osmotique Face à l‟augmentation des forces de rétention de l‟eau dans un sol en cours de dessiccation, un ajustement osmotique peut se manifester, mais à des degrés variables, chez la plupart des végétaux. Les métabolites impliqués dans cet ajustement sont assez variés. Ces solutés ont des propriétés physiques et biologiques compatibles, même à forte concentration, avec les fonctions métaboliques (Tahri et al., 1998). L‟un des principaux caractères physiologiques de tolérance aux contraintes du milieu est l‟ajustement osmotique. Celui-ci est réalisé grâce à une accumulation de composés osmorégulateurs conduisant à une réduction du potentiel osmotique permettant ainsi le maintien du potentiel de turgescence. L‟accumulation de ces composés a été mise en évidence chez plusieurs espèces végétales soumises à la contrainte saline. Cette accumulation varie dans de larges proportions suivant l‟espèce, le stade de développement et le niveau de la salinité. Les différences d‟accumulation des solutés (Acides aminés libres, proline et sucres solubles totaux) entre les plantes témoins et les plantes soumises au stress salin sont très importantes (Elmidaoui et al.,2007). L‟ajustement osmotique apparaît aujourd‟hui comme un mécanisme majeur d‟adaptation aux stress ionique et osmotique qui s‟exprime par la capacité d‟un végétal à accumuler, au niveau symplasmique et de manière active des ions tels que les K+, Na+ et Cl- ou des composés organiques tels les sucres solubles (fructose, glucose, tréhalose, raffinose, fructanes) et certains amino-acides (proline, glycine bétaïne, ß-alaninebétaïne, prolinebétaïne). Parmi les acides aminés pouvant être accumulés, la proline représente l‟une des manifestations les plus remarquables des stress hydriques et osmotiques. Son rôle d‟osmoticum a été rapporté par de nombreux auteurs. L‟accumulation de la proline, induite par les stress, peut être le résultat de trois processus complémentaires: stimulation de sa synthèse, inhibition de son oxydation et/ou altération de la biosynthèse des protéines. La proline serait synthétisée à partir de l‟acide glutamatique via l‟acide 5 carboxylique 1 pyrroline (P5C), mais également via l‟arginine et l‟ornithine (Tahri et al., 1998). 36 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques 5. Mécanismes d’adaptation biochimique à la salinité 5.1. Accumulation des sucres solubles sous stress Les sucres solubles dans l‟eau constituent une source glucidique rapidement métabolisable et couvrent les besoins immédiats de la plante. Ce sont des intermédiaires métaboliques qui sont également une forme de transport et qui peuvent être dans certains cas considérés comme forme de stockage. Ainsi le saccharose, sucre soluble majoritaire dans la plupart des espèces contribue également au stockage hivernal en l‟accumulant dans les vacuoles. Cette accumulation est initiée par une baisse des températures hivernales et contribue à augmenter la résistance au froid (Palonen, 1999 in Mint. M ; 2006). Les autres sucres (glucose, fructose et maltose) peuvent être considérés comme des métabolites intermédiaires à durée de vie relativement courte chez les arbres jeunes (sans fruits) ; leur importance pondérable est négligeable à l‟exception du maltose, en quantité assez importance par l‟hydrolyse des dextrines (Bailey et al, 1957 ; Sauter, 1988). L‟accumulation de sucres est aussi un phénomène supplémentaire révélateur de résistance aux conditions de stress salin, surtout par les teneurs élevées en saccharose et en amidon dans les racines et les feuilles (Zid et Grignon, 1991). Depuis longtemps, il est connu que le taux des sucres augmente considérablement chez des plantes soumises aux différents types de stress ; en effet, cela a été vérifié par Chunyang (2003) chez des arbres adultes d‟eucalyptus sous différents stress hydrique ; et par Noiraud et al., (2000) chez le céleri sous stress salin. Les principaux sucres solubles accumulés sous stress sont : le glucose, fructose et le saccharose (Hare et al., 1998) et ces derniers semblent jouer un rôle très important dans le maintien d‟une pression de turgescence qui est à la base des différents processus contrôlant la vie d‟une plante. D‟après Henin (1976), l‟abaissement du potentiel osmotique conduisait à l‟augmentation dans les feuilles, non seulement de l‟activité spécifique des ribonucléases et phosphatases acides, mais aussi du taux spécifique de sucres solubles. 37 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques III. La germination 1. Définition de la germination La germination est un stade physiologique qui correspond à la transition de la phase de vie latente de la graine sèche à la phase de développement de la plantule. elle commence dès que la graine sèche est hydratée (Anzala,2006). 2. Notion de graine La graine est une structure se développant à partir de l‟ovule fécondée chez les plantes à fleur. Elle contient généralement un embryon ainsi qu‟une réserve de substances nutritives (Indge.,2007). 3. Dormance des graines la vie ralentie est un facteur important de l‟évolution des plantes (Raven et al.,2007). Elle représente chez les végétaux, une forme de résistance aux condition climatiques défavorables (température extrême, sécheresse) (Raven et al,.2007). la caractéristique essentielle de la vie ralentie est la diminution ou l‟arrêt presque total du métabolisme (Prat.,2007). Elle permet la germination au moment où les chances de servie des plantules sont les meilleurs (Raven et al.,2007), comme une période de forte précipitation pour les plantes des milieux désertiques, ou des températures hivernales froides pour les espèces, le niveau d‟acide abcsissique diminue et la germination peut débuter (Indge.,2007). 4. Phases de germination La germination d'une graine est définie comme étant la somme des événements qui commencent avec l'imbibition et se terminent par l'émergence d'une partie de l'embryon, généralement la radicule, à travers les tissus qui l'entourent (Bewley, 1997). Elle se compose de trois phases distinctes selon Bove et al., (2001): La première phase ou phase d‟imbibition, correspond à une forte hydratation des tissus, accompagnée d‟une élévation de l‟intensité 38 Éléments Bibliographiques C h a p i t r e II : Stress abiotiques respiratoire (Heller et al.,2004). Elle implique un mouvement d‟eau dans le sens du potentiel hydrique décroissant (Hopkins.,2003). La deuxième phase ou phase de la germination sensu stricto est caractérisée par une stabilisation de l‟hydratation et de l‟activité respiratoire à un niveau élevé, l‟imbibition par l‟eau est suivie d‟une activation générale du métabolisme de la graine (Hopkins.,2003). La troisième phase correspond à une phase de croissance caractérisée par une reprise de l‟absorption d‟eau et une élévation de la consommation d‟oxygène, puis très rapidement, on assiste à une reprise des divisions et grandissement cellulaire (Hopkins.,2003). I : phase d'imbibition II : phase de germination stricto sensu III : phase de croissance Eau absorbée Allongement de la radicule I II III Temps Figure 18: Courbe théorique d‟imbibition d‟une semence selon Côme (1982). 5. Importance adaptative des graines D‟après Raven et al (2007), les graines présentent des adaptations importantes d‟au moins quatre types : Elles maintiennent un état de dormance lorsque les conditions sont défavorables et postposent la reprise du développent jusqu‟à l‟apparition de conditions meilleures. Elles assurent une protection maximale à la plantule au stade le plus vulnérable de son développement. Elles contiennent des réserves alimentaires qui permettent à la plantule de se développer avant le début de son activité photosynthétique. Elles sont adaptées à la dispersion, ce qui facilite la migration du variété dans habitats nouveaux, il s‟agit peut être de l‟adaptation la plus important . 39 ème 2 Partie Chapitre III Matériel et méthodes Étude expérimentale C h a p i t r e III : Matériel et méthodes CHAPITRE III : Matériel et méthodes 1. Protocole expérimental L‟objectif de cette expérience est d‟étudier l‟effet du stress salin sur la germination de trois variétés de Quinoa en utilisant le NaCl à : 50 meq.l-1, 100 meq.l-1 et 150 meq.l-1, ces concentrations élevées sont choisies pour pouvoir discriminer les variétés entre elles. Chaque traitement est répété trois fois. L'expérimentation a été conduite à l'université Ibn Khaldoun de Tiaret au niveau de laboratoire de physiologie végétale, de la faculté des sciences et de la nature et de vie. 1.1. Le dispositif expérimental Les solutions salines sont préparées en mélangeant le chlorure de sodium NaCl par des pesées équivalentes à la concentration voulue dans un litre d‟eau distillée. Les graines des trois variétés sont reparties sur quatre échantillons dont un est considéré comme témoin. Le protocole général de cette étude est présenté dans le schéma suivant : 50 meq.l-1 100 meq.l-1 variété 1 150 meq.l-1 Témoin Essai 01 50 meq.l-1 100 meq.l-1 Quinoa variété 2 150 meq.l-1 Témoin Essai 01 Essai 01 50 meq.l Essai 01-1 100 meq.l-1 variété 3 150 meq.l-1 Témoin Essai 01 Essai 1 Essai 2 Essai 3 Essai 01 Figure 19 : Protocole expérimental. Essai 01 40 Essai 01 Étude expérimentale C h a p i t r e III : Matériel et méthodes Tableau 8: Quantité de sels utilisés lors de la préparation des solutions salines. 50 meq.l-1 100 meq.l-1 150 meq.l-1 Témoin 2,92 5,84 8,76 Eau distillée NaCl g.l-1 2. Matériel végétal Les semences du Quinoa (Chenopodium Quinoa) utilisées dans les essais de germination ont été fournies par l‟Institut Technique de Grandes Cultures ITGC Tiaret en 2015. Tableau 9: Les variétés étudié et leurs origines Variétés Code dans nos essais Origine Chucara V1 ITGC Tiaret Sajama V2 ITGC Tiaret Sandoval V3 ITGC Tiaret 3. Préparation de la culture 3.1. Germination des graines Les graines sont désinfectées à l‟hypochlorite de Sodium à 0.5% durant quelques minutes (3 min), puis rincées à l‟eau distillée 3 fois. Après la stérilisation, les semences sont mises en culture dans des boites de Pétri. Les graines servant pour les essais de germination sont réparties en lots de 10 graines disposées dans des boîtes de Pétri stériles de quatre couches de papier filtre, dans chaque boite de Pétri sont versées 3 ~ 7 ml d‟eau distillée pour les graines témoins et le même volume des différentes solutions salines pour les graines stressées à la salinité. Les solutions utilisées sont illustrées dans le tableau au-dessus (tableau 8). Pour chaque variété, nous avons compté plus de 120 graines que nous avons reparties sur les différents essais. Figure 20: Disposition des graines du Quinoa dans la boite de Pétri. 41 Étude expérimentale C h a p i t r e III : Matériel et méthodes Les cultures sont incubées à l‟obscurité dans une étuve dotée d‟un thermostat assurant une stabilité thermique convenable, à 25±2°C pendant 7 jours où un contrôle quotidien et minutieux est effectué afin d‟observer l'évolution de la germination des graines. Etuve Figure 21 : Répartition des boites de Pétri dans l‟étuve. Dans notre cas, nous avons considéré qu‟une graine a germé lorsque la radicule a percé l‟enveloppe et dépasse 0.5cm de long. Au cours des observations, nous avons pris le soin d‟imbiber le milieu de culture en arrosant dès que nécessaire. Dès l‟apparition de la pointe de la radicule à travers les enveloppes, nous avons procédé régulièrement au comptage des graines germées. Figure 22 : Germination des premières graines. 42 Étude expérimentale C h a p i t r e III : Matériel et méthodes 3.2. Préparation des alvéoles et rempotage Les boites de Pétri sont utilisées quand il s'agit de tester de germination sur de très courtes durées (7 jours maximum). Pour les premières phases qui suivent la germination (phase de 2, 4 et 6 feuilles), l'utilisation des boites de Pétri présente divers inconvénients qui risquent de fausser les résultats. En effet, par leur faible capacité de rétention de l'eau, le dessèchement et/ou l'excès d'eau de la couche porteuse de graines (coton ou papier filtre) nécessitent des manipulations onéreuses. Compte tenu, de ces inconvénients, nous avons été amenés à transplanter (rempoter), les graines germer et parfois même à ressemer de nouvelles graines dans des plaques de culture alvéoles en respectant le protocole des traitements pour terminer la deuxième partie de notre expérience c'est-à-dire évaluer la teneur de chlorophylle et le dosage des sucres solubles. Dès l‟apparition des premières feuilles, les plantules sont repiquées dans les alvéoles remplis de sable mélangé à de terreau, à raison d‟une plante par alvéole. Figure 23: Transplantation des plantules vers des plaques alvéolées. 3.3. Paramètres étudiés 3.3.1. Paramètre physiologique Taux d’imbibition Le taux d‟imbibition ou la prise d‟eau relative des graines en germination de l‟ensemble des variétés et au niveau des quatre traitements osmotiques est déterminée chaque 12 heures, du début de la germination jusqu‟à la percée des téguments par la radicule, équivalent à 72heures de temps de germination. L‟imbibition est déterminée par le rapport suivant : 43 Étude expérimentale C h a p i t r e III : Matériel et méthodes ( ) - Imbibition, représente la prise d‟eau pendant un temps t, exprimée en pourcentage. - Pt : représente le poids du grain après un temps t de mise en germination exprimé en grammes, ce poids Pt est estimé par pesée des graines prélevées des différents milieux de germination et essuyées délicatement avec un papier buvard afin d‟éliminer toutes traces de l‟eau de surface. - Pi : est le poids initial de la graine déterminé avant la mise en germination exprimé en grammes. Taux de germination Le taux de germination c'est le pourcentage de graines pour lesquelles le germe est sorti dans un temps donné, c'est une mesure importante pour l'évaluation de la vigueur et la tolérance des variétés aux stress. Dans notre cas, nous avons considéré qu‟une graine a germé lorsque la radicule a percé l‟enveloppe et est devenue visible à l‟œil nu selon la définition de COME (1970). Au cours des observations, nous avons pris le soin d‟imbiber le milieu de culture enarrosant dès que nécessaire. L‟ambiance de l‟étuve est maintenue humide en plaçant dansle fond de celle-ci un bac plein d‟eau. La taux de germination des graines relevé chaque 12 heures pendant 7 jours (toute la durée de germination) de mise en germination, est exprimé en pourcentage et représente le nombre de graines germées par rapport au nombre total des graines initialement mises en germination, à travers le rapport suivant : ( ) é Précocité de germination En générale, chaque espèce dispose d‟une précocité de germination spécifique à sa nature, car même placée dans les mêmes conditions expérimentales, le début d‟apparition de la radicule à travers la membrane n‟aura pas lieu en même temps chez toutes les graines (RENARD, 1975). Ce paramètre est déterminé lorsque nous observons les premières graines germées. 44 Étude expérimentale C h a p i t r e III : Matériel et méthodes Dans ce cas, la précocité de la germination est exprimée par le taux des premières graines germées correspondant à l‟intervalle de temps entre le semis des graines et les premières graines germées (BELKHODJA, 1996). Vitesse de germination Elle caractérise la variation dans le temps des taux de germination dès l‟apparition de la première pointe de la radicule d‟une des graines jusqu‟à la stabilité de la germination. Elle peut s‟exprimer par : - Le taux de germination obtenu à un moment donné. - Le temps nécessaire à l‟obtention de 50% de germination. - Le coefficient de vélocité (CV) proposé par KOTOWSKI (1926) avec un temps moyen de germination (TMG). Le temps moyen de germination (TMG) correspond à l'inverse du coefficient de KOTOWSKI (CV). N1 = nombre de graines germées au temps T1. N2 = nombre de graines germées entre le temps T 1 et T2 N3, …. Nn = graines germées au temps T3… ….jusqu'au temps Tn Dans nos calculs nous avons retenu les deux formules de Kotowski consistant à calculer le coefficient de vélocité (CV), et le temps moyen de germination TMG. 3.3.2. Paramètres morphologiques Longueur moyenne de la radicule La longueur moyenne de la radicule des grains germés (LMR, mm) est évaluée après 48 h, 72 h, 96 h et120 h de traitement pour chaque concentration, en comptabilisant la longueur totale des racines pour chaque traitement et en la divisant par le nombre total de grains (germé ou pas) (BELKHODJA, 1996). La mesure est effectuée à l‟aide d‟une ficelle de coton, qui permet de prendre en compte les courbures de la radicule. 45 Étude expérimentale C h a p i t r e III : Matériel et méthodes 3.3.2. Paramètres biochimiques Les paramètres biochimiques consistent à mesurer les quantités des constituants des organes biologiques en général sucres solubles ; chlorophylle ; protéines totales ; acides aminés ; proline ; lipides ...etc. Dosage de la chlorophylle La chlorophylle a été dosée, durant le stade de 6 feuilles, pour chaque variété et chaque traitement. La technique de dosage des chlorophylles a, b et totale(t), utilisée est celle d‟Arnon(1949). On écrase 100 mg des feuilles et 10 ml d‟acétone à 80 %, dans un mortier en porcelaine. La solution est filtrée et conservée à l'obscurité dans des boites noires pour éviter l'oxydation de la chlorophylle par la lumière. Le dosage se fait par le prélèvement de 3 ml de la solution dans la cuve à spectrophotomètre. En fin la lecture se fait aux deux longueurs d'ondes 645 et 663 nm, et l'étalonnage de l'appareil se fait par la solution témoin d'acétone à 80%. La détermination de la teneur en chlorophylle a; b et dela chlorophylle totale t est réalisée selon les formulesd‟ARNON : Chl. a (mg/l) = 12,7 DO (663) – 2,59 DO (645) Chl. b (mg/l) = 22,9 DO (645) – 4,68 DO (663) Chl. (a+b) = Chl. a + Chl. b Ou : Chl. a (µg/g MF) = [12,7 × DO (663)– 2,59 × DO (645)]× Chl. b (µg/g MF) = [22,9 × DO (645) – 4,68 × DO (663)] × Chl. (a+b) (µg/g MF) = Chl. a + Chl. b 46 Étude expérimentale C h a p i t r e III : Matériel et méthodes Chl.a: chlorophylle a. Chl.b: chlorophylle b. Chl.t ou (a+b) : chlorophylle totale. DO: densité optique en nm. V : volume de la solution extraite. W : poids de la matière fraîche de l‟échantillon100mg. Dosage des sucres solubles. Les sucres solubles totaux (saccharose, glucose, fructose, leurs dérivés méthyles et les polysaccharides) sont dosés par la méthode au phénol de Dubois et al., (1956). Elle consiste à prendre 100 mg de matière fraîche, placés dans des tubes à essai, on ajoute 3ml d‟éthanol à 80% pour l‟extraction des sucres. On laisse à température ambiante pendant 48 heures. Au moment du dosage, les tubes sont placés dans une étuve à 80° C pour faire évaporer l‟alcool. Dans chaque tube, on ajoute 20 ml d‟eau distillée. C‟est la solution à analyser. Dans des tubes à essai propre, on introduit 1 ml de la solution à doser auquel on ajoute 1 ml de solution de phénol à5% (le phénol est dilué dans de l‟eau distillée). Les tubes sont soigneusement agités. On ajoute alors 5 ml d‟acide sulfurique concentré à l‟aide d‟une burette dont le jet tombe brutalement sur la surface du liquide. On obtient, une solution jaune orange à la surface, on passe au vertex pour homogénéiser la couleur de la solution. On laisse les tubes pendant 10 mn et on les place au bain-marie pour 10 à 20 mn à une température de 30°C (La couleur de la réaction est stable pendant plusieurs heures). Les mesures d‟absorbances sont effectuées à une longueur d‟ondes de 485 nm. Enfin des résultats des densités optiques sont rapportés sur un courbe étalon (Fig. 24) des sucres solubles (exprimés en glucose). Les résultats des concentrations en sucres solubles sont déduits à partir d‟une courbe-étalon de solutions de glucose à différentes concentrations préparées dans les mêmes conditions que les échantillons et exprimés en μg.100 mg-1 de matière végétale. On détermine la longueur d‟onde de la solution à 485 nm puis convertit les densités optiques selon la courbe d‟étalonnage en µg.g-1MF. 47 Étude expérimentale C h a p i t r e III : Matériel et méthodes La densité optique Sucres solubles (µg/g MS) = DO (485) × 1.657 DO Linéaire Concentration en glucose Figure 24 : Courbe étalon du dosage des sucres solubles. 4. Analyse statistique Les données sont calculées sous forme d‟une moyenne de trois répétitions à l‟aide du logiciel Microsoft office Excel 2007 et les graphiques également réalisés à l‟aide du même logiciel. Les résultats sont traités et analysés par la suite avec le logiciel STATISTICA 8 dans le but de déterminer la signification des différents traitements salins et leurs effets sur les paramètres que nous avons étudiés par l‟analyse de la variance à deux facteurs (variétés et stress salin). Un test de comparaison des moyennes a été fait chaque fois qu‟il y avait un effet significatif des facteurs étudiés, pour révéler la variété qui tolère mieux la salinité. 48 Chapitre IV Résultats et discussion Étude expérimentale C h a p i t r e IV : Résultats et discussion CHAPITRE IV : Résultats et discussion I. Résultats et discussion 1. Effets de la salinité sur les paramètres physiologiques 1.1. Paramètres d’évolution du taux d’imbibition Les résultats obtenus (figures 25, 26, 27), indique que l‟absorbance d‟eau par les graines est influencée par la nature des variétés testés. La pression osmotique influe également et de manière importante sur l‟expression et les variations des niveaux d‟absorption hydrique à 12h, 24, 36, 48, 60 et 72h après la mise en germination. Le besoin d‟eau par les grains en germination est important au cours de la première phase du processus . Au niveau des témoins, les résultats moyens obtenus montrent une nette prédominance du taux d‟imbibition des graines, en enregistrant un taux d‟imbibition élevé dépassant 100 % pour l‟ensemble des variétés ce taux chute dès que la concentration en NaCl augmente de 50 meq.l-1, 100 meq.l-1 et l‟allure de la prise d‟eau diminue progressivement après 36h. 120 Taux d'imbubition % 100 80 Temoins 60 50meq.l-1 40 100meq.l-1 150meq.l-1 20 0 12h 24h 36h 48h 60h 72h Temps apres semis (heures) Figure 25: Évolution moyenne du taux d‟imbibition de la variété Chucara en fonction du traitement appliqué. 49 Étude expérimentale C h a p i t r e IV : Résultats et discussion 120 Taux d'imbubition % 100 80 Temoins 60 50meq.l-1 40 100meq.l-1 150meq.l-1 20 0 12h 24h 36h 48h 60h 72h Temps apres semis (heures) Figure 26 : Évolution moyenne du taux d‟imbibition de la variété Sajama en fonction du traitement appliqué. 120 Taux d'imbubition % 100 80 Temoins 60 50meq.l-1 40 100meq.l-1 150meq.l-1 20 0 12h 24h 36h 48h 60h 72h Temps apres semis (heures) Figure 27 : Évolution moyenne du taux d‟imbibition de la variété Sandoval en fonction du traitement appliqué. Après 72 heures, on observe que la variété Sajama a inscrit le taux d‟imbibition le plus élevé (100,35%, 87,22%, 77,08%), par contre le plus faible taux d‟imbibition est détenu par la variété Sandoval,en inscrivant un taux évalué à 72,03% et 37,56% successivement pour les deux traitements 100 meq.l-1 et 150 meq.l-1. 50 Étude expérimentale C h a p i t r e IV : Résultats et discussion 1.2. Taux final de germination Le taux final de germination est indiqué par la figure 28 pour chaque traitement. Les mesures sont obtenues dans un intervalle d‟une semaine ; il faut noter qu‟au-delà de cette période, les grains restant dans les boites de Pétri n‟ont manifesté aucun signe de germination pendant toute la durée de l‟essai. Taux de germination % 100 80 Chucara Sajama 60 Sandoval 40 20 0 Temoin 50 100 150 Concentration en NaCl meq.l-1 Figure 28 : Évolution du taux de germination en fonction des différents traitements de NaCl. Le traitement des grains à l‟eau distillée (témoin) induit une forte germination puisque les taux de germination avoisinent 100%, mais en présence des concentrations croissantes de NaCl et quelle que soit le génotype, le taux de germination des graines stressées est réduit comparativement au témoin et ceci pour les trois traitements salins 50, 100 et 150 meq.l-1, avec une observation générale que le seuil de 30 % est dépassé pour toutes les variétés et dans toutes les conditions de l‟expérience. Par ailleurs, l‟estimation du taux de germination montre que la variété Sajama a inscrit un taux élevé (88%, 70% et 40%) par rapport les autres variétés ; Chucara (75%, 55% et 35%) et Sandoval (65%, 55% et 30%) respectivement pour les trois traitements de NaCl à 2.92g/l 5.84g/l et 8.76g/l. 51 Étude expérimentale C h a p i t r e IV : Résultats et discussion Tableau 10: Analyse de la variance du taux de germination des trois variétés sous différents stress salins. Effet variétal Variables Taux de germination Effet salin Interaction F1 × F2 Test F P Test F P Test F P 375,1 0,000 3844,5 0,000 35,1 0,005 L‟analyse de la variance à deux facteurs (tableau 10) démontre que les variations constatées s‟opèrent sous l‟influence des niveaux de salinité imposés et du génotype, car les résultats sont très hautement significatifs pour l‟impact du NaCl, (p=0,00) et celui du facteur variétal (p=0,00). Il en est de même pour l'interaction des deux facteurs « variétés × salinité » (p>0,05). En effet, l‟action de la salinité est remarquable, la figure 28 révèle que l‟intensification du traitement salin sur les trois variétés de Quinoa s‟accompagne d‟une diminution du taux de germination. 1.3. Précocité de germination Précocité de la germination % 100 90 80 70 60 50 Chucara 40 Sajama 30 Sandoval 20 10 0 Temoin 50 100 Concentration en NaCl 150 meq.l-1 Figure 29: Précocité de la germination des graines après le 2e jour de semis En absence de sel, les graines témoins (imbibées à l‟eau distillée) germent plus précocement dès le 2éme jour après le semis, avec des taux qui varient entre 80%, 82% et 79% respectivement pour les trois variétés Chucara, Sajama et Sandoval. En revanche en présence de sel et avec la plus faible concentration 50 meq.l-1 (2,92 g/l), la précocité de germination chute significativement, en effet les graines démarrent leur 52 Étude expérimentale C h a p i t r e IV : Résultats et discussion germination avec un taux réduit (52%, 55% et 40%). À partir de 100 meq.l-1 de NaCl, la précocité de germination se révèle encore plus faible (30%, 35%, 20%). Il faut noter que les graines de la variété Sandoval recevant la solution saline à 150 meq.l-1(8,76g/l) n‟ont manifesté aucun signe de germination, contre un taux très faible : 10% et 20% respectivement pour Chucara et Sajama pour le même traitement. Tableau 11: Analyse de la variance de la précocité de germination des trois variétés sous différents stress salins Variables Précocité de germination Effet variétal Effet salin Interaction F1 × F2 Test F P Test F P Test F P 822,9 0,076 12773,12 0,000 68,97 0,005 L‟analyse de la variance (tableau 11) révèle un effet très hautement significatif de la salinité aux concentrations testées sur la précocité de germination. Par contre l‟effet variétal sur la précocité de germination n‟est pas significatif. En effet, les graines stressées au sel, réagissent avec une germination de plus en plus tardive par rapport aux graines témoins. Coefficient de vélocité 30 CV 7 TMG 6 25 5 20 4 15 3 10 2 5 1 0 0 Temoin 50 100 150 Temps moyen de germination (jours) 1.4. Vitesse de germination [NaCl] (meq.l-1) Figure 30 : Coefficient de vélocité (CV) et temps moyen (TMG) de germination pour la variété Chucara. 53 C h a p i t r e IV : Résultats et discussion Coefficient de vélocité 30 CV 7 TMG 6 25 5 20 4 15 3 10 2 5 1 0 0 Temoin 50 100 150 Temps moyen de germination (jours) Étude expérimentale [NaCl] (meq.l-1) Figure 31 : Coefficient de vélocité (CV) et temps moyen (TMG) de germination pour la variété Coefficient de vélocité 30 7 CV 25 TMG 6 5 20 4 15 3 10 2 5 1 0 0 Temoin 50 100 150 Temps moyen de germination (jours) Sajama. [NaCl] (meq.l-1) Figure 32 : Coefficient de vélocité (CV) et temps moyen (TMG) de germination pour la variété Sandoval. Dans l'ensemble, les résultats montrent que le traitement salin affecte le processus germinatif des trois variétés, particulièrement lorsque la pression osmotique est élevée ; le survol des trois représentations graphiques, montre que la vitesse de germination, exprimée en coefficient de vélocité (CV) est inversement proportionnelle à la concentration en sel, elle diminue avec l‟augmentation de la concentration en NaCl : Pour les trois variétés Chucara, Sajama et Sandoval, le coefficient de vélocité (CV) le plus élevé est celui des graines témoins (22,07%, 21,56% et 20,51%). Dès que la concentration à 50meq.l-1 est appliquée, le coefficient de vélocité chute à (21,70%, 21,37% et 19,76%) et 54 Étude expérimentale C h a p i t r e IV : Résultats et discussion diminue encore plus avec l‟augmentation de la concentration soit (18.75%, 18.96% et 18.75%) sous le traitement à 150meq.l-1de NaCl. Si on compare les variétés entre elles, on observe clairement que la diminution de coefficient de vélocité (CV) a été moins importante chez la variété Sajama par rapport aux autres variétés Pour le temps moyen de germination (TMG), il en résulte que le temps le plus court est enregistré pour les graines témoins (4,52j, 4,63j et 4,87jours) respectivement pour Chucara, Sajama et Sandoval ; il passe à (4,60j, 4,67j et 5,05jours) lorsque les graines reçoivent le traitement à 50meq.l-1.Ce temps est plus long lorsque les graines sont stressées à 150meq.l-1 de NaCl (5.3j, 5.27j et 5.33jours). Contrairement au coefficient de vélocité (CV), le temps moyen de germination (TMG) s‟allonge avec l‟augmentation de la concentration en NaCl. 2. Effets de la salinité sur les paramètres morphologiques 2.1. Longueur moyenne de la radicule Longueur des racines en cm 10 8 6 Chucara 4 Sajama Sandoval 2 0 temoin 50 [NaCl] 100 150 (meq.l-1) Figure 33 : Variation de la longueur de la radicule de différentes variétés en fonction de la concentration en sel. Les résultats obtenus de la longueur de la radicule montrent que les variations de cette caractéristique se réalisent d‟une manière dépendante de la nature des variétés étudiés, ces résultats indiquent que l‟augmentation de la pression osmotique a affecté l‟ensemble des variétés pour l‟élaboration de ce paramètre. 55 Étude expérimentale C h a p i t r e IV : Résultats et discussion Au niveau des graines témoins, les longueurs sont comprises entre 5,3cm valeur maximal, donnée par la variété Sajama et une autre minimale 4 cm, extériorisée par Sandoval. Au lot conduit à 50meq.l-1, les variétés présentent des valeurs qui varient entre 4,5cm pour la variété Sajama et 4,3 cm pour la variété Chucara. Dans ces mêmes conditions, la variété Sandoval s‟avère le plus sensible relativement à l‟expression de la longueur de la radicule avec 3,9 cm. Dans le milieu de germination à 100 meq.l-1, la variété Sandoval a montré la plus faible longueur (3 cm). A l‟échelle du 3éme traitements 150meq.l-1, la réduction de la longueur de la radicule s‟accentue, et par conséquent les valeurs varient entre 4,1 ~ 2,7 cm pour les trois génotypes. Tableau 12: Analyse de la variance de la longueur des racines des trois variétés sous différents traitements salin. Variables Longueurs des racines Effet variétal Effet salin Interaction F1 × F2 Test F P Test F P Test F P 169,72 0,000 281,98 0,000 4,01 0,006 L‟analyse de la variance relative à la longueur moyenne des racines montre qu‟il existe un effet très hautement significatif de la salinité sur les différentes variétés de Quinoa avec une sensibilité différente d‟une variété à l‟autre vis-à-vis le stress salin ; ainsi que pour l'interaction variété et traitements (p=006) ce qui indique que ces trois variétés répondent de la même manière face à la présence du sel en diminuant la longueur des racines. 3. Effets de la salinité sur les paramètres biochimiques 3.1. Effet de la salinité sur la teneur en chlorophylles Le taux de variation de la moyenne de la teneur en chlorophylle (a), (b) et totale (a+b) dosées par rapport au témoin en fonction du stress salin pour les trois variétés Chucara, Sajama et Sandoval est illustré par les figures 34, 35 et 36. 56 Étude expérimentale C h a p i t r e IV : Résultats et discussion Teneur en Chl a (mg/g MF) 300 250 200 Chucara 150 Sajama 100 Sandoval 50 0 Temoin 50 100 150 Concentration en NaCl meq.l-1 Figure 34 : Variation de la teneur en pigment chlorophyllien (a). Teneur en Chl b (mg/g MF) 300 250 200 Chucara 150 Sajama 100 Sandoval 50 0 Temoin 50 100 150 Concentration en NaCl meq.l-1 Figure 35 : Variation de la teneur en pigment chlorophyllien (b). 57 Étude expérimentale C h a p i t r e IV : Résultats et discussion Teneur en Chl a+b (mg/g MF) 300 250 200 Chucara 150 Sajama 100 Sandoval 50 0 Temoin 50 100 150 Concentration en NaCl meq.l-1 Figure 36 : Variation de la teneur en pigments chlorophylliens (a+b). Les résultats obtenus montrent que le stress salin influe sur la moyenne de la teneur en chlorophylle (a), chlorophylle (b) et par conséquent chlorophylle (a+b) chez toutes les espèces étudiées. Chez les témoins, les teneurs en chlorophylles sont restées plus importantes, comparativement aux teneurs en chlorophylles dosées chez les plantes traitées par le sel. Les réductions les plus importantes ont été notées en présence de 150 meq.l -1 soit 8,76g/l de NaCl. Les moyennes les plus élevées de la teneur en chlorophylle (a) et chlorophylle (b) pour les trois traitements sont enregistrées chez la variété Sajama par rapport les autres variétés Chucara et Sandoval. Le stress salin n‟induit pas de la grande variation de la teneur en chlorophylle (a) par rapport la teneur en chlorophylle (b). Tableau 13 : Analyse de la variance des pigments chlorophylliens des trois variétés sous différents traitements salins. Variables Chlorophylle (a) Chlorophylle (b) Chlorophylle totale (a+b) Effet variétal Effet salin Interaction F1 × F2 Test F P Test F P Test F P 424,19 0,016 1360,15 0,000 85,65 0,016 28,80 0,000 2339,5 0,000 390,8 0,000 169,7 0,000 3261 0,000 336,8 0,000 58 Étude expérimentale C h a p i t r e IV : Résultats et discussion L'analyse de la variance de la teneur en chlorophylle (a), (b) et totale (tableau 13) montre que la teneur en pigments chlorophylliens est fortement influencée par les variations de la solution saline (p<0,05). En effet, pour l‟ensemble des traitements ; le stress salin réduit la teneur des pigments chlorophylliens. Cette réponse a tendance régressive dans la teneur en pigments chlorophylliens reste toutefois très peu influencée par la variabilité génotypique des variétés étudiées, (p=0,016). Par ailleurs, l'interaction entre les deux facteurs pris en compte « effet variétal × effet salinité » permet également des fluctuations de la teneur en chlorophylle. Teneur en sucres solubles (μg/100 mg MF) 3.2. Effet de salinité sur la teneur en sucres solubles 3500 3000 2500 2000 Chucara 1500 Sajama 1000 Sandoval 500 0 0 50 100 150 Concentration en NaCl meq.l-1 Figure 37 : Variation de la teneur en sucres solubles au niveau de la feuille en fonction des variétés et du traitement salin. D‟après la figure 37, il s‟est avéré que le stress salin provoque une variation de la teneur en sucres solubles au niveau des feuilles pour les trois variétés, on remarque que les accumulations en sucre soluble augmentent avec la concentration en NaCl uniquement pour la variété Sajama (2191,78 et 3060,95µg/100mg MF) pour les deux concentrations 50 et 100 meq.l-1par rapport au témoin, puis elle chute brusquement avec le troisième traitement (150 meq.l-1). Contrairement aux deux autres variétés (Chucara et Sandoval) dont la plus grande valeur est enregistrée dans le deuxième traitement c‟est-à-dire à 50 meq.l-1 puis cette teneur diminue fortement avec l‟augmentation de NaCl. 59 Étude expérimentale C h a p i t r e IV : Résultats et discussion Tableau 14 : Analyse de la variance de la teneur en sucres solubles des trois variétés sous différents stress salins. Variables Sucres solubles Effet variétal Effet salin Interaction F1 × F2 Test F P Test F P Test F P 106067 0,000 33318 0,000 50857 0,004 L‟analyse des résultats révèle que la teneur en sucres solubles a été affectée par le stress salin appliqué de manière très hautement significative (p=0,000). La nature des variétés testées semble aussi être affectée par l‟expression de ce paramètre (p=0,000), de même qu'il y'a un effet de l‟interaction « salinité × variété » sur l‟expression de ce paramètre. Ce qui indique que, le NaCl a fortement perturbé l‟accumulation des sucres solubles chez les trois variétés et cette fluctuation diffère d‟une variété à l‟autre. 60 Discussion Étude expérimentale C h a p i t r e IV : Discussion II. Discussion Cette étude a porté sur des réponses physiologiques à travers le taux d‟imbibition, taux et vitesse de germination et des réponses morphologiques à travers la langueur et le nombre des racines ; sont intégrées aussi quelques composantes biochimiques à travers l‟analyse des teneurs en chlorophylles et des sucres solubles. D‟après les résultats obtenus, il est possible de retenir les points essentiels suivants : Taux final et vitesse de germination Sous stress au NaCl, le taux final de germination ne change pas beaucoup, mais le temps de germination s‟allonge avec l‟augmentation de la concentration du NaCl, des résultats similaires ont été observés chez de nombreuses espèces végétales (DEMIR et al.,2003 ; KHAJEH-HOSSEINI et al.,2003 ; OKCU et al.,2005 ; KAYA et al.,2006). Ces auteurs ont démontré que le potentiel osmotique dû au NaCl affecte l‟absorption d‟eau et le temps moyen de germination, mais pas le taux final de germination. Pour ce qui est du taux final de germination des graines stressées, on a constaté qu‟il diminue comparativement au témoin et ceci pour les trois concentrations utilisées. Selon Prado et al. (2000), la diminution du taux de germination des graines soumises à un stress salin serait due à un processus de dormance osmotique développé sous ces conditions de stress, représentant ainsi une stratégie d‟adaptation à l‟égard des contraintes environnementales, en plus de la réduction du taux de germination, le sel retarde également la germination et ralentit sa vitesse. La vitesse de germination, exprimée en coefficient de vélocité (Cv) est proportionnellement inversée par rapport à la concentration en sel ; elle diminue avec l‟augmentation de la concentration en NaCl, au contraire le temps moyen de germination (TMG) s‟allonge. Ce retard pourrait être dû selon Prado et al. (2000) à l‟altération des enzymes et des hormones qui se trouvent dans la graine. Il pourrait s‟agir également d‟une difficulté d‟hydratation des graines suite à une pression osmotique élevée entrainant une certaine inhibition des mécanismes aboutissant à la sortie de la radicule hors des téguments et par conséquent un retard de germination des graines. Langueur des racines Les résultats obtenus de la longueur des racines montre que leur croissance est réduite, et cette réduction s‟accentue par l‟augmentation du niveau du stress salin, une telle situation pourrait s‟expliquer par le fait que le stress salin peut conduire à l‟altération des processus 61 Étude expérimentale C h a p i t r e IV : Discussion métaboliques de la croissance du a l‟effet toxique d‟excès d‟ions Na+ et Cl-, ce qui affecte considérablement la croissance du système racinaire (Hajlaoui et al., 2007). Teneur de chlorophylle Selon Munns et Termaat (1986), durant une exposition à long terme à la salinité. Les symptômes visuels de la sénescence des feuilles en réponse à la salinité sont associés à la réduction du contenu de la chlorophylle. La salinité provoque une dégradation de la chlorophylle et une accumulation de la fraction soluble des composés azotés (Viégas et Siveira, 1999). Nos résultats montrent que l‟augmentation des concentrations salines s‟accompagne d‟une nette diminution dans chlorophylle(a) et chlorophylle(b) chez les variétés (Chucara, Sajama et Sandoval) Plusieurs études expliquent que la diminution de la teneur de la chlorophylle sous stress salin résulte de la dégradation de la chlorophylle et/ou la réduction du taux de synthèse avec la diminution de l‟instabilité membranaire des thylakoïdes. Vieira et al., (2001) suggèrent que la réduction de la chlorophylle des plantes traitées est due à l‟augmentation de l‟activité d‟enzymes de dégradation de la chlorophylle «la chlorophyllase». La salinité détruit la structure fine des chloroplastes et provoque l‟instabilité des complexes protéines-pigments et la diminution de la teneur en chlorophylle (Epstein et al., 1980). La réduction de la concentration en chlorophylle en conditions de stress salin est attribuée à l‟augmentation de l‟activité des enzymes catalytiques « Chlorophyllase ». Teneur de sucres solubles D‟autre part nos résultats ont mis en évidence une augmentation de la teneur en sucres solubles lors de l‟application du stress salin au stade de germination, cette accumulation devient plus importante chez la variété Sajama avec l‟augmentation du stress comparativement aux autres variétés. D‟après Belkhodja M., (1996), les sucres solubles sont des indicateurs de degrés de stress, à cause de son importante augmentation lors de la sévérité, les sucres métaboliques (glucose, galactose, saccharose, et fructose) permettent la résistance aux différents stress. Selon Hare et al., (1998), ces principaux sucres semblent jouer un rôle important dans le maintien d‟une pression de turgescence qui est à la base des différents processus contrôlant la vie d‟une plante. Des résultats comparables ont été rapportés par Belkheiri (2009), l‟accumulation des sucres solubles semble induire la gélification du contenu cellulaire en saturant le milieu intracellulaire. Ce phénomène permet d‟éviter la cristallisation des molécules contenues dans la cellule et donc limiter les dommages au niveau des structures cellulaires (protéines, membrane). 62 Conclusion et perspectives Conclusion et perspectives Conclusion La salinisation du sol limite considérablement la production des cultures et par conséquent a des effets négatifs sur la sécurité alimentaire. Les conséquences se répercutent à la fois en termes socioéconomiques et environnementaux. La prévention, la mise en valeur des sols salins et l‟utilisation de nouvelles espèces résistantes, combinée à de bonnes pratiques culturales, peut prévenir et, dans certains cas, réduire la salinisation. Compte tenu de l‟intérêt du Quinoa désignée par la FAO en 2013 comme l'une des cultures les plus prometteuses pour la lutte contre la faim et la pauvreté dans le monde, et de sa très forte adaptabilité aux différents milieux ; la compréhension des mécanismes physiologiques impliqués dans sa tolérance au sel est une étape déterminante pour l'extension de sa culture, et établir des critères de tri des variétés intéressantes C‟est dans cette perspective vient cette étude qui cherche à réunir des observations aussi précises et objectives que possible sur la tolérance du Quinoa vis-à-vis au stress salin et plus particulièrement sur le processus de germination à travers une série de mesures d‟ordre physiologique biochimique et morphologique. Les résultats obtenus lors de notre expérimentation nous permettent d‟en tirer les remarques suivantes : - Quant au taux de germination, ce paramètre constitue le meilleur moyen d‟identification de la variété tolérante en conditions de stress salin, et donne toujours une idée plus ou moins précise du comportement des autres variétés étudiées - L‟estimation de ce paramètre montre qu‟il y a des différences chez les trois variétés. Ainsi, nous notons que la variété Sajama a enregistré un taux de germination plus élevé par rapport aux autres variétés ; Chucara et Sandoval. - Les caractères morphologiques ; la longueur des racines n‟évoluent pas de la même façon dans les différentes concentrations. Certaines variétés sont plus rapides et vigoureuses dans leurs développements, ce qui est le cas avec la variété Sajama. - Nos résultats montrent que l‟augmentation des concentrations salines s‟accompagne d‟une nette régression des qualités en chlorophylle(a) et chlorophylle(b) chez les trois variétés (Chucara, Sajama et Sandoval) dans les trois concentrations. 63 Conclusion et perspectives - Les résultats nous permettent d‟affirmer les fortes accumulations de sucres solubles, en particulier chez la variété Sajama, révèle un indice de tolérance manifesté par cette dernière. - Enfin, et après l‟étude de divers facteurs, nous concluons que le stress salin provoque les mêmes mécanismes de la réponse chez les trois variétés, mais à des degrés différents. À la lumière de ces résultats obtenus et suite aux remarques que nous avons faites au cours des essais réalisés, nous considérons que notre étude, comme toute autre, ne peut être que partielle et qu‟elle nécessite absolument d‟être complétée par d‟autres recherches. Les perspectives de notre étude visent à contribuer à l‟enrichissement des recherches sur sur cette nouvelle espèce. Comme complément à la présente étude, les points suivants nous semblent assez pertinents : - Nécessité de pratiquer des tests de résistance aux différents stress abiotique durant le cycle complet de la plante ; -Procéder à l‟élaboration d‟un programme de développement de la culture du Quinoa et d‟évaluer son comportement dans les conditions réelles c‟est-a-dire dans nos conditions édapho-climatiques ; - Généraliser l‟étude aux autres variétés. - Compléter les travaux agronomiques par des travaux technologiques quantitatifs et qualitatifs tels que sa valeur nutritive pour mieux exploiter les aptitudes culinaires et industrielles de cette espèce. 64 Références bibliographiques Références bibliographiques Références bibliographiques [1]. Abbad A.; El Hadrami A.; El Hadrami I. and Benchaabane A., 2004Seasonal chemical composition of leaves of three Atriplex halimus (Chenopodiaceae) Natural populations grown in common garden.Pakistan ournal of Biological Sciences 7(2) p. 203-208. [2]. Adex., 2010. CBI Market Information Database, "Promising EU export markets for Quinoa", Publication data: 13.04.2012 - www.cbi.eu. [3]. Almansouri M., Kinet J.M., Lutts S., 2001. Effect of salt and osmotic stress on germination in durum wheat (Triticum durum Desf.). Plant Soil., 231, 245-256. [4]. Anaïs Vassas, Manuela Vieira Pak., 2010. La production de Quinoa dans l'altiplano sud de la Bolivie: entre crises et innovations. Emilie COUDEL, Hubert DEVAUTOUR, Christophe-Toussaint SOULARD, Bernard HUBERT. ISDA 2010, Jun 2010, Montpellier, France. Cirad-Inra-SupAgro, 12 p. [5]. Andrea Roscher-Muruchi., 2013. l‟Année internationale du Quinoa.Horizons et debats « archives ». N°34, 11 novembre 2013. [6].Anonyme (2006) Conférence électronique sur la salinisation: Extension de la salinisation et stratégies de prévention et réhabilitation. Organisée et coordonnée par: IPTRID du 6 février au 6 Mars 2006, 20 p. [7]. Anzala F.J,2006-contrôle de la vitesse de germination chez la maïs(zea mays) :étude de la voie de biosynthèse des acides amines issus de l‟aspartate et recherche de QTLs, thèse de doctorat ;université d‟Angers ;148p [8]. Ayala G., Ortega L. & Moron C., 2001. Quinua (Chenopodium Quinoa Willd.): Valor nutritivo y usos de la quinua. In: Izquierdo Fernández J.I. et al., eds. Cultivos Andinos. [CD-ROM]. Santiago: FAO. [9]. Bailey RW., Barker SA and Bourne EJ., 1957 – Significance of oligosaccharide intermediates in dextrin synthesis. Nature; 179: 179-310. [10]. Bajji M., Kinet J-M. and Lutts. 2002. Osmotic and ionic effects of NaCl on germination, early seedling growth, and ion content of Atriplex halimus (Chenopodiaceae) Canadian Journal of Botany, Volume 80 N° 3 : pp. 297-304. [11]. Belhabib, 2005. Les culures alternatives : Quinoa, Amarante et épeautre. Bulletin du PNTTA n° 133, Octobre 2005. [12]. Belhassen E.;This D et Monneveux P., 1995-L‟adaptation génétique face aux contraintes de la sécheresse. Cahiers d‟agriculture 4 : p. 251- 261 [13]. Belkheiri O., 2009. Adaptabilité des espèces du genre Atriplex aux conditions de salinité et d‟aridité. Thèse de doctorat, Université di Sassari (Espagne), 90p. [14]. Belkhodja M., 1996. Action de la salinité sur le comportement physiologique, métabolique chez la féve (Vicia faba L.). Thése doct. Es Science Naturelles, Univ Oran, 255p. [15]. Belkhodja M et Bidai Y., 2004. Réponse des graines d’Atriplex halimus L. à la salinité au stade de la germination. Sécheresse, 4(15) :331-334. [16]. Benaceur. M, Rahmoun.C, Sdiri.H, Medahi. M. et Selmi. M., 2001. Effet du stress salin sur la germination, la croissance et la production en grains de quelques variétés maghrébines de blé. Revue Sécheresse , Volume 12, N°03, pp. 167-174 [17]. Benkhetou A., 2003 – Contribution à l‟étude de la mise en culture des zones steppiques dans le cadre de l‟accession à la propriété foncière agricole et son impact sur l‟écosystème – cas de Rechaiga, Tiaret-. Thèse de Magister, Univ. de Tiaret, Algérie, p 25, 28. [18]. Ben Miled D, Boussaid M, Cherif A.,1986. Tolérance au sel d‟espèces annuelles du genre Medicago au cours de la germination. Colloque sur les végétaux en milieu aride. Tunisie : Djerba. [19]. Bewley J. D., 1997 – Seed germination and plant dormancy. Plant Cell 9, 10551066. [20]. Bhargava A., Shukla S. & Ohri D., 2006. Chenopodium Quinoa: an Indian perspective. Ind. Crops Prod., 23, 73-87 [21].Bois J.F. et al., 2006. Response of some Andean cultivars of Quinoa (Chenopodium Quinoa Willd.) to temperature: effects on germination, phenology, growth and freezing. Eur. J. Agron., 25, 299-308. [22].Bouaouina, S., Zid, E. et Hajji, M. (2000) Tolérance à la salinité, transports ioniques et fluorescence chlorophyllienne chez le blé dur (Triticum turgidum L.) .CIHEAM – Options Méditerranéennes. pp. 239-2. [23].Bouchoukh I., 2010. Comportement écophysiologique de deux Chénopodiacées des genres Atriplex et Spinacia soumises au stress salin. Mémoire de Magistère en Biologie végétale, Université Mentouri –Constantine. 112p + annexes. [24].Boulghalagh, J., Berrichi, A., El Halouani, H. et Boukroute, A. (2006) Effet des stress salin et hydrique sur la germination des graines du jojoba (Simmondsia chinensis [link] schneider). Recueil des résumés. Le Premier Congrès National sur l‟Amélioration de Production Agricole, Settat, Maroc, p. 24. [25].Bove J.; Jullien M. and Grappin P., 2001 – Functional genomics in the study of seed germination. Genome Biology, 3: 1002. 1-1002. 5. [26]. Brack Egg A., 2003. Perú: diez mil años de domesticación. Lima: Editorial Bruño. [27].Bruno M.C., 2006. A morphological approach to documenting the domestication of Chenopodium in the Andes. In: Zeder M.A., Emshwiller E., Smith B.D. & Bradley D.G., eds. Documenting domestication: new archaeological and genetic paradigms. Berkeley, USA: University of California Press, 32-45. [28].Cabido M., Ateca N., Astegiano M. & Antón A., 1997. Distribution of C3 and C4 grasses along an altitudinal gradient in Central Argentina. J. Biogeogr., 24, 197204. [29].Caceres E., 1993. Cultivos Andinos. Oruro, Bolivia: Impreso Felipe Moya. [30].Cardenas, M. & Hawkes, J.G. 1948. Número de cromosomas de algunas plantas nativas cultivadas por los indios en los Andes. Revista Agrícola, 4: 30[31].Castillo C., Grégory M. et Winkel T., 2008. La Quinoa en Bolivie : une culture ancestrale devenue culture de rente “ bio-équitable ”. Biotechnol. Agron. Soc. Environ., 12 (4): 421-435. [32].Chamayou H et Legros, JP, 1989. Les bases chimiques, physiques et minéralogiques de la science du sol, Ed presse universitaires; Paris, pp 223- 225. [33].Choukr allah R, Hamdy A, Lahmer FZ., 1997. Germination d‟Atriplex halimusdans des milieux salés, International Conference on Water management, salinity and pollution control towards sustainable irrigation in the Mediterranean region, IAM Valenzano Bari Italy 22-26: 209 p. [34].Chunyang L and Kaiyun W., 2003 – Differences in drought responses of three contrasting Eucalyptus microtheca F. Muell. populations. Uni of Helsinki. Finland. Forest Ecology and Management., 179, p 377- 385. [35].Côme D., 1970. Les obstacles de la germination. Ed. Masson ; 162p. [36].Côme D.,1982 - Germination. In Croissance et développement. Physiologie Végétale II, P. Mazliak (ed.), Hermann, Paris, 129-225. [37].Daoud Y., 1993. Contribution à l'étude des sols des plaines du Chéliff. Le phénomène de salinisation, conséquences sur les propriétés physiques des sols des sols argileux. Thèse Doctorat d'état, INA Alger, 233 pages. [38].DEMIR I.; MAVI K.; OZCOBAN M. and OKCU G., 2003 - Effect of salt stress on germination and seedling growth in serially harvested aubergine (Solanum melongena L.) seeds during development. Israel Journal of Plant Sciences, 51: 125-131. [39].Derkaoui K., 2011.Les réponses morphologiques, physiologiques et anatomiques des racines de la tomate (solanum lycopersicum L) vis-à-vis du stress salin. Diplôme de Magister, université d‟Oran, p4. [40].Diédhiou G.J., 2006. Mechanisms of salts tolerance: Sodium, Chloride, and potassium Homeotasis in two rice lines with diferent tolerance to salanity stress. Dr. Rer.nat theses. Faculté de biologie. Université de Bielefeld, Allman, 190p. DOGAR M A., 1980. Méthodes d'analyses des sols salés alcalins, Polycopie, I.N.E.S.A., Batna, 33p [41].Douaoui A., Gascuel-Odoux. C et Walter C., 2004. Infiltrabilité et érodibilité de sols salinisés de la plaine du Bas Chéliff (Algérie) Mesures au laboratoire sous simulation de pluie. Étude et Gestion des Sols, Volume 11, N°4, pp. 379- 392 [42].Dubois M., Gillet K.A. (1965): Dosage des sucres totaux à l‟ortho–toluidine, J. Agr. Food Chem. 13 : 137. [43].Duchaufour P.H., 1983 – Pédologie. Pédogenèse et classification T1.Ed Masson, p 467-483. [44].El Midaoui M, Benbella M, Aït Houssa A, Ibriz M et Talouizte A., 2007. Contribution à l‟étude de quelques mécanismes d‟adaptation à la salinité chez le tournesol cultivé (Helianthus annuus L.) Revue HTE 136 : 29-34. [45].Epstein E., Norlyn J.D., Ruch D.W., Kingsbury R.W., Kelley D.B., Cunningham G.A. And Wrona A.F., 1980- saline culture of corps: A genetic approach. Science 210: 399-404. [46].Espindola G., 1986.Respuestas fisiológicas, morfológicas y agronómicas du Quinoa al déficit hídrico. Thesis: Colegio de Post-graduados, Universitad Chapingo (Mexico). [47].Espindola G., 1992. Proyecto de fortalecimiento y modernización. IBTA-BM. In: Informe Anual 1992. Programa Quinoa. La Paz: Estación Experimental de Patacamaya, 37-42. [48].FAO., 2013. Bioversity International, Descripteurs pour le Quinoa et ses espèces sauvages apparentées. Rome, Italie. [49].Gandarillas, H. & Luizaga, J. 1967. Número de cromosomás de Chenopodium Quinoa Willd. En radículas y raicillas. Turrialba,17(3): 275-279. [50].Gandarillas H., 1968. Caracteres botánicos más importantes para la clasificación de la quinua. In: Universidad Nacional Técnica del Altiplano, ed. Anales de la Primera convención de Quenopodiáceas Quinoa – cañahua. Puno, Perú: Universidad Nacional Técnica del Altiplano, 41-49. [51].Gandarillas H., 1979. La quinua (Chenopodium Quinoa Willd.): Botánica. In: Tapia M.E. et al., eds. La Quinua y la Kañiwa cultivos andinos. Bogota: CIID-IICA, 20-44. [52].Gandarillas H., 1979. La quinua (Chenopodium Quinoa Willd.): Genética y origen. In: Tapia M.E. et al., eds. La Quinua y la Kañiwa cultivos andinos. Bogota: CIID-IICA, 45-64. [53].Gandarillas, H. 1986. Estudio Anatómico de los Organos de la quinua. Estudio de Caracteres Correlacionados y sus Efectos sobre el Rendimiento. Hibridaciones entre Especies de la Subsección Cellulata del Genero Chenopodium. La Paz. 48 p. [54].Geerts S., 2008. Deficit irrigation strategies via crop water productivity modeling: Field research of Quinoa in the Bolivian Altiplano. Faculteit Bioingenieurs wetenschappen,Katholieke Universiteit Leuven, Leuven. Doctoraatsproefschrift. [55].Geerts Set Raes D., 2009. « Deficit irrigation as an on-farm strategy to maximize crop water productivity in dry areas », Agric. Water Manage, vol. 96, p. 1275–84. [56].Genoux C, Putzola F et Maurin G., 2000. La Lagune méditerranéenne : Les plantes halophiles. TPE. 1 ère S-2, 22p. [57].Ghodbène, N. (2006) Etude comparative de quelques paramètres morphophysio agronomiques chez quelques variétés d‟orge (Hordeum vulgare L.) cultivées en condition de salinité. Mémoire d‟ingéniorat en biologie végétale. 109p. [58].Greenway H et Munns R., 1980. Mechanism of salt tolerance in nonhalophytes. Annual Review of Plant Physiology, (31):149-190. [59].Groome M.C., Axler S. & Gfford D.J., 1991, Hydrolysis of lipid and protein reserves in lobolly pine seeds in relation to protein electrophoretic patterns following imbibition. Physiol. Plant, 83, 99-106. Hajlaoui H, Denden M, Bouslama M. 2007. Étude de la variabilité intraspécifique de tolérance au stress salin du pois chiche (Cicer arietinum L.) au stade germination. Tropicultura, 25(3): 168-173. [60].Halitim A., 1985. Contribution à l'étude des sols des zones arides (Hautes Plaines Steppiques d'Algérie). Morphologie, distribution et rôle des sels dans la genèse et le comportement des sols. Thèse Doc. d'Etat, Univ. Rennes, 383 p. [61].Hare P.D., Cress W.A and Van Stadem J., 1998 - Dissecting the roles of osmolyte accumulation during stress. Plant cell and Environment; 21, 535-553. [62].Heller R., Esnault R et Lance C., 2004.Physiologie végétale II (développement).Ed Dunod, Paris, France. p.64,240. [63].HENIN S., 1976 - Définition de la sécheresse, politique d‟utilisation de l‟eau. Fourrage 67,p13-25. [64].Hopkins W.G., 2003. Physiologie végétale. 2éme édition. De Boeck, Bruscelles:476p. [65].Indge B.,2007. La Biologie de A à Z. Ed Dunod, Paris. France. p.123,130. [66].Izquierdo Fernández J.I. et al., 2001. Cultivos andinos, Version 1.0. [CDROM]. Santiago: FAO, http://www.rlc.fao/org/es/agricultura/pubs.html. [67].Jason A., 2009. Olivier Hubert, avec la collaboration des jardiniers des serres d‟agronomie tropicale du Grand Blottereau. JABNOUNE M., 2008- adaptation des plantes au stress Salin : caractérisation de la transporteur de sodium et potassium de la famille HKT chez le riz .Thèse doctorat, univ Montpellier II. [68].KAYA M. D.; OKÇU G.; ATAK M.; ÇIKILI Y. and KOLSARICI Ö., 2006 – Seed treatments to overcome salt and drought stress during germination in sunflower (Helianthus annuus L.)European Journal of Agronomy Volume 24, Issue 4, Pages 291-295. [69].KHAJEH-HOSSEINI; Powell M. A.A. and Bingham I.J. - 2003. The interaction between salinity stress and seed vigour during germination of soybean seeds. Seed Sci. & Technol, 31: 715-725. [70].Kotowski F., 1926. Temperature Relations to Germination of Vegetable Seeds,”American Society of Horticulture Science Proceedings, 23, 176–184. [71].Kubien D.S. & Sage R.F., 2004. Low-temperature photosynthetic performance of a C4 grass and a co-occurring C3 grass native to high latitudes. Plant Cell Environ., 27, 907-916. [72].Lamaze, T., Tousch, D., Sarda, X., Grignon, C., Depigny-This, D., Monneveux, P. et Belhassen, E. (1994) Résistance des plantes à la sécheresse : mécanismes physiologiques. Le sélectionneur Français. Vol. 45, pp. 75. [73]. Langridge P.; Paltridge N. and Fincher G., 2006- Functionnal genomics of abiotic stress tolerance in cereals. Briefings in Functionnal genomics and Proteomics. 4(4):343-354. [74].Lebonvallet S., 2008. Implantation du Quinoa et simulation de sa culture sur l‟Altiplano bolivien. Thèse de doctorat, Agro Paris Tech, France. [75].Lemzeri H., 2006. Réponses écophysiologiques de trois espèces forestières du genre Acacia, Eucalyptus et Schinus (A. cyanophylla, E. gomphocephala et S. mölle) soumises à un stress salin. Mémoire de magistère, Université de Mentouri Constantine,180 p + annexe. [76].Levigneron A, Lopez F, Varisuyt G, Berthomien P et Casse-Delbar T., 1995. Les plantes face au stress salin. Cahier d’agriculture. (4): 263-273. [77].Luttge U, Kluge M et Bauer G., 2002. Botanique. 3éme édition, Tec et Doc Lavoisier, Paris: 439- 450. [78].Maillard J. (2001) Le point sur l‟Irrigation et la salinité des sols en zone aride : Risques et Recommandations. Handicap International. Novembre 2001. 35p. [79].Marlet, S. (2005) Gestion de l‟eau et salinisation des sols dans les systèmes irrigués Synthèse de l‟atelier du PCSI sur : Vers une maîtrise des impacts environnementaux de l‟irrigation. CIRAD/AMIS, Montpellier, France, n°40, pp. 1223. [80].Marouf A. et Reynaud J., 2007- La botanique de A à Z. 1662 définitions. Ed Dunod :P.286. [81].Mermoud, A. (2006) Cours de physique du sol : Maîtrise de la salinité des sols. Ecole polytechnique fédérale de Lausanne, 23 p. [82].Misra N. and Dwivedi U.N., 2004. Genotypic difference in salinity tolerance of green gram cultivars. Plant Science, 166: 1135-1142. [83].Monneveux P., This D.,1995. Intégration des approches physique génétiques et moléculaires pour l‟amélioration de la tolérance à la sécheresse chez les céréales. In :quels avenir pour l‟amélioration des plantes ?Dubois j. Demarly.Ed.Aupelf UREF.pp164-169. [84].Mujica A. & Jacobsen S.E., 1999. Resistencia de la quinua a la sequía y otros factores abióticos adversos y su mejoramiento. In: I Curso Internacional sobre Fisiología de la Resistencia a Sequía en Quinua (Chenopodium Quinoa Willd.). Lima: CIP-DANIDA, 25-38. [85].Munns R., 1993. Physiological processes limiting plant growth in saline soils: some dogmas and hypotheses. Plant Cell Environ. (16): 15-24.Mint Mohamed K.M., 2006 – Effet de la salinité sur la proline et les glucides chez la fève (Vicia faba L.). Thèse de Magister, Université d‟Oran Es- Senia, Algérie, p17. [86].Noiraud N., Delrot S. Et Lemoine R., 2000 - The sucrose transporter of Celery. Identification and expression during salt stress 1. Plant physiol, vol. 122, pp 1447-1456. [87].OKCU G.; KAYA M. D. and ATAK M., 2005 - Effects of salt and drought stresses on germination and seedling growth of pea (Pisum sativum L.). Turk J Agric For.29(4):237–242. [88].Ottow E, Brinker M, Fritz.E, Teichmann.M. and Polle.W., 2005. Populus euphratica Displays Apoplastic SodiumAccumulation, Osmotic Adjustment by Decreases Ca++ and Soluble Carbohydrates, and Develops Leaf Succulence under Salt Stress. Plant Physiology, Volume 139, pp. 1762–1772. [89].Ouerghi Z, Zid E, Hajji M Et Soltani A., 1998. Comportement physiologique du blé dur (Triticum durum L.) en milieu salé. CIHEAM - Options Méditerranéennes : 309- 31. [90].Prat R.,2007 Expérimentation en biologie et physiologie végétale. Ed Hermann et Quae. Paris. France. P.161 [91].Prego I., Maldonado S. & Otegui M., 1998. Seed structure and localization of reserves in Chenopodium Quinoa. Ann. Bot., 82, 481-488. [92].Raven., Johnson., Losos., Signer., 2007. Biologie.7e ed Boeck et Larcier.763p. [93].Rasanen L.A., 2002. Biotic and abiotic factors infl uencing the development of N2-fi xing symbioses between rhizobia and the woody legumes Acacia and Prosopis. Academic dissertation in microbiology. Helsinki. Thesis.80p. [94].Rea J., 1969. Morfología de la quinua. In: Observaciones sobre la biología floral y estudios de saponinas en Chenopodium Quinoa Willd. Serie Técnica n°3. La Paz: Ministerio d‟Agricultura, Departamento d‟Experimentación, 15-17. [95].Renard J. L. and Quillec G., 1975. L‟Helminthosporiose du cocotier. Etudes préliminaires. Oléagineux 30(5) : 209-213. [96].Rojas et al, 2013. Bioversity International 18. Boulghalagh J., Berrichi A., El Halouani H., Kouddane NE., 2008. Impact de la salinité sur la germination et la croissance in vitro du Jojoba (Simmondsia chinensis [Link] Schneider). Cahiers UAE, (2-3), 25-30.[97].Rush D.W et Epstein E., 1981. Breeding and selection for salttolerance by incorporation of wild germplasm into a domestic tomato. J. Amer. Soc. Hort. Sci. (106): 699-704. [98].S. Padulosi, 2013. La FAO, l'Organisation des Nations-Unies pour l'agriculture et l'alimentation, a décrété 2013. PRADO, C. P. A., M. UETANABARO, AND F. S. LoPES. 2000. Reproductive strategies of Leptodactylus chaqchaquensis and L. podicipinus in the Pantanal, Brazil. J. Herpetol. 34:135-139. [99].Saidi D, Le Bissonnais Y, Duval O, Daoud Y et Haitim. A., 2004. Effet du sodium échangeable et de la concentration saline sur les propriétés physiques des sols de la plaine du Cheliff (Algérie); Étude et Gestion des Sols, Volume 11, N°2, pp 81-92. [100].Saritha V., Kuriakose Prasad MNV., 2007. Cadmium stress affects seed germination and seedling growth in Sorghum bicolor (L.) Moench by changing the activities of hydrolyzing enzymes. Plant growth regulation, 54: 143-156. [101].Sentenac H et BERTHOMIEU P., 2003. Découverte d‟un nouveau mécanisme de tolérance des plantes au sel. UMR Biochimie et physiologie moléculaire des plantes (Unité mixte Ecole nationale supérieure agronomique de Montpellier /Université/CNRS/ INRA) Service Presse INRA. 34p. [102].Suarez D.L., 2001. Sodic soil reclamation : modelling and field study. Australian journal of Soil Res. Volume 39, pp. 1225-1246. [103].Szabolcs I., 1994. Soils and salinization. In: Pessarakli, M. (Ed.), Handbook of Plant and Crop Stress. Marcel Dekker, New York: 3-11. [104].Tahri E.H, Belabed A.M. et Sadki K., 1998. Effet d‟un stress osmotique sur l‟accumulation de proline, de chlorophylle et des ARNm codant pour la glutamine synthétase chez trois variétés de blé dur (Triticum durum). Université Mohamed Premier. Maroc. Bulletin de l'Institut Scientifique, Rabat, 2 : 81-87. [105].Tapia M.E. et al., 1979. La quinua y la kañiwa: cultivos andinos. Serie Libros y Materiales Educativos 49. Bogota: IICA, CIID. [106].U.S.Salinity Laboratory Staff, 1954. Diagnosis and improvement of saline and alkali soils, U.S.D.A. Handbook n° 60, 160 pages. Viégas, R.A.; Silveira, J.A.G. Ammonia assimilation and proline accumulation in young cashew plants during long term exposure to NaCl-salinity. Brazilian Journal of Plant Physiology, Campinas, v.11, p.153-159, 1999. [107].Wang W.; Vinocur B. and Altman A., 2003- Plant response to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance.Planta 218:1-14. [108].Wilson C, Read JJ, Abo-Kassem E (2002).Effect of mixed-salt salinity on growth and ion of a Quinoa and a wheat variety. J Plant Nutr 25:2689–2704 [109].Zid E., 1982. Relations hydriques dans la feuille de Citrus aurantium : effets de l‟âge et de la salinité. Rev. FAC. Sc. Tunis, 2 : 195-205. [110].Zid E et Grignon C., 1991. Les tests de sélection précoce pour la résistance des plantes aux stress. Cas des stress salin et hydrique. L‟amélioration des plantes pour l‟adaptation aux milieux arides. Ed. John Libbey. Eurotext, Paris : 91-108. [111].Zina Caceres, Aurélie Carimentrand et John Wilkinson., 2007. « Fair Trade and Quinoa from the Southern Bolivian Altiplano », in Raynolds L., Murray D., Wilkinson J. (Eds). Fair Trade: The Challenges of Transforming Globalization. Londres et New York, Routledge. [112].Zhu J.K., 2001-Plant salt tolerance.Trends in Plant Sci. 6: 66-71. [113].CHEHAT foued Directeur de l'INRAA, « Durabilis » Emission TV diffusée le 04/2016, ENTV Wikipedia site internet : www.wikipedia.com ANNEXES Liste des annexes Annexe 1: mécanismes de résistance du Quinoa à la sécheresse (Mujica et al., 2001). Types de mécanisme Caractéristiques Réduction de taille des plantes entières ou des feuilles Morphologiques Réduction de la surface foliaire par perte de feuilles Plasticité du développement et de la croissance Repli des feuilles sur la panicule Plus grande résistance stomatique Récupération rapide des capacités photosynthétiques après une période de sécheresse Faible taux de transpiration Physiologiques Concentration sur les organes jeunes de cristaux d‟oxalate de calcium réfléchissant la radiation solaire et favorisant la rétention d‟humidité atmosphérique Plus grande vitesse d‟absorption d‟eau Plus grande tolérance au sel Anatomiques Plus grande développement radiculaire (en densité et profondeur) Réduction du nombre et de la taille des stomates Développement radiculaire plus rapide dans les premières étapes de croissance Phénologiques Asynchronisme dans la phase de floraison Raccourcissement de la phase de floraison Développement phénologique plus rapide Résistance ontogénique (endurcissement par les stress antérieurs Présence d‟oxalate de calcium dans les feuilles, tiges et panicule Thermostabilité des cellules Biochimiques Plus grande production d‟acide abcissique (ABA) Translocation des ions Ket Ca des cellules stomatiques durant les période de sècheresse Annexe 2: Mécanismes de résistance du Quinoa au froid (Mujica et al., 2001). Types de mécanismes Caractérisation Chute de feuilles Morphologiques Réduction de la taille des feuilles Réduction de la taille de la plante Mouvements des feuilles et de la tige Physiologiques Osmorégulation de la formation de glace dans l‟apoplaste et résistance au sous refroidissement Anatomiques Stomates moins nombreux et plus grande Phases phénologiques plus tolérantes au froid, Phénologiques prolongation ou raccourcissement des phases phénologiques Accumulation de métabolite (sucre solubles, Biochimiques proline et protéines) Annexe 3: composition chimique des principales céréales, pour 100g de produit sec (Belhabib, 2005). Quinoa Riz Blé Orge Protéines (g) 13.8 7.4 11.5 10.6 Glucides (g) 59.7 74.6 59.4 57.7 Lipides (g) 5.0 2.2 2.0 2.1 Minéraux (g) 3.4 1.2 1.8 2.2 Calcium (mg) 85 39 41 26 Magnésium (mg) 204 119 90 57 Fer (mg) 4.2 2.0 3.3 2.0 Annexe 4: Teneurs en Acides aminés de quelques produits (Belhabib, 2005). Quinoa Blé Soja Lait Réf (FAO) écrémé Isoleucine 0.4 3.8 4.7 5.6 4.0 Leucine 6.8 6.6 7.0 9.8 7.0 Lysine 5.1 2.5 6.3 8.2 5.5 Phénylalanine 4.5 4.6 4.8 - - Tyrosine 3.8 3.0 3.6 5.0 - Cystine 2.4 2.2 1.4 0.9 - Méthionine 2.2 1.7 1.4 2.6 - Thréonine 3.7 2.9 3.9 4.6 4.0 Tryptophane 1.2 1.3 1.2 1.3 1.0 Valine 4.8 4.7 4.9 6.9 5.0 Annexe 5: teneurs en minéraux des 3 principales céréales, g ou mg/100de produit sec (Belhabib, 2005). Ca P Mg K Na Fe Cu Mn Zn Quinoa 0.19 0.47 0.26 0.87 115 205 67 128 50 Maïs 0.05 0.36 0.14 0.39 900 21 - - - Blé 0.05 0.36 0.16 0.52 900 50 7 - 14 Annexe 6 : solubilité décroissante des principaux sels solubles dans l'eau Type de sels Composition Solubilité(g/100g de solution Chlorure de calcium Cacl2 400 Chlorure de magnésium Mgcl2 6H2O 130 Carbonate de potassium K2CO3 , 2H2O 112 Sulfate de magnésium MgSO4 ,2H2O 41,5 Chlorure de sodium Nacl 35,7 Chlorure de potassium Kcl 34,2 Carbonate de sodium Na2CO3 13 Sulfate de sodium Na3SO4 13 Sulfate de potasium K2 SO4 10 Bicarbonate de sodium NaHCO3 8 Sulfate de calcium CaSO4 2H2O 0,199 Carbonate de calcium CaCO3 0,017 Annexe 7 : Tableaux qui résument l‟ensemble des analyses statistiques Chl A Chl B Chl A+B Sucre Long Racines Taux Germination Precocité Germination Effet Variétal F P 424,19 0,00 205,4 0,00 169,7 0,00 106067 0,00 169,72 0,000000 375,1 0,00 Effet Salin F 1360,15 2339,5 3261,0 33318 281,98 3844,5 Interaction V × S P F P 0,00 85,65 0,00 0,00 390,8 0,00 0,00 336,8 0,00 0,00 50857 0,00 0,000000 4,01 0,000675 0,00 35,1 0,00 822,90 12773,12 0,00 0,076 68,97 0,00 Correlations Marked correlations are significant at p < ,05000 N=360 (Casewise deletion of missing data) Variable Con Chl a Chl b Chl a+b Sucres solubles long Racines taux germination precocité germination Con Chl a Chl b Chl a+b Sucres solubles long Racine s 1,0000 -,8315 -,8154 p= --- 1,0000 ,7383 -,8827 -,1850 -,7336 -,9437 -,9618 p=0,00 p=0,00 p=0,00 p=,000 p=0,00 p=0,00 p=0,00 ,4002 ,8274 ,8727 p= --- ,9047 p=0,00 p=0,00 p=,000 p=0,00 p=0,00 p=0,00 1,0000 ,9392 ,1478 ,6200 ,7687 ,8272 p= --- p=0,00 p=,005 p=0,00 p=0,00 p=0,00 1,0000 ,2870 ,7705 ,8773 ,9266 p= --- p=,000 p=0,00 p=0,00 p=0,00 1,0000 ,4315 ,3536 ,2496 p= --- p=,000 p=,000 p=,000 1,0000 ,8074 ,8028 p= --- p=0,00 p=0,00 1,0000 ,9523 p= --- p=0,00 ,9250 taux germ precocit é germ 1,0000 p= --- Étude des effets du stress salin sur la germination du Quinoa (Chenopodium Quinoa). Résumé : La salinité constitue un obstacle majeur pour la croissance des végétaux, la céréaliculture se trouve confrontée à ce problème en Algérie. L‟utilisation des variétés résistantes à la salinité est devenue impérative et la germination sous contraintes salines pourrait constituer un test rapide à cet égard. Dans ce contexte, la présente étude a pour objectif l‟évaluation de la tolérance de trois variétés du Quinoa (Chucara, Sajama, Sandoval) au stress salin à des concentrations croissantes (50~100~150 meq.l-1) au stade germinatif, l‟étude a porté sur les réponses physiologiques, biochimiques et morphologiques. Les résultats obtenus montrent que le stress salin a entraîné une réduction du taux final de germination, une diminution de la teneur en chlorophylle a, b et totale pour l‟ensemble des variétés, de même, un prolongement du temps moyen de germination et une accumulation des sucres solubles sont enregistrés. À la lumière de ces résultats, nous avons révélé une supériorité et adaptation de la variété Sajama par rapport aux autres variétés Chucara et Sandoval pour tous les paramètres du potentiel germinatif étudiés. Mots-clés: Quinoa, Germination, Chlorophylle, Stress Salin, Tolérance, Sucre Soluble Study the effects of salt stress on the germination of Quinoa (Chenopodium Quinoa ) . Abstract Salinity is a major obstacle to the growth of plants, grain farming is faced with this problem in Algeria. Use varieties resistant to salinity has become imperative and germination under salt stress could be a quick test in this regard. In this context, this study aims to evaluate the tolerance of three varieties of Quinoa (Chucara, Sajama, Sandoval) to salt stress at increasing concentrations (50 ~ 100 ~ 150 meq.l -1) in germinal stage the study examined the physiological responses, biochemical and morphological. The results obtained show that the saline stress resulted in a reduction of the final rate of germination, a decrease in chlorophyll a, b and total for the whole of the varieties, similarly, an extension of the average time of germination and an accumulation of soluble sugars are registered. In the light of these results, we revealed a superiority and tolerance of the variety Sajama compared to other varieties Chucara and Sandoval for all parameters of potential studied germination. Keywords: Quinoa, Germination, Chlorophyll, salt stress,adaptation, soluble sugars تأثيزاالجهاد الملحي على عملية إنتاش بذور الكينىا دراسة ٍ ملخص وتانرانٍ عهً اإلَراج انضساعٍ يًا خعهها إحذي، ذعرثش انًهىحح يٍ أهى انًشاكم انطثُعُح انرٍ ذؤثش عهً َىعُح انرشتح .أونىَاخ انثحث انعهًٍ انزٌ َهذف إنً فهى أفعم نهظاهشج ورنك تغُح انىصىل إنً إخرُاسخُذ نهُثاذاخ األكثش ذحًال نهًهىحح انرٍ وظعد نرًُى داخم،) ساَذوفال،سدايا،فٍ هزا انسُاق أخشَد انذساسح عهً ثالثح عُُاخ يٍ تزوس انكُُىا (شُكاسا أٍَ قًُا تًقاسَح يذي ذداوب انعُُاخ.) يُهٍ يكافئ005-055-05( يحانُم يانحح يٍ كهىسَذ انصىدَىو ترشاكُض يرصاعذج .إظافح إنً دساسح تعط انرحانُم انثُىكًُُائُح، انثالثح يٍ خالل سهسهح يٍ انقُاساخ انًىسفىنىخُح وانفسُىنىخُح وكزنك اَخفاض فٍ غىل اندزوس يع، انُرائح انًحصم عهُها ذظهش أٌ اإلخهاد انًهحٍ َسثة اَخفاظا فٍ يعذل اإلَراش .َقصاٌ فٍ ذشكُض انُخعىس وصَادج فٍ ذدًع انسكشَاخ انزائثح ذشُش َرائح دساسرُا أَه تىخىد اإلخهاد انًهحٍ ذسردُة أصُاف انكُُىا تذسخاخ يخرهفح اٍَ َُفشد انصُف سدايا ترششحه .كصُف اكثش يقاويح نهًهىحح اعرًادا عهً يخرهف قُاساخ االَراش انًسدهح . انسكشَاخ انزائثح، انًقاويح،ٍ اإلخهاد انًهح، انُخعىس، اإلَراش، كُُىا:الكلمات المفتاحية