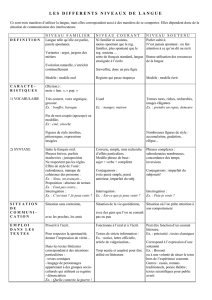
. La N-Glycosylation
La plupart des protéines synthétisées dans le réticulum endoplasmique
granuleux (REG) sont glycosylées. Il s’agit essentiellement de protéines
sécrétées et des protéines transmembranaires. A l’inverse peu de protéines
cytosoliques sont glycosylées.
La N glycosylation démarre à la face cytosolique du REG où un lipide porteur,
le dolichol, est phosphorylé. Le premier sucre (GlcNAc) s'y fixe par une
liaison pyrophosphate. Les sucres suivants (GlcNAc et 5 Mannoses) sont
ajoutés séquentiellement. Le dolichol glycosylé est «flippé» vers la lumière du
REG où la glycosylation se poursuit par l’ajout de 4 Mannoses et de 3
Glucoses. Ces 7 oses ont été transportés préalablement vers la lumière du REG
par du dolichol «flippé».
On assiste alors à un transfert en bloc de cet oligosaccharide sur la chaine
latérale d’asparagines [Asn- N] cibles. On parle de N-glycosylation puisque
c’est sur un atome d’azote de l’Asn que l’oligosaccharide est fixé.
La diversité des structures oligosaccharidiques résulte de modifications
ultérieures de l’oligosaccharide précurseur dans le REG puis dans le golgi par
hydrolyse de certains oses (souvent les trois glucoses et un mannose sont
décrochés) et addition d’autres sucres (Galactose, Acide sialique,...).
Il existe un autre type de glycosylation, la O-glycosylation, qui se produit sur des
résidus sérine (Ser-S) ou thréonine (Thr-T) dont le groupement résiduel présente un
atome d'oxygène. Elle a lieu dans le golgi. Ce type de glycosylation concerne tout
particulièrement les mucines et les protéoglycanes.
1
/
1
100%