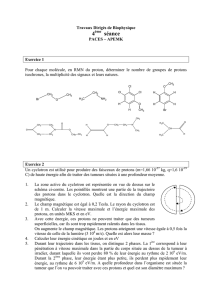
Terminale S - Retour Sommaire - Informations
(Pensez à utiliser la commande "Précédente" du navigateur et la touche F11 du clavier)
Leçon n° 7 : ANALYSE SPECTRALE
Cette leçon comporte quatre paragraphes qui parlent de spectroscopie.
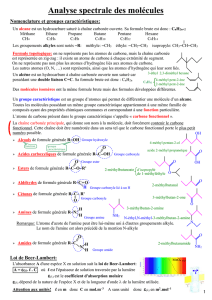
1- GROUPES CARACTERISTIQUES ET FONCTIONS
En classe de première nous avons classés plusieurs molécules organiques en familles : alcanes, alcools, aldéhydes, cétones, acides carboxyliques. Nous y ajouterons en terminale les familles suivantes :
alcènes, esters, amines, amides.
Chaque famille est caractérisée par un groupe d'atomes caractéristique. Rassemblons les principales fonctions :
(1)
Nomenclature :
Alcools : La chaîne principale est la chaîne d’atomes de carbones la plus longue contenant le carbone fonctionnel. On numérote cette chaîne de façon que le carbone fonctionnel porte le plus petit
numéro.
Le nom de l’alcool dérive de celui de l’alcane correspondant suivi du numéro du carbone fonctionnel et suivi du suffixe « ol ». (2)
Exemple :
Dans une formule topologique on ne représente pas les atomes de carbone C et les atomes d'hydrogène H liés à des atomes C. La formule
brute de cet alcool est C6H14O.
Aldéhydes : La chaîne principale est la chaîne la plus longue contenant le carbone fonctionnel qui porte le numéro 1. Le nom de l’aldéhyde est celui de l’alcane correspondant suivi du suffixe « al ».
(3)
Exemple : 3-éthylhexanal.
Cétones : La chaîne principale est la chaîne la plus longue contenant le carbone fonctionnel affecté du numéro le plus petit possible. Le nom de la cétone dérive de celui de l’alcane correspondant suivi
du numéro du carbone fonctionnel puis du suffixe « one ». (4)
Exemples :
La formule brute est C5H10O.
Acides carboxyliques : La chaîne principale est la chaîne la plus longue contenant le carbone fonctionnel. On numérote cette chaîne de façon que le carbone fonctionnel, en bout de chaîne, porte le
numéro 1. Le nom de l’acide est celui de l’alcane correspondant précédé de « acide » et suivi du suffixe « oïque ». (5)
Série cyclique : On fait suivre le mot acide du nom de l'hydrocarbure auquel on ajoute le suffixe carboxylique. L'atome de carbone du carboxyle ne fait pas partie de la chaîne principale.
Exemples :
Acide éthanoïque
CH3 - COOH
Formule brute : C2H4O2
Formule brute : C6H12O2(Ici l'atome de carbone du groupe carboxyle COOH n'est pas inclus dans la chaîne principale de l'hydrocarbure correspondant.
Le nom ne se termine pas par le suffixe « oïque ».
Esters : Le nom comporte deux termes :
le premier avec la terminaison oate désigne la chaîne principale provenant de l’acide (numérotée, si nécessaire, à partir de l’atome de carbone lié aux deux atomes d'oxygène).
le second, avec la terminaison yle est le nom du groupe alkyle provenant de l’alcool (cette chaîne R' est numérotée, si nécessaire, à partir de l’atome de carbone lié à un seul atome
d’oxygène). (6)
Exemples :
(7)
Amines :
Quand le groupement amine est prioritaire, la molécule comprend le suffixe -amine : (8)
Exemples :
(ou triméthylamine).
Quand le groupement amine n'est pas prioritaire, le nom possède le préfixe amino- : (8 bis)
Exemples :
La fonction alcool est prioritaire devant la fonction amine.
La fonction acide est prioritaire devant la fonction amine.
Amides : Il y a de nombreux cas.
Si la fonction amide est prioritaire, le nom des amides primaires non substitués est celui de l'acide carboxylique correspondant en substituant la terminaison oïque par la terminaison amide
(on enlève le terme acide) : (9)
Exemples :
amide tertiaire car N est relié à 3 C.
Si la fonction amide n'est pas prioritaire, elle est nommée par le préfixe amido : (9 bis)
Exemples :
La fonction ester est prioritaire devant la fonction amide.
Rappel sur les hydrocarbures non cycliques
Les hydrocarbures ne contiennent que des atomes H et C. On distingue :
- les hydrocarbures saturés dont la chaîne carbonée est constituée uniquement de liaisons simples (alcanes).
- les hydrocarbures insaturés dont la chaîne carbonée présente au moins une liaison double ou triple (alcènes, alcynes)
Radical en fonction du nombre d'atomes de carbones
Nombre de carbones Radical Nombre de carbones Radical
1 méth- 2 éth-
3 prop- 4 but-
5 pent- 6 hex-
7 hept- 8 oct-
9 non- 10 déc-
11 undéc- 12 dodéc-
13 tridéc- 14 tétradéc-
15 pentadéc- 16 hexadéc-
17 heptadéc 18 octodec-
19 nonadéc- 20 eicos-
21 heneicos- 22 docos-
23 tricos- 24 tétracos-
25 pentacos- 26 hexacos-
27 heptacos- 28 octacos-
29 nonacos- 30 triacont-
31 hentriacont- 32 dotriacont-
33 tritriacont- 34 étratriacont-
35 pentatriacont- 36 hexatriacont-
37 heptatriacont- 38 octatriacont-
39 nonatriacont- 40 tétracont-
Exemples d'hydrocarbures non cycliques :
Propane : CH3 - CH2 - CH3 But-2-ène : CH3 - CH = CH - CH33-méthylbut-1-yne :
2- SPECTRES UV-VISIBLE
La spectroscopie étudie les interactions entre les ondes électromagnétiques et la matière. Chaque domaine de longueur d'onde apporte des renseignements sur l'organisation de la matière.
Nous commencerons par le domaine comprenant l'ultra-violet et le visible (longueurs d'onde comprises, dans le vide ou dans l'air, entre 200 et 400 nm pour l'ultra violet et entre 400 et 800 nm pour le
visible).
(10)
L'absorbance A (grandeur sans unité) d'une espèce en solution suit la loi de Beer-Lambert (voir le lexique de physique) :
AB( ) = log (Isolvant / Isolution) = e( ) . L . [B] (11)
L'absorbance d'une solution contenant une espèce colorée B à la concentration [B] dépend de la longueur d'onde de la radiation utilisée. Elle est proportionnelle à l'épaisseur L de la
solution et à la concentration [B] de l'espèce colorée.
Isolvant et Isolution sont les intensités lumineuses transmises par la cuve de solvant d'une part et la cuve de solution contenant l'espèce colorée d'autre part, pour des flux incidents égaux et
des caractéristiques de cuves identiques.
L est l'épaisseur de la solution en m (les chimistes emploient plutôt le cm).
[B] est la concentration molaire effective de l'espèce B en mol / L.
e( ) est le coefficient d'absorption molaire en L.mol - 1.m - 1 (ou en L.mol - 1.cm - 1). Il dépend de la nature du soluté et du solvant, de la température et de la longueur d'onde.
Au lieu de :
AB( ) = e( ) . L . [B] (11)
On écrit souvent ;
AB( ) = k . c (12) en posant k = e( ).L (13) et c = [B] (14)
Si une espèce chimique n'absorbe aucune radiation du domaine visible elle est incolore. (15)
Si une espèce chimique n'absorbe que dans un seul domaine du visible sa couleur sera la couleur complémentaire de celle des couleurs absorbées.
(16)
Avec le béta-carotène le spectre présente une bande d'absorption vers les courtes longueurs d'onde :
On observe que les radiations violettes, bleues et une partie des radiations vertes (bande d'absorption comprise
entre 400 et 500 nm) sont presque totalement absorbées par la solution de béta-carotène. Cette solution a donc la
couleur orange de la carotte. Cette couleur de la solution, observée par transmission, résulte de la superposition
sur la rétine de l'œil humain des radiations non absorbées (longueurs d'onde comprises entre 530 et 800 nm). (17)
Si une espèce chimique absorbe dans plusieurs domaines du visible sa couleur sera la synthèse additive des couleurs complémentaires des couleurs absorbées. (18)
Couleur perçue et struture chimique Bien que la spectroscopie UV-visible soit plus souvent utilisée pour mesurer la concentration d'une solution grâce à la loi de Beer-Lambert, les bandes d'absorption
peuvent aussi nous renseigner sur la présence de liaisons multiples dans la molécule et sur une éventuelle conjugaison (alternance liaison simple-liaison multiple). (19)
En effet, l'absorption de radiations par une molécule entraîne des sauts électroniques, c'est-à-dire le passage des électrons d'un niveau de basse énergie vers un niveau de plus haute énergie.
3- SPECTRES INFRAROUGE
En physique les ondes infrarouges sont comprises entre le domaine visible et les micro-ondes. Leurs longueurs d'ondes varient (dans le vide ou l'air) entre 780 nm et 1 000 000 nm (soit de 7,80 x 10 - 5
cm à 0,100 cm.
L'inverse de la longueur d'onde = 1 / est appelé nombre d'onde. Pour l'infrarouge les nombres d'ondes = 1 / sont compris entre 12821 cm - 1 et 10 cm - 1. (20)
On a = 1 / = 1 / (C / f) = f / C = h f / hC = Energie / hC.
Le nombre d'onde est proportionnel à l'énergie E = h.f des photons associés à l'onde électromagnétique.
On distingue l'infrarouge lointain (10 cm - 1 à 400 cm - 1 ), l'infrarouge moyen (400 cm - 1 à 4000 cm - 1), le proche infrarouge (4000 cm - 1 à 14 000 cm - 1). (21)
Les spectres d'absorption infrarouge, exploités en chimie organique, ne font intervenir que des nombres d'onde compris entre 500 et 4000 cm - 1 (infrarouge moyen). (22)
Lorsqu’un faisceau infrarouge d’intensité Io passe à travers une solution, une partie de l'énergie est absorbée. L’intensité de la lumière transmise I est donc inférieure à Io. (23)
La transmittance est définie par la relation T = I / Io. (24) On a la relation suivante entre la transmittance et l'absorbance : A = - log T. (25)
Exemple de spectre d'absorption infrarouge : On éclaire l'hexan-1-ol avec l'infrarouge moyen et le spectromètre donne la transmittance.
(26)
Sur l'axe horizontal orienté de droite à gauche on porte le nombre d'onde = 1 / . (27)
Sur l'axe vertical figure la transmittance ou intensité lumineuse exprimée en pourcentage. Une
transmittance de 100 % signifie qu'il n'y a pas d'absorption. (28)
Les bandes d'absorption d'un spectre infrarouge pointent donc vers le bas. (29)
Un spectre infrarouge comprend 2 régions distinctes :
- la région des grands nombres d'ondes ( > 1300 cm - 1 ) où se trouvent les bandes
d'absorption caractérisant les principales liaisons : C=O, C=C, C-H, O-H, N-H (30)
- la région des petits nombre d'ondes ( < 1300 cm - 1 ) qui est caractéristique du composé
étudié (non seulement des fonctions chimiques). (31)
Seule la première région est facilement exploitable. (32)
Origine du spectre Infra Rouge
Les différentes fréquences absorbées f = c / correspondent à des énergies hf permettant de faire vibrer de diverses manières certaines liaisons dans la molécule étudiée. Il s'agit de vibrations
d'élongation ou de vibrations de déformation. (33)
Vibrations d'élongation
(34)
Une molécule diatomique possède une fréquence de vibration propre fo. Si on soumet cette molécule à une onde électromagnétique de
fréquence f, il y aura résonance et absorption lorsque f sera égal à fo. (35)
Pour une molécule polyatomique, il y a plusieurs liaisons et donc plusieurs fréquences propres. Il y a couplage des oscillateurs. On peut ainsi
observer des vibrations symétriques et asymétriques expliquant notamment la présence de 2 bandes dans le spectre IR des amines primaires
(2 liaisons -N-H) (36)
Vibrations de déformation
Ces vibrations de déformation correspondent aux mouvements rotatifs de 2 atomes liés à un même 3°. Ces vibrations de déformation angulaire possédent des fréquences propres fo. Si on soumet cette
molécule à une onde électromagnétique de fréquence f, il y aura résonance et absorption lorsque f sera égal à fo. (37)
Exemple : Une bande d'absorption (1415 à 1470 cm - 1) met en évidence les vibrations angulaires associées aux angles pour un carbone tétragonal.
Un spectre IR renseigne sur la nature des laisons présentes dans une molécule et donc sur ses groupes caractéristiques. (38)
Voici un tableau donnant les nombres d'ondes associés aux différentes liaisons : (39)
Liaison O - H
libre
O - H
avec pont hydrogène
N - H
Ctri - H
Ctétra - H
vibration longitudinale
C = O
C = C
Ctétra - H
vibration angle
C - O
Nombre d'ondes
= 1 /
(cm - 1 )
3580 à 3650 3200 à 3400 3100 à 3500 3000 à 3100 2800 à 3000 1650 à 1750 1625 à 1685 1415 à 1470 1050 à 1450 1000 à 1250
Intensité Forte, fine Forte, large Moyenne Moyenne Forte Forte Moyenne Forte Forte Forte
Remarque :
Une liaison multiple est plus forte qu'une liaison simple. Les nombres d'ondes sont plus élevés. (40)
La présence de liaisons hydrogène entre molécules abaisse les nombres d'ondes associés aux liaisons O - H (alcools, acides carboxyliques) et aux liaisons N - H (amines, amides). (41)
La liaison O - H (ordinaire) dans l'éthanol gazeux (pas de liaisons hydrogène entre molécules différentes) a une bande d'absorption pour > 3600 cm - 1. Dans l'éthanol liquide (présence de
ponts hydrogène entre molécules) la bande d'absorption correspondant à la liaison O - H (associée par pont hydrogène) s'abaisse et s'élargit (3400 cm - 1 > > 3200 cm - 1).
Lorsqu'elles sont conjuguées les liaisons C = C ou C = O sont affaiblies et diminue. (42)
Exemple d'interprétation d'un spectre IR :
(43)
A l'aide du spectre IR ci-contre retrouvons les principales liaisons chimiques présentes dans la
molécule de l'hexan-1-ol de formule semi-développée :
CH3 - (CH2)4 - CH2OH alcool primaire (44)
- Le tableau ci-dessus permet de dire que la large bande d'absorption à 3 300 cm - 1 correspond à
la présence de la liaison O - H (associée) à 3 300 cm - 1, (45)
- La bande étroite vers 2 800 - 3 000 cm - 1 correspond à la présence des liaisons Ctétra - H. (46)
4- SPECTRES RMN DU PROTON
Principe
La spectroscopie RMN (Résonance Magnétique Nucléaire) est basée sur l'énergie que peut capter un noyau lorsqu'il est placé dans un champ magnétique et qu'il reçoit un rayonnement
électromagnétique. (47)
Le programme limite l'étude de la RMN à celle du proton (noyau de l'atome présent dans une molécule). (48)
Un proton possède un spin lié à une rotation sur lui-même. Placé dans un champ magnétique le proton peut prendre 2 orientations ayant 2 énergies différentes. Soumis à un rayonnement
électromagnétique amenant la bonne énergie ( h.f ) il peut alors passer du niveau d'énergie bas au niveau d'énergie haut (retournement du spin). Il y a résonance. (49)
S'il est placé dans un champ magnétique de 1,4 T (tesla) le proton absorbe l'énergie d'une onde ayant une fréquence d'environ 6 x 10 7 Hz (domaine des ondes radio). Mais cette fréquence de
résonance peut varier légèrement de quelques parties par million ( ppm ) d'un noyau à un autre selon l'environnement ( atomes voisins et liaisons ) :
Si cet environnement est favorable (déblindage) la fréquence de la radiation provoquant la résonance diminue ainsi que son énergie. (50)
Si cet environnement est défavorable (blindage) la fréquence de la radiation provoquant la résonance augmente ainsi que son énergie. (51)
On place le composé étudié dans un champ magnétique fixe créé par un aimant puis on envoie un rayonnement de fréquence réglable. (52)
La variation de fréquence est exprimée par rapport à un composé de référence : le Tétra Méthyl Silane Si(CH3)4 ou TMS introduit en petite quantité avec le composé étudié. Le TMS fournit un pic unique (
12 protons équivalents ) situé complètement à droite du spectre. (53)
La variation de fréquence est très faible et dépend du voisinage du noyau. On la transforme en une grandeur appelée déplacement chimique exprimée en partie par million ( est en ppm ). (54)
Voici un tableau donnant quelques déplacements chimiques des protons en RMN : (55)
Proton CH3- C CH3- C-O CH3 - C = C CH3- OH CH3 - CO - O - R C - CH2 - C C - CH2 - C - O C-CH-C C - CH2 - O - H C - CH2- O - CO - R C6H6- CO - OHR - OH
Déplacement chimique
(ppm)
0,9 1,4 1,6 3,4 2,0 1,3 1,9 1,5 3,6 4,1 7,2 8;5 - 13 0,5 - 5,5
Remarque : En abscisse on lit le déplacement chimique en ppm (partie par million) qui est un écart relatif de fréquence : = ( fe - fr) / fo où fr est la fréquence de résonance d'un produit de référence, fe
est la fréquence de résonance d'un proton de l'échantillon et fo est la fréquence de l'appareil.
Par exemple = 1200 / 300.106 = 4,00.10-6 = 4,00 ppm (en multipliant par 106). Le déplacement chimique est généralement compris entre 0 et 16 ppm.
Exemple de spectre RMN
En spectroscopie IR ou UV - visible on parle de bande d'absorption. En spectroscopie RMN on parle de signal.
(56)
Spectre de RMN de l'éthanol CH3 - CH2 - OH (57)
Chaque signal du spectre RMN de l'éthanol est caractérisé par sa position sur un axe orienté de droite à
gauche ayant pour origine le signal du TMS (voir ci-dessus). Le déplacement chimique du signal est
exprimé en ppm. (58)
Les protons du groupe méthyle CH3 résonnent vers 1,2 ppm. (59)
Les protons du groupe méthylène CH2 résonnent vers 3,6 ppm. (60)
Les protons du groupe hydroxyle OH résonnent vers 4,7 ppm. (61)
Remarque :
On explique les termes singulet, triplet, quadruplet ci-dessous.
Influence de l'environnement des protons
Les 4 protons du 1,2-dichloroéthane Cl - CH2 - CH2 - Cl ayant le même environnement sont chimiquement équivalents; Ils résonnent tous les 4 pour = 3,4 ppm. (62)
Par contre pour le 1-chloro-2-iodoéthane Cl - CH2 - CH2 - I les 2 premiers protons résonnent pour des déplacements chimiques différents : = 3,4 ppm pour les premiers et = 3,1 ppm pour les
seconds. (63)
Remarque : Rarement certains non chimiquement équivalents peuvent résonner pour le même déplacement chimique. Par exemple les des groupes méthyle de CH3 - NH2 et de CH3 - C6H5
résonnent tous pour = 2,3 ppm. (65)
Courbe d'intégration des signaux
Définition :
Certains appareils permettent de tracer en plus du spectre une courbe dite courbe d'intégration avec des marches verticales. (66)
Le rapport des hauteurs entre 2 paliers est égal au rapport du nombre de protons présents dans chaque groupe de pics (groupe appelé massif) :
h2 / h1 = nombre de protons du groupe 2 / nombre de protons du groupe 1 h2 / nombre de protons du groupe 2 = h1 / nombre de protons du groupe 1 (67)
h3 / h1 = nombre de protons du groupe 3 / nombre de protons du groupe 1 h3 / nombre de protons du groupe 3 = h1 / nombre de protons du groupe 1 (68)
h3 / h2 = nombre de protons du groupe 2 / nombre de protons du groupe 1 h3 / nombre de protons du groupe 3 = h2 / nombre de protons du groupe 2 (69)
Exemple :
(70)
Multiplicité d'un signal - Règle des (n + 1)-uplets
Dans une molécule, les protons portés par un atome de carbone C interagissent avec les protons portés par les atomes de carbone voisins. C'est le couplage entre protons. (71)
(72)
Les protons du groupe méthyle CH3 - de l'éthanol CH3 - CH2 - OH voisins des 2 protons du groupe -
CH2 - donnent (2 + 1) pics , soit 3 pics (un triplet). (73)
Les protons du groupe - CH2 - de l'éthanol CH3 - CH2 - OH voisins des 3 protons du groupe CH3 -
donnent (3 + 1) pics , soit 4 pics (un quadruplet). (74)
Quand le proton est lié à un atome autre que C (ici H est lié à O) il ne donne pas lieu au couplage avec
d'autres protons de la molécule. On a un pic singulet. (75)
Singulet, triplet et quadruplet sont visibles sur le spectre de RMN de l'éthanol. Il existe aussi des signaux
duplet, quintuplet, sextuplet, etc. (76)
Règle des (n + 1)-uplets : Un proton ou un groupe de protons équivalents ayant n protons voisins eux-mêmes équivalents (portés par des atomes de carbone voisins) donne par couplage avec ceux-ci un
signal possédant (n + 1) pics. Ce signal est un multiplet (doublet, triplet, quadruplet, quintuplet, etc.). (77)
Par conséquent le nombre de signaux, la courbe d'intégration ainsi que le déplacement chimique permettent très souvent d'identifier les différents atomes d'hydrogène présents dans une molécule dont on
a le spectre de RMN. (78)
Remarque :
Quand le proton est lié à un atome autre que C (alcool, acide, amine) il ne donne pas lieu au couplage avec d'autres protons de la molécule. On a un pic singulet. (75 bis)
Du fait de la symétrie de la molécule Cl - CH2 - CH2 - Cl les protons H sont tous équivalents et on a un pic singulet. (78)
5- CONCLUSION
Spectroscopie IR et spectroscopie RMN se complètent bien. La spectroscopie IR donne surtout des renseignements sur les fonctions chimiques présentes dans une molécule, la spectroscopie RMN en
donne davantage sur la chaîne carbonée.
A VOIR :
Exercice 7-A : Connaissances du cours n° 7.
Exercice 7-B : Groupes caractéristiques et fonctions.
Exercice 7-C : Spectres UV-visible.
Exercice 7-D : Spectres infrarouge.
Exercice 7-E : Spectres de RMN.
Exercice 7-F : Identifier une molécule.
Exercice 7-G : Estérification (Bac 2013 - Centres étrangers - Exercice II)
Retour Sommaire - Informations
1
/
1
100%