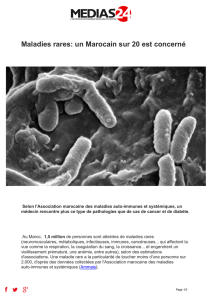
Programme Conférence Auto-immunité - Maroc 2016

www.ammais.org
L’Association Marocaine
des Maladies Auto-Immunes
et Systémiques
Organise
ème
Thèmes :
Infections et maladies auto-
immunes et systémiques
JOURNEE
de l’auto-immunité
Sous la présidence
du Pr Loïc Guillevin
Hôtel Sheraton
Casablanca
Lieu
Samedi 5 novembre 2016
Date
Pr Olivier Lesens
Pr Alain Saraux
Dr Abdelffettah Sentissi
Pr Abdeleffettah Chakib
Pr Hasna Hassikou
Pr Loic Guillevin
Dr Hicham Ouazzani
Pr Abdelhamid Mohattane
Pr Abdelhamid Naitlho
intervenants
Rhumatisme articulaire aigu et rhumatismes
post-streptococciques
Arthrites réactionnelles
Les manifestations systémiques des infections
La biothérapie et risque infectieux
La périartérite noueuse
Les auto-anticorps et infections
La tuberculose latente
Les èvres d’origine non infectieuse
Les vaccinations dans les maladies auto-
immunes
Le traitement des infections opportunistes au
cours des maladies auto-immunes
Partenaires Média
Partenaires et sponsors
Pour toutes informations contacter :
Dr Khadija Moussayer, spécialiste en
médecine interne et en Gériatrie,
présidente d’AMMAIS
Tel : 06 61 43 11 86 /
[email protected] www.ammais.ma


3
www.ammais.org
PROGRAMME
8h30 : Accueil des participants et exposition des stands
Première session : le rhumatisme articulaire aigu, une
maladie auto-immune post-infectieuse
Modérateurs : Pr Ali Hda & Pr Kamal Marhoum
09h00 : Liens entre infections et maladies auto-immunes et
systémiques (Pr Olivier Lesens)
09h25 : Actualités du rhumatisme articulaire aigu
et des rhumatismes post-streptococciques
(Pr Alain Saraux)
09h50 : L’apport des ASLO dans le diagnostic
du rhumatisme articulaire aigu
(Dr Abdelfattah Sentissi)
10h00 : Discussion
10h30 : Pause café&visite des stands
Seconde session : Liens entre infections et maladies
auto-immunes et systémiques
Modérateurs : Dr Saloua Larhrissi & Pr Nouzha Guessous
11h00 : Les actualités des arthrites réactionnelles
(Pr Alain Saraux)
11h30 : Les manifestations systémiques des infections
(Pr Abdelffettah Chakib)
12h00 : Biothérapies et risque infectieux
(Pr Hasna Hassikou)
12h30 : Discussion
13h00 : Déjeuner (Prière de réserver votre place au
moment de l’inscription - coût du repas 100Dh).
Matinée :

4
Association Marocaine des Maladies Auto-Immunes et Systémiques
Troisième session : La périartérite noueuse et les
infections virales
Modérateurs : Pr Majida Zahraoui & Dr Fouzia Chraibi
14h 30 : Les actualités de la périatérite noueuse
(Pr Loïc Guillevin)
15h10 : La recherche biologique des ANCA
(Dr Hicham Ouazzani)
15h 30 : Fièvre au long cours et maladies auto-immunes et
systémiques
(Pr Abdelhamid Mohattane)
16h00 : Discussion
16h30 : Pause café
Quatrième session : Les infections et leurs
thérapeutiques
Modérateurs : Pr Loïc Guillevin & Dr Malika Benkiran
17h00 : Le diagnostic et le traitement de l’infection
tuberculeuse latente
(Pr Abdelhamid Naitlho)
17h20 : La vaccination dans les maladies auto-immunes
et systémiques (Pr Loïc Guillevin)
17h40 : La gestion des infections au cours des maladies
auto-immunes et systémiques (Pr Olivier Lesens)
18h00 : Discussion
18h30 : Recommandations et clôture
Après-midi
PROGRAMME

5
www.ammais.org
LISTE DES MODERATEURS
Pr Ali Hda : Interniste libéral Marrakech.
Pr Kamal Marhoum : Professeur de maladies
infectieuses, chef de service des
maladies infectieuses CHU de
Casablanca.
Dr Saloua Larhrissi : Rhumatologue libéral Rabat.
Pr Nouzha Guessous : Professeur de l’université Hassan
II de Casablanca. Chercheuse et
consultante en Droits Humains et
en Bioéthique.
Pr Majida Zahraoui : Interniste infectiologue libéral
Casablanca.
Dr Fouzia Chraibi : Pharmacienne biologiste
Casablanca.
Dr Malika Benkiran : Pharmacienne biologiste
Casablanca.
COMITÉ D’ORGANISATION
Dr Khadija Moussayer : Présidente d’ AMMAIS
Mme Aziza Djedidi : Vice-présidente.
Mme Soua khoufacha : Secrétaire générale
Mlle Maha Moustatir : Trésoriére Adjointe
Mme Madiha Esseffah : Trésorière
M.Chahbi Ahmed : Conseiller
Dr Loubna Dalal : Conseillère
Mme Fatima Lahouiry : Conseillère
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
1
/
44
100%