bacteriologie - Accueil - revue

bacteriologie
BONI CISSÉ C1,2, MÉITÉ S1,2, KOFFI P3, N’DOUBA KACOU A1,2, FAYE KETTÉ H1,2, DOSSO M1,2.
1- Département de Microbiologie, Université de Cocody, Abidjan, Côte d’Ivoire.
2 - Département de Bactériologie- Virologie, Institut Pasteur de Côte d’Ivoire.
3- Institut de Cardiologie, Abidjan, Côte d’Ivoire UFR-
Correspondance : BONI CISSE Catherine /tel. 225 05 08 35 23
E-mail : [email protected]
RÉSUMÉ
la méthode de Brun buisson. L’antibiogramme a été
réalisé selon la technique de diffusion en milieu gélosé.
Les cathéters périphériques représentaient 78% de
l’ensemble des cathéters collectés et 22% étaient des
cathéters veineux centraux. Sur un ensemble de 102
cathéters collectés, la culture s’était révélée positive
dans 14,7%. Au niveau des cathéters centraux deux
prols de résistance étaient observés sur les bactéries
isolées. Il s’agissait de S. epidermidis du prol (MetiR,
FQR, KTG) et de E. aerogenès du prol(NAR). Au niveau
des cathéters périphériques, deux prols de résistance
étaient observés sur les bactéries isolées. Il s’agissait
de E. coli du prol (Penicillinase TRI ; KTNm) et de A.
baumannii du prol(ImpR).
Mo t s -c l é s : c a t h é t e r , b i o f i l m , s o i n s i n t e n s i f s
Revue Bio-Africa - N° 8 - 2010, pp. 34-38
© EDUCI 200x
COLONISATION DES CATHETERS PAR LE BIOFILM BACTERIEN DANS UN SERVICE
DE SOINS INTENSIF A ABIDJAN
En Afrique et particulièrement en Côte d’ivoire, il
existe très peu de données concernant l’étude sur le
biolm. Devant la relation existant entre biolm et
infections nosocomiales, Il apparait important d’étudier
le biolm au niveau des biomatériaux et notamment
des cathéters an de mieux lutter contre les infections
acquises en milieu hospitalier. L’objectif de notre
étude était d’identier les bactéries constituant le
biolm et de déterminer leur prol de résistance vis-
à-vis des antibiotiques. Une étude pilote, prospective
à visée descriptive qui s’est déroulée du 10 avril au
10 juillet 2009. L’échantillonnage était constitué de
102 cathéters recueillis chez 69 patients hospitalisés
dans les services de Réanimation et de Médecine de
l’Institut de cardiologie d’Abidjan durant la période
d’étude. Les cathéters ont été mis en culture selon
ABSTRACT
In Africa and particularly in Cote d’ Ivoire, there is
very little data concerning the study of biolm. In view
of the relationship that exists between biolm and no-
socomial infections, it is important to study the biolm
in biomaterials, especially catheters in other to ght
efciently against infections acquired in hospitals. The
aims of this study were to identify the bacteria forming
the biolm and determine their antibiotics resistance
prole. This a descriptive study, which was conducted
from April 10 to July 10, 2009.
A total of 102 catheters were collected from 69
patients hospitalized in the intensive care units of the
institute of cardiology of Abidjan (ICA) during the study
period. The catheters were cultured using the method
of Brun buisson. Antimicrobial susceptibility was per-
formed using the method of agar diffusion.
Out of total 102 catheters collected, peripheral
catheters accounted for 78%. In the bacteria isola-
ted from central venous catheters two antibacterial
prole were observed .They were S. epidermidis of
the profile (Meti,R FQR and KTGR) and E.aerogenes
of the prole(NaR). From the bacteria isolated from
peripheral catheters, two resistance patterns were
observed. They were E. coli of the profile (KTNmR
pénicillinase TRI) and A. baumannii profile (IMPR).
Identify the molecular characterization of bacteria
from the biolm in other to study the mechanisms of
resistance especially resistance genes of (IMPR) strain.
Ke y w o r d s : c a t h e t e r , b i o f i l m , i n t e n s i v e c a r e

INTRODUCTION
Le biolm est un ensemble de micro-
organismes recouvert par une couche
protectrice visqueuse polysaccharidique. Des
bactéries, des mycobactéries, des levures,
des champignons et des algues peuvent s’y
trouver9. En médecine, le rôle du biolm
est établi dans les infections nosocomiales
exogènes. Dans ces cas, les biomatériaux
tels que les sondes urinaires, les cathéters
intraveineux et les pacemakers servent de
support. Ainsi, dans l’infection urinaire
sur sonde à demeure, une bactériurie se
développe chez plus de 25% des patients
porteurs d’une sonde urinaire au bout
d’environ 7 jours avec un risque journalier
croissant de 5%. Après 30 jours, l’infection
urinaire est de 100%4,8,15. En France, les
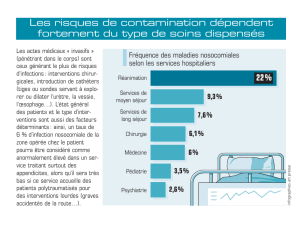
infections liées aux cathéters représentent 18
à 25% des infections nosocomiales ; et sont
à l’origine de complications infectieuses ou
thrombotiques, d’une prolongation du séjour
à l’hôpital et de surcoûts hospitaliers16.
Cependant, en Afrique et particulièrement
en Côte d’Ivoire, il existe très peu de données
concernant l’étude sur le biolm. Devant la
relation existant entre biolm et infections
nosocomiales, Il apparait important d’étudier
le biolm an de mieux lutter contre les in-
fections acquises en milieu hospitalier ; d’où
l’intérêt de notre travail. Les objectifs de cette
étude sont d’identier les bactéries consti-
tuant le biolm et de déterminer leur prol
de résistance vis-à-vis des antibiotiques.
MATÉRIEL ET MÉTHODES
Il s’agissait d’une étude prospective à visée
descriptive qui s’est déroulée du 10 avril
au 10 juillet 2009. L’inclusion des malades
s’est faite dans les services de Médecine et
de Réanimation de l’Institut de Cardiologie
d’Abidjan (ICA) .L’analyse bactériologique
des cathéters s’est effectuée à l’Unité de
Bactériologie Clinique du département de
Bactériologie et Virologie à l’Institut Pasteur
de Côte d’ Ivoire (IPCI). L’échantillonnage
était constitué de 102 cathéters recueillis
chez 69 patients. Ont fait partie de notre
étude les cathéters veineux centraux et les
cathéters veineux périphériques, implantés
chez tout patient admis dans les services
de Réanimation et de Médecine de l’ICA
durant la période d’étude. La che d’enquête
comportait des paramètres liés au porteur
du cathéter et des paramètres liés au
cathéter. L’analyse bactériologique s’est
faite selon la méthode de Brun Buison3.
L’identication bactérienne s’est faite selon
les techniques classiques de bactériologie.
L’étude de la sensibilité aux antibiotiques a
été réalisée selon la méthode de diffusion en
milieu gélosé. La lecture et l’interprétation
de l’antibiogramme ont été faites selon les
normes du CASFM version 20095.
RÉSULTATS
LES DONNÉES ÉPIDÉMIOLOGIQUES
La tranche d’âge allant de 30 à 50 ans
était la plus importante avec 51% suivie de
celle de 51 à 80 ans avec 39%. Le sex ratio
était de 1,27. Environ 67% des échantillons
provenaient du service de Médecine et 33%
du service de Réanimation. Les cathéters
périphériques représentaient 78% de l’en-
semble des cathéters collectés. Le taux de co-
lonisation des cathéters périphériques était
de 15% (12/80) et celui des cathéters cen-
traux à 13,6% (3/22). Les cultures positives
étaient observées dans 66,7% des cathéters
provenant de patients de sexe masculin.
LES DONNÉES BACTÉRIOLOGIQUES
Sur un ensemble de 102 cathéters
collectés, la culture s’était révélée positive
dans 14,7 % avec 66,7 % (10/15) de bacilles
à Gram négatif, 20% (3/15) de cocci à
Gram positif et 13,3% (2/15) de bacilles
à Gram positif. Au niveau des bacilles à
Gram négatif, l’espèce la plus fréquente
Revue Bio-Africa - N°8- 2010, pp. 34-38
35
Colonisation des catheters par le biolm bactérien....

Revue Bio-Africa - N° 8- 2010, pp. 34-38
BONI CISSÉ C, MÉITÉ S, KOFFI P et al
36
a été Acinetobacter baumannii avec 26,5%
(Tableau 1). Au niveau des cocci à Gram
positif, S. aureus a été retrouvé dans 13,3%.
Sur les cathéters centraux, étaient isolées
Enterobacter aerogenès (33,3%), Klebsiella
pneumoniae (33,3%) et Staphylococcus
epidermidis (33,3%). Au niveau des cathéters
périphériques Acinetobacter baumannii étaient
isolées dans 33,4% suivies de Staphylococcus
aureus avec 16,7% (Tableau 2).
LES MARQUEURS DE RÉSISTANCE
AUX ANTIBIOTIQUES
Dans 69,2% des souches isolées aucun
marqueur de résistance n’avait été observé.
30,8% des bactéries isolées présentaient
au moins un marqueur de résistance aux
antibiotiques. Une souche de S. epidermi-
dis isolée au niveau d’un cathéter central
était à la fois résistante à la méticilline, aux
uoroquinolones et aux aminosides et une
souche d’E. coli produisait une pénicillinase
et était résistante aux aminosides (tableau
3). La résistance à l’acide nalidixique a été
observée pour une souche d’E. aerogenes
isolée au niveau d’un cathéter central.
La résistance à l’imipenème Au niveau
des Non entérobactéries, une souche de A.
baumannii isolée au niveau d’un cathéter
périphérique était résistante à l’imipenème.
Tableau I : Répartition des bactéries isolées selon leur morphologie
Morphologie Genre Espèces N %
Bacilles à Gram négatif
(N=10)
Entérobactéries
(n= 4)
E. coli 1 6,7
K. pneumoniae 1 6,7
E. aerogenes 1 6,7
S. marcesens 1 6,7
Non entérobactéries
(n=6)
Acinetobacter baumannii 4 26,5
P. aeruginosa 1 6,7
Stenotrophomonas
malthophilia 1 6,7
Cocci à Gram positif
(N= 3) Staphylocoques S. aureus 2 13,3
S. epidermidis 1 6,7
Bacilles à Gram positif
(N= 2) Bacillus Bacillus spp 2 13,3
Tableau II : Comparaison des bactéries selon le type de cathéters
Bactéries Cathéters centraux
N(%)
Cathéters périphériques
N (%)
E. aerogenes 1 (33,3)
K. pneumoniae 1 (33,3)
S. epidermidis 1 (33,3)
Acinetobacter baumannii 4 (33,4)
Stenotrophomonas maltophilia 1(8,3)
bacillus 2 (16,7)
E.coli 1 (8,3)
P.aeruginosa 1 (8,3)
S.aureus 2 (16,7)
S.marcescens 1 (8,3)

Revue Bio-Africa - N°8- 2010, pp. 34-38
37
Colonisation des catheters par le biolm bactérien....
Tableau III : Répartition des phénotypes de résistance selon les espèces bactériennes.
Phénotypes de résistance Espèces %
Staphylocoques
MetiR FQR KTGRS. epidermidis 42,9
Entérobactéries
KTNmR pénicillinase TRI E.coli 28,6
NaRE. aerogenes 14,4
Non entérobactéries
IMPRA.baumannii 14,2
DISCUSSION
Comme tout matériel implanté, les
cathéters ont une propension à se couvrir
d’un biolm, c’est à dire à être colonisés par
des germes. Ils peuvent être ainsi le point
de départ d’infection locale ou générale
dont les conséquences vont retentir sur
l’avenir du cathéter ou celui du patient4,12,13.
Plusieurs études ont donc été effectuées
sur les cathéters aussi bien centraux que
périphériques en milieu hospitalier16,10,14.
Dans la présente étude, le sexe masculin
prédominait et la moyenne d’âge était de
46,4 ans. Selon certains auteurs, 90% des
infarctus se voient entre 40 et 60 ans.17.
De plus l’infarctus du myocarde serait plus
fréquent chez l’homme que chez la femme7.
Aussi dans cette étude, l’âge des patients, le
sexe masculin, une utilisation intra-cathéter
répétée et systématique d’antibiotique durant
le cathétérisme ainsi que la durée du maintien
du cathéter, augmenteraient le risque de
colonisation du cathéter. Ces résultats ont
été aussi retrouvés par certains auteurs10,6.
Cependant l’utilisation d’antibiotiques
intraveineux pendant la durée d’insertion
du cathéter est associée à un risque moindre
d’infection10. De plus, il existerait un lien
entre risque infectieux et durée d’insertion
du cathéter qui était de 0,3 à 0,5% par
jour-cathéter16. De cette étude, il semble
difcile d’incriminer le service, la durée de
l’hospitalisation et le type de cathéter comme
des facteurs à risque compte tenu de la taille
de notre échantillon. Certaines études ont
montré que le taux d’infection des cathéters
périphériques et celui des cathéters centraux
étaient pratiquement identiques16.
Concernant le prol microbiologique, une
étude réalisée dans un hôpital de Paris Sud-
Est a rapporté S. epidermidis comme première
étiologie des infections des cathéters11.
D’après plusieurs auteurs les bactéries des
biolms, isolés sur des cathéters centraux
restent pratiquement les mêmes, seuls
diffèrent les taux de colonisation16.
Concernant la résistance aux antibiotiques,
in vivo les antibiotiques ont peu d’effets sur
les microorganismes présents à l’intérieur
des biolms car ces derniers agissent comme
facteur de résistance ou de protection
contre les antibiotiques qui ne réussissent
pas à pénétrer ce réservoir2,18,19,21. Par
conséquent, les marqueurs de résistance aux
antibiotiques ne permettant pas d’expliquer à
eux seuls la résistance des bactéries présents
sur le biofilm, il y a nécessité d’étudier
les autres facteurs tels que les facteurs
d’adhérence et de virulence. Les infections à
BMR entraînent un surcoût (durée de séjour
plus longue, coût des antibiotiques, cout
des examens) par rapport aux infections à
bactéries sensibles1,20.
CONCLUSION
Il importe aujourd’hui que le personnel de
santé sache prendre en charge un malade
porteur de biomatériau tel que les cathéters
an de minimiser les coûts hospitaliers.
L’étude sur les biolms constitue un maillon
important dans les mécanismes de survenue

Revue Bio-Africa - N° 8- 2010, pp. 34-38
BONI CISSÉ C, MÉITÉ S, KOFFI P et al
38
des infections nosocomiales. Les données
issues de ces études doivent être prises en
compte dans la surveillance et la prévention
de ces infections.
REFERENCES BIBLIOGRAPHIQUES
1-Astagneau P., COSTA Y., Legrand P. (2009).
Maîtrise de la diffusion des bactéries multiré-
sistantes aux antibiotiques. CLIN, Paris.
2-Belanger S. (2006). Cathéter veineux central
introduit par voie éphébique ; à la recomman-
dation adéquat, faiblesses et résultats. Atelier
Séminaire de l’Association québécoise des
inrmières en oncologie.45-80.
3-Buisson B. (1988). Méthode diagnostic des
infections liées aux cathéters. Paris Masson
éd. 76-87.
4-Chevrou .M, Roudiere. A (2004).Les biolms :
projet binôme Ecole Nationale Supérieure de
Chimie de Reine. 16-20
5-COMITÉ DE L’ANTIBIOGRAMME DE LA
SOCIÉTÉ FRANÇAISE DE MICROBIOLOGIE.
CA-SFM. (2009).
6-Filloux A , Vallet I. (2003). Biolm,positioning
and organisation of bacterial communities. 1
(19). 77-83
7-Ghigho J.M. (2008). Les biolms bactériens ; des
agents pathogènes sous abri. Paris. 9-13
8-Haffner F. (2008). Les infections ordinaires
récidivantes Lettre du Spina Bida 109. 2-6.
9-Klingler C., Filloux A., Lazdunski A. (2005).
Les biolms, forteresse bactérienne. Revue La
Recherche. 139.
10-Leroy.(2006).Infections sur cathéters
vasculaires. http//www.infectio.lille.com.Ed
1-79.
11-Lucet JC. (2002). Épidémiologie des infections
liées aux CVC en réanimation actualisation.
12-Mulla, SA, Revdiwala, S (2011). Assessment of
biolm formation in device-associated clinical
bacterial isolates in a tertiary level hospital.
Indian J Pathol Microbiol 54:561-4
13-Patwardhan RB, Dhakephalkar PK, Niphadkar
KB, Chopade BA.(2008). A study on nosocomial
pathogens in ICU with special reference to
multi resistant Acinetobacter baumannii
harbouring multiple plasmids. Indian J Med
Res 128: 178–187.
14-Paul N (2002). Danese Antibiolm Approaches:
Prevention of Catheter colonization Chemistry
& Biology, 9:873–880.
15-Pour, NK, Dusane, DH, Dhakephalkar, P. (2011).
Biolm formation by Acinetobacter baumannii
strains isolated from urinary tract infection and
urinary catheters. FEMS Immunology & Medical
Microbiology, 62: 328–338.
16-Santre CH. (2002). Infection liées aux cathéters,
prévention et traitement épidémiologie,
facteurs de risque, aspects cliniques, moyens
diagnostiques et thérapeutiques.
17-Sevede M. (2002) Evolution des enzymes
cardiaques au cours de l’infarctus du myocarde.
Mém. d’Ingénieur en Biochimie, 77- 79.
18-Shin, JH, Kim, SM, Kim, J (2009). Proteomic
analysis of Acinetobacter baumannii in biolm
and planktonic growth mode. J. Microbiol., 47:
728–735
19-Smolyakov, R, Borer, A, Riesenberg, K (2004).
Nosocomial multidrug resistant Acinetobacter
baumannii bloodstream infection: risk factors
and outcome with ampicillin–sulbactam
treatment. J Hosp Infect., 56: 165–156.
20-Sousa, CL, Henriques, M, Oliveira, R (2011).
Mini-review: Antimicrobial central venous
catheters – recent advances and strategies.
Biofouling, 27(6): 609–620
21-Zavascki, AP, Carvalhaes, CG, Picao, RC, Gales,
AC. (2010) Multidrug resistant Pseudomonas
aeruginosa and Acinetobacter baumannii:
resistance mechanisms and implications for
therapy. Expert Rev Anti Infect Ther 8: 71–93
1
/
5
100%