CANCER DU POUMON

//
FORMATION CONTINUE
CANCER DU POUMON
ACTION-RÉACTION !
Mme Bouchard, 65 ans, se présente à votre cabinet pour une toux sèche et persistante
depuis un mois avec une légère dyspnée. Elle vous rappelle fièrement qu’elle a cessé de fumer
il y a plus de vingt ans. Cependant, elle s’inquiète, car elle a remarqué, la semaine dernière,
un filet de sang dans ses expectorations. Il s’agit fort probablement d’une bronchite,
mais vous ne voulez pas écarter la possibilité d’un cancer du poumon. Quelles actions
devez-vous entreprendre pour vous assurer d’une démarche efficace et éliminer le pire ?
Giovanna Speranza, François Rodier et Céline Devaux
En 2013, le cancer du poumon représentait 27 % de tous
les nouveaux cas de cancer au Canada et était la première
cause de mortalité par cancer (plus de 25 %)1. La fumée
du tabac en est responsable la plupart du temps, mais
d’autres facteurs de risque incluent l’exposition à divers
carcinogènes (ex. : amiante, radon ou nickel) et à des micro-
particules en milieu de travail (ex. : silicose, poussière de
bois) ainsi que les antécédents personnels de bronchopneu-
mopathie chronique obstructive ou de fibrose pulmonaire
et des antécédents familiaux de cancer du poumon ou de
la sphère ORL. Même les patients sans facteurs de risque
apparents peuvent souffrir d’un cancer du poumon.
D’un point de vue histologique, le cancer du poumon se
classe en cancer à petites cellules (15 % des cas) et en
cancer non à petites cellules (85 % des cas)2.
Le cancer non à petites cellules comprend principale-
ment l’adénocarcinome, le carcinome épidermoïde et le
carcinome à grandes cellules. La biologie, la stadification
et le traitement diffèrent considérablement entre les deux
types. Aussi, les récentes percées dans la pathogenèse
moléculaire et l’arrivée de traitements dits ciblés ont modi-
fié l’approche. Non seulement le diagnostic histologique
précis s’avère déterminant, mais l’identification molé-
culaire appropriée influe sur le traitement des récidives
ou des métastases.
En présence de symptômes non spécifiques (ex. : perte de
poids ou fatigue) ou fréquents (ex. : toux et dyspnée), qui
peuvent parfois dissimuler un cancer du poumon, com-
ment établir un diagnostic pouvant bénéficier à chaque
patient individuellement ?
COMMENT RECONNAÎTRE LE TABLEAU CLINIQUE ?
Seule une minorité de personnes ne présente pas encore
de symptômes au moment du diagnostic2. Il s’agit alors
souvent d’une découverte fortuite à un stade précoce. Les
lésions solitaires de 3 cm ou moins avec bilan d’extension
négatif font généralement l’objet d’une opération. Sinon, une
orientation en pneumologie est à envisager3. Il est impor-
tant de connaître les tableaux variés du cancer du poumon
afin de faciliter l’évaluation diagnostique et les décisions
thérapeutiques subséquentes. Le tableau I4 énumère les
si gnes et les symptômes initiaux du cancer du poumon.
En raison de la diversité des tableaux cliniques, les pro-
chaines actions dépendront des réponses aux questions
suivantes :
h Qui doit-on envoyer à l’urgence ?
h À qui doit-on prescrire une radiographie pulmonaire ou
une tomographie axiale ?
//
FORMATION CONTINUE
La Dre Giovanna Speranza, oncologue médicale,
la Dre Céline Devaux, hémato-oncologue et
le Dr François Rodier, pneumologue, exercent tous
les trois au Centre hospitalier Charles-Le Moyne, à
Greenfield Park, et sont professeurs au Département
de médecine de l’Université de Sherbrooke.
TABLEAU I
FRÉQUENCE DES SIGNES
ET SYMPTÔMES INITIAUX DU CANCER
DU POUMON4
Signes et symptômes Fréquence
Toux 8 % – 75 %
Perte de poids 0 % – 68 %
Dyspnée 3 % – 60 %
Douleur thoracique 20 % – 49 %
Hémoptysie 6 % – 35 %
Douleur osseuse 6 % – 25 %
Hippocratisme digital 0 % – 20 %
Fièvre 0 % – 20 %
Asthénie 0 % – 10 %
Obstruction de la veine cave supérieure 0 % – 4 %
Dysphagie 0 % – 2 %
Sibilances 0 % – 2 %
25
lemedecinduquebec.org

h Qui doit-on orienter en pneumologie ou vers une équipe
d’évaluation pulmonaire ? Et quels seront alors les prin-
cipaux examens paracliniques effectués ?
En 2011, le programme Action Cancer Ontario a créé un
guide de recommandations à l’intention des médecins ou
des professionnels de la santé en première ligne qui soup-
çonnent un cancer du poumon4. Il est possible de faire
ressortir de cet outil certains éléments adaptables à notre
réalité québécoise.
ALORS QUI DOIT-ON ENVOYER À L’URGENCE ?
Une orientation à l’urgence est de mise si les symptômes
énumérés dans le tableau II4 sont présents.
À QUI DOIT-ON PRESCRIRE UNE RADIOGRAPHIE
PULMONAIRE ?
La bronchite est la cause la plus fréquente d’hémoptysie.
Cependant, si elle persiste, même en petite quantité, chez
des patients ayant des facteurs de risque, la possibilité
d’une tumeur endoluminale doit être envisagée malgré
une radiographie pulmonaire normale.
Après la radiographie pulmonaire (tableau III4), lorsqu’il
y a présomption de cancer, l’attention en soins primaires
doit se porter sur l’orientation en pneumologie et l’obten-
tion d’une tomographie axiale, idéalement avec agent de
contraste, de la base du cou jusqu’en dessous des surré-
nales dans un délai de quelques semaines. Le pneumologue
ou l’équipe d’évaluation pourra poursuivre les examens
d’imagerie complémentaires. Toutefois, les symptômes
attirant l’attention (douleur osseuse, céphalées) pourront
aussi faire l’objet d’autres examens en première ligne.
Le syndrome de Pancoast est associé à une tumeur de
l’apex du poumon. La vigilance s’impose en présence d’un
tel tableau clinique, car les symptômes sont souvent
extra tho ra ci ques et peuvent donc entraîner des retards
dia g nos tiques. Ce syndrome se manifeste habituellement
par une douleur à l’épaule qui irradie au bras et qui est liée à
l’invasion du plexus brachial et des tissus adjacents (tissus
mous, côtes ou vertèbres). Le syndrome d’Horner (symp-
tômes unilatéraux de ptose palpébrale, myosis et anhidrose)
provient de l’infiltration de la chaîne sympathique et du
ganglion stellaire. Le médecin doit être particulièrement
attentif à la douleur ainsi qu’à la paresthésie du bras et de la
main dans le territoire de distribution des racines nerveuses
des vertèbres C8 et T12.
QUELS SONT LES EXAMENS PARACLINIQUES
NÉCESSAIRES EN CAS DE CANCER DU POUMON ?
Les examens paracliniques servent à établir précisément
le diagnostic pathologique et le stade selon les modalités
diagnostiques existantes. Une évaluation rapide en pneu-
mologie est souhaitable (tableau IV4).
TABLEAU II SYMPTÔMES QUI DEMANDENT
UNE ORIENTATION À L’URGENCE
h Signes d’obstruction de la veine cave supérieure :
dyspnée, œdème du visage et du bras droit, distension
des vaisseaux sanguins cervicaux et thoraciques
h Stridor
h Hémoptysie massive
h Nouveaux symptômes neurologiques évocateurs
de métastases cérébrales ou de compression médullaire
Source : Del Giudice L, Young S, Vella E et coll. Referral of suspected lung
cancer by family physicians and other primary care providers. Program in
Evidence-based Care Evidence-Based Series No. 24-2. Toronto : Cancer
Care Ontario ; 2011. Site Internet : www.cancercare.on.ca/common/pages/
UserFile.aspx?fileId=104433 (Date de consultation : mai 2014). Repro-
duction autorisée.
TABLEAU III INDICATIONS DE RADIOGRAPHIE
PULMONAIRE
Il est suggéré de procéder rapidement (en quelques jours)
à une radiographie pulmonaire si les symptômes suivants
sont présents :
h hémoptysie
h hippocratisme digital nouveau
h adénopathie douteuse
h dysphagie
h caractéristiques évoquant des métastases à distance :
hépatiques, cérébrales, surrénaliennes, osseuses
h caractéristiques évoquant un syndrome paranéoplasique
OU
Symptômes ou signes persistants parmi les suivants :
h toux
h perte de poids ou d’appétit
h essouement
h douleur au thorax ou à l’épaule
h signes thoraciques anormaux (ex. : sibilances, râles, etc.)
h raucité de la voix
OU
h Personne atteinte de bronchopneumopathie
chronique présentant des changements inexpliqués
de ses symptômes habituels
Source : Del Giudice L, Young S, Vella E et coll. Referral of suspected lung
cancer by family physicians and other primary care providers. Program in
Evidence-based Care Evidence-Based Series No. 24-2. Toronto : Cancer
Care Ontario ; 2011. Site Internet : www.cancercare.on.ca/common/pages/
UserFile.aspx?fileId=104433 (Date de consultation : mai 2014). Repro-
duction autorisée.
26
Le Médecin du Québec, volume 49, numéro 11, novembre 2014

//
FORMATION CONTINUE
LA TOMOGRAPHIE PAR ÉMISSION DE POSITONS
La tomographie par émission de po sitons (PET scan)
constitue un moyen d’évaluation anatomique et métabo-
lique par l’injection du fluorodéoxyglucose (18F-FDG), un
analogue marqué radioactif du D-glucose (18-fluoro-2-
déoxyglucose). Les cellules à forte activité métabolique
accumuleront le 18F-FDG, ce qui permettra de savoir si la
tumeur est maligne ou bénigne. La tomographie par émis-
sion de positons est très utile pour établir le caractère malin
des adénopathies, sa sensibilité et sa spécificité atteignant
80 % et 88 %, respectivement5. Un résultat positif pour le
ganglion du médiastin doit être confirmé par histologie.
LA TOMOGRAPHIE OU LA RÉSONANCE
MAGNÉTIQUE CÉRÉBRALE
La tomographie cérébrale est faite lorsque le patient
présente des symptômes neurologiques. Il s’agit d’un com-
plément d’évaluation nécessaire pour établir le stade du
cancer du poumon.
LA SCINTIGRAPHIE OSSEUSE
La scintigraphie est souvent remplacée par la tomographie
à émission de positons, dont la sensibilité et la spécificité
sont similaires pour la détection de lésions osseuses, et qui
permet en plus l’évaluation des viscères5.
LA RÉSONANCE MAGNÉTIQUE
DU PLEXUS BRACHIAL
La résonance magnétique du plexus brachial est utile en
cas de syndrome de Pancoast.
EXAMENS EN VUE D’UN DIAGNOSTIC
HISTOLOGIQUE
La recherche d'échantillons aux points ayant le plus de
répercussions sur le stade (ex. : biopsie d’une métastase
hépatique) se révèle souvent la plus intéressante, surtout
si la prise en charge s’en trouve modifiée (ex. : chirurgie ou
non). Les différentes modalités diagnostiques pour la lésion
primaire sont présentées dans le tableau V6,7.
À QUOI SERT L'ÉPREUVE DE FONCTION
RESPIRATOIRE DANS LES CAS DE CANCER
DU POUMON ?
La fonction respiratoire influe sur l’approche thérapeutique.
L’épreuve de fonction respiratoire est utile pour prédire les
valeurs postopératoires et le risque opératoire afin d’établir
si l’opération est possible en fonction du stade du cancer8.
QUELS SONT LES FACTEURS PRONOSTIQUES
DU CANCER DU POUMON ?
C’est le stade au moment du diagnostic qui a le plus grand
effet sur l’évolution de l’état du patient et qui dicte les objec-
tifs thérapeutiques (intention curative ou palliative). Pour
le cancer non à petites cellules, la 7e version du système de
classification TNM (Tumors Node Metastasis) a été validée,
TABLEAU V MODALITÉS DIAGNOSTIQUES POUR OBTENIR UN ÉCHANTILLON HISTOLOGIQUE6,7
Méthode diagnostique Sensibilité Spécificité Commentaires
Cytologie des expectorations
(trois échantillons)
TC* : 71 %
TP† : , 50 %
99 %
Thoracocentèse 80 % Plus de 90 % Lorsqu’un épanchement pleural est présent
Bronchoscopie TC : 88 %
TP : 60 % – 70 %
90 %
Biopsie transthoracique à l’aiguille TP : 90 % 97 % Tumeur périphérique chez un sujet non opérable
*TC : tumeurs centrales ; †TP : tumeurs périphériques
TABLEAU IV
INDICATIONS D’ORIENTATION VERS
UN PNEUMOLOGUE, UN CHIRURGIEN
THORACIQUE OU UNE CLINIQUE
D’ÉVALUATION PULMONAIRE
h Hémoptysie persistante
h Radiographie pulmonaire évoquant un cancer :
• nodules ou masses aux poumons ;
• épanchements pleuraux persistants ;
• adénopathies médiastinales ;
• infiltrats interstitiels ;
• pneumonies ou consolidations récidivantes
ou de résolution lente ;
• élévation inexpliquée du diaphragme ;
h Radiographie pulmonaire normale, mais présomption
élevée de cancer selon le jugement clinique
Source : Del Giudice L, Young S, Vella E et coll. Referral of suspected lung
cancer by family physicians and other primary care providers. Program in
Evidence-based Care Evidence-Based Series No. 24-2. Toronto : Cancer
Care Ontario ; 2011. Site Internet : www.cancercare.on.ca/common/pages/
UserFile.aspx?fileId=104433 (Date de consultation : mai 2014). Repro-
duction autorisée.
27
lemedecinduquebec.org

par l’évaluation de plus de 31 000 cas en provenance de
la base de données « Surveillance, Epidemiology and End
Results »9, comme moyen de lier le stade au pronostic.
La survie des patients diminue progressivement pour les
stades plus avancés, à partir d’une médiane de 59 mois
pour le stade IA à une de quatre mois pour le stade IV. Les
chances de récupération lors de maladie avancée sont
minimales. Ainsi, le traitement, qui peut comprendre la
chimiothérapie, vise la palliation.
Le tableau VI10 énumère les stades de la classification
TNM. D’autres facteurs cliniques au moment du diagnostic
peuvent être associés à une survie réduite indépendam-
ment du stade. Ils incluent un pauvre état fonctionnel,
une diminution de l’appétit et une perte de poids. Certains
paramètres biochimiques, tels que la leucocytose, l’hyper-
calcémie chez les personnes atteintes de la forme non à
petites cellules ainsi que l’hypoalbuminémie, se sont aussi
révélés de faibles marqueurs pronostiques11. Tous ces
facteurs reflètent la gravité ou le fardeau de la maladie.
L’échelle « Eastern Cooperative Oncology Group (ECOG)
performance status scale » est une mesure de fonction-
nement général couramment utilisée pour le cancer du
poumon12. En règle générale, la chimiothérapie, même en
mode palliatif, n’apporte aucun bienfait quand le patient est
incapable de prendre soin de lui ou ne peut rester debout
plus de la moitié des heures d’éveil13. L’âge biologique n’est
pas en soi un facteur pronostique.
Pour le cancer à petites cellules, la plupart des médecins
emploient un système qui divise la maladie en stade loca-
lisé ou généralisé. Le stade localisé fait référence à un
cancer avec ou sans atteinte ganglionnaire, confinée à une
aire suffisamment petite pour offrir un traitement de radio-
thérapie à l’aide d’un seul champ de radiation. Le stade
généralisé s’applique à un cancer s’étant propagé aux pou-
mons ou aux ganglions du côté controlatéral ou encore à
la présence de métastases à distance ou d’un épanche-
ment pleural. Quelque 30 % des patients en seront au stade
localisé au moment du diagnostic14. Cette division per-
met de séparer les personnes qui bénéficieraient d’un
traitement plus vigoureux aux stades localisés, c’est-à-
dire d'une chimiothérapie combinée à une radiothérapie,
et ceux chez qui une chimiothérapie seule serait préfé-
rable (maladie généralisée). Le déterminant principal de
la survie en cas de cancer à petites cellules est le degré
de dissémination au moment du diagnostic. Au stade
localisé, la survie médiane est de 16 à 24 mois (14 % après
cinq ans14) contre de 8 à 13 mois (1 % – 2 % après cinq ans)
pour la maladie généralisée14.
EST-CE QUE LE BILAN INITIAL ET SON RETARD
INFLUENT SUR LE PRONOSTIC VITAL
DU PATIENT ?
Plusieurs facteurs peuvent causer un retard diagnostique.
Par exemple, une radiographie pulmonaire faussement
négative y contribue substantiellement. Les médecins
doivent donc être attentifs à la faible sensibilité de la
TABLEAU VI CLASSIFICATION TNM
DU CANCER DU POUMON
Tumeur
T1 Tumeur < 3 cm
T1a Tumeur < 2 cm
T1b Tumeur . 2 cm, mais < 3 cm
T2a Tumeur de . 3 cm, mais < 5 cm
T2b Tumeur de . 5 cm, mais < 7 cm
T3 Tumeur . 7 cm ou invasion de la paroi
thoracique, moins de 2 cm de la carène
ou . 1 nodule dans un même lobe
T4 Envahissement du médiastin, du cœur,
des gros vaisseaux, de la trachée, du nerf
récurrent laryngé, de l’œsophage, du corps
vertébral, de la carène ou nodules dans
diérents lobes ipsilatéraux
Ganglions
N0 Pas de ganglion
N1 Atteinte des ganglions près du hile ipsilatéral
N2 Ganglions du médiastin ipsilatéral
N3 Atteinte ganglionnaire controlatérale
Métastases
M0 Pas de métastases
M1a Épanchement pleural ou péricardique
ou encore nodule métastatique sur le lobe
controlatéral
M1b Métastase ganglionnaire distante
Stades
Stade Ia T1a-1bN0M0
Stade Ib T2aN0M0
Stade IIa T1a-2aN1M0 ou T2bN0M0
Stade IIb T2bN1M0 ou T3N0M0
Stade IIIa T3N1M0 ou T1a-3N2M0 ou T4N0-1M0
Stade IIIb T4N2M0 ou T1a-4N3M0
Stade IV T N M1a-1b
Source : Edge SB, Byrd DR, Compton CC et coll., rédacteurs. AJCC Cancer
Staging Manual (chapitre : Lung cancer) 7e éd. Chicago : Springer ; 2010.
Repro duction autorisée par l’American Joint Committee on Cancer (AJCC),
Chicago, Illinois.
28
Le Médecin du Québec, volume 49, numéro 11, novembre 2014

//
FORMATION CONTINUE
radio graphie pulmonaire en cas de cancer du poumon15.
Également, une orientation initiale vers un spécialiste autre
qu’un pneumologue ou un chirurgien thoracique entraîne
aussi des retards4.
Il est probablement vrai qu’une évaluation rapide et efficace
favorise l’amorce d’un traitement plus tôt, ce qui accroît les
chances de succès. La palliation, le cas échéant, est plus
précoce et la détresse émotionnelle, réduite. Une équipe
multidisciplinaire, constituée de pneumologues, d’oncolo-
gues, de radio-oncologues, de chirurgiens thoraciques, de
spécialistes en soins palliatifs, de pathologistes, de person-
nels infirmiers et de professionnels, permet d’atteindre ces
objectifs et accélère l’évaluation des cas complexes. La dis-
cussion multidisciplinaire est associée à un meilleur accès
aux diverses modalités de traitement et peut augmenter la
qualité de vie des patients16 (tableau VII9,17).
RETOUR AU CAS DE MME BOUCHARD
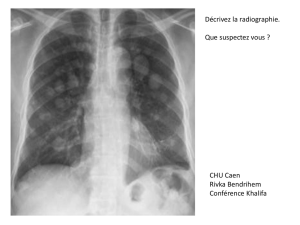
Mme Bouchard présentait des symptômes d’hémoptysie et
de dyspnée légère. Sa radiographie pulmonaire a malheu-
reusement révélé une masse de 3,5 cm x 3,2 cm sur le lobe
supérieur droit. Vous la convoquez en consultation. Paral-
lèlement, vous avisez l’équipe d’évaluation pulmonaire et
demandez une tomographie axiale dans les plus brefs
délais. Vous prévoyez que la patiente sera très inquiète
et voudra déjà tout savoir avant même d’avoir terminé les
examens paracliniques. Vous devez alors connaître les fac-
teurs pronostiques du cancer du poumon afin d’orienter
la discussion. //
Date de réception : le 16 mai 2014
Date d’acceptation : le 8 juin 2014
Les Drs Giovanna Speranza, François Rodier et Céline Devaux n’ont
déclaré aucun intérêt conflictuel.
BIBLIOGRAPHIE
1. Société canadienne du cancer. Comité consultatif de la Société canadienne
du cancer. Statistiques canadiennes sur le cancer 2013. Toronto : Société
canadienne du cancer ; 2013.
2. Ost DE, Yeung SCJ, Tanoue LT et coll. Clinical and organizational factors in the
initial evaluation of patients with lung cancer: diagnosis and management of
lung cancer, 3e éd. : American College of Chest Physicians evidence-based
clinical practice guidelines. Chest 2013 ; 143 (suppl. 5) : e121S-e141S.
3. Gould MK, Donington J, Lynch WR et coll. Evaluation of individuals with pul-
monary nodules: when is it lung cancer? Diagnosis and management of
lung cancer, 3e éd. : American College of Chest Physicians evidence-based
clinical practice guidelines. Chest 2013 ; 143 (suppl. 5) : e93S-e120S.
4. Del Giudice L, Young S, Vella E et coll. Referral of suspected lung cancer by
family physicians and other primary care providers. Program in Evidence-
based Care Evidence-Based Series No. 24-2. Toronto : Cancer Care Ontario ;
2011. Site Internet : www.cancercare.on.ca/common/pages/UserFile.aspx
?fileId=104433 (Date de consultation : mai 2014).
5. Silvestri GA, Gonzalez AV, Jantz MA et coll. Methods for staging non-small cell
lung cancer: diagnosis and management of lung cancer. 3e éd.: American
College of Chest Physicians evidence-based clinical practice guidelines.
Chest 2013 ; 143 (suppl. 5) : e211S-e250S.
TABLEAU VII OBJECTIFS THÉRAPEUTIQUES ET PRONOSTIQUES
POUR LE CANCER DU POUMON NON À PETITES CELLULES9,17
Stades Prise en charge habituelle
Prognostic – Taux
de survie après 5 ans
Ia, Ib h Résection chirurgicale (lobectomie, segmentectomie) si le patient est opérable.
h Si la réserve pulmonaire est insusante, une radiothérapie à visée curative.
h Stade Ia : 75 %
h Stade Ib : 55 %
IIa, IIb h Le traitement de choix est la résection chirurgicale, suivie d’une chimiothérapie
adjuvante si le patient est opérable.
h Radiothérapie à visée curative si le patient est inopérable.
h Stade IIa : 50 %
h Stade IIb : 40 %
IIIa h Chimiothérapie et radiothérapie combinée (radiothérapie concomitante
ou séquentielle).
h Résection chirurgicale, suivie de chimiothérapie adjuvante 6 radiothérapie
pour les patients sélectionnés (N1).
h 10 % – 35 %
(10 % – 15 %
pour IIIa avec
ganglion N2)
IIIb h Chimiothérapie et radiothérapie combinée (concomitante ou séquentielle). , 5 %
IV h Chimiothérapie à base de platine ou thérapie ciblée en cas de mutation moléculaire.
h Résection chirurgicale de métastase solitaire (considération spéciale).
h Radiothérapie.
h Meilleurs soins de soutien.
, 5 %
Tumeur de
pancoast, stade IIIa
(T3N1, T4, N0N1)
h Chimiothérapie associée à la radiothérapie, suivie d’une résection chirurgicale en
l’absence de contre-indication à la chirurgie.
30 % sans résection
54 % avec résection
29
lemedecinduquebec.org
 6
6
1
/
6
100%