? Entretien avec Éric Pujade-Lauraine

??
La Lettre du Cancérologue - Vol. XVI - n° 5 - mai 2007
3 questions à…
3questions à…
188
Entretien avec Éric Pujade-Lauraine (hôpital Hôtel-Dieu, Paris)
à propos de la parution récente de l’article sur l’étude PACA
portant sur le traitement
de seconde ligne des cancers de l’ovaire avancés (1)
>
>
Quels sont les principaux résultats
de l’étude PACA dans le cancer
de l’ovaire en rechute sensible aux sels
de platine ?
Éric Pujade-Lauraine Les chimiothérapies à base de sels de
platine sont des standards dans le traitement de seconde ligne
du cancer de l’ovaire avancé en rechute tardive, donc considéré
comme sensible aux sels de platine. La doxorubicine liposomale
pégylée en monothérapie a déjà démontré son intérêt majeur
dans cette situation puisqu’elle est aujourd’hui le seul traitement
qui permette un allongement de la survie chez des patientes
en rechute sensible lorsqu’il est comparé à un traitement de
référence (2, 3).
Nous avons donc testé l’association PACA à base de doxorubicine
liposomale pégylée et carboplatine (tableau).
Cette étude de phase II a inclus 104 patientes avec un cancer de
l’ovaire en récidive plus de 6 mois après un premier traitement
à base de taxanes et sels de platine. Les doses de l’association
utilisées étaient la doxorubicine liposomale pégylée à la dose de
30 mg/m² et le carboplatine AUC 5. Le traitement était répété
toutes les 4 semaines. Les principaux résultats ont été un taux
de réponse objective de 63 %, avec un taux de réponse complète
élevé de 38 %. La médiane de survie sans progression a été de
9,4 mois et la médiane de survie globale de 32 mois.
En termes de tolérance, la toxicité hématologique a été marquée
par une neutropénie de grade 3/4 dans 51 % des cas mais s’ac-
compagnant d’une neutropénie fébrile chez seulement 3 % des
patientes. Les autres eff ets indésirables ont été relativement peu
nombreux et de faible intensité : grade 1 ou 2 le plus souvent, et
limités à une alopécie et à une toxicité neurologique.
Ces résultats suggèrent ainsi une effi cacité élevée qui permet
d’espérer un allongement de la survie globale au prix d’une
tolérance tout à fait acceptable chez les patientes prétraitées par
un premier traitement à base de taxanes et de sels de platine.
>
>
Comment situer ces résultats par
rapport aux autres alternatives chez
ces patientes ?
E. P-L. Chez les patientes en rechute sensible, le standard de
traitement consiste à reprendre la même combinaison qui a été
utilisée en première intention, c’est-à-dire l’association carbo-
platine + paclitaxel. Ce standard a été défi ni par les résultats
de l’étude ICON 4-OVAR2.2 (4). Cependant, la reprise de ce
traitement effi cace pose des problèmes de deux ordres : d’une
part, l’impact sur la qualité de vie de ces patientes à qui l’on
impose une nouvelle alopécie qui, si elle est acceptable en
première ligne, lors d’un espoir de guérison, l’est plus diffi ci-
lement lorsque l’on entre dans une phase plus chronique de la
maladie ; d’autre part, la tolérance parfois médiocre de cette
association en termes de neuropathie périphérique, d’autant
que certaines gardent encore des séquelles neurologiques de
leur première ligne. Il n’est dans ce cas pas envisageable de
reprendre ce type de traitement, et la question se pose alors
de proposer une chimiothérapie à base de sel de platine aussi
effi cace avec un profi l de tolérance diff érent. Dans ce cadre,
l’association carboplatine + gemcitabine est intéressante, car
peu alopéciante et peu neurotoxique, mais d’administration
délicate chez des patientes prétraitées du fait de son hémato-
toxicité importante. Ainsi, l’association PACA nous semble
une alternative à considérer.
>
>
Quel développement envisagez-vous
aujourd’hui ?
E. P-L. Les résultats de cette étude de phase II chez plus
de 100 patientes sont suffisamment significatifs en termes
d’efficacité et de tolérance pour proposer l’association PACA
en pratique quotidienne. Cependant, pour en faire un stan-
dard de traitement, il faut encore démontrer son équi-effi-
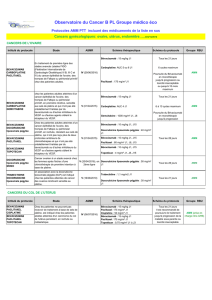
Tableau.
Étude GINECO – carboplatine + doxorubicine liposomale
pégylée (phase II).
PACA
(n = 105, récidive > 6 mois)
RO (RC) 63 % (38 %)
SSP 9,4 m
SG 32 m
Anémie grade 3/4 12 %
Thrombopénie grade 3/4 26 %
Neutropénie grade 3/4 51 %
Alopécie grade 2 12 %
Neuropathie grade 2/3 7 %
D’après Ferrero JM et al. Annals of Oncology 2007.

La Lettre du Cancérologue - Vol. XVI - n° 5 - mai 2007
Entretien
189
Entretien
cacité par rapport au standard carboplatine + paclitaxel.
Pour répondre à cette question, une étude internationale
de phase III menée par le groupe GINECO et huit autres
groupes coopérateurs dans le monde est actuellement en
cours : cette étude CALYPSO (Caelyx
®
in Platinum Sensi-
tive Ovarian cancer) représente la plus grande étude jamais
réalisée chez des patientes atteintes de cancer de l’ovaire en
rechute. Cette étude compare le standard carboplatine +
paclitaxel toutes les 3 semaines à l’association PACA toutes
les 4 semaines, avec un objectif de non-infériorité en termes
de survie sans progression. Un total de plus de 800 patientes
a déjà été inclus en deux ans sur les 970 patientes prévues.
La période d’inclusion devrait donc se terminer à l’été 2007,
avec des résultats attendus courant 2009. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Ferrero JM, Weber B, Geay JF et al. Second-line chemotherapy with pegy-
lated liposomal doxorubicin and carboplatin is highly eff ective in patients with
advanced ovarian cancer in late relapse: a GINECO phase II trial. Ann Oncol
2007;18(2):263-8.
2. Gordon AN, Fleagle JT, Guthrie D et al. Recurrent epithelial ovarian carci-
noma: a randomized phase III study of pegylated liposomal doxorubicin versus
topotecan. J Clin Oncol 2001;19(14):3312-22.
3. Gordon AN, Tonda M, Sun S et al. Long-term survival advantage for women
treated with pegylated liposomal doxorubicin compared with topotecan in a
phase 3 randomized study of recurrent and refractory epithelial ovarian cancer.
Gynecol Oncol 2004;95(1):1-8.
4. Parmar MK, Ledermann JA, Colombo N et al. ICON and AGO Collaborators.
Paclitaxel plus platinum-based chemotherapy versus conventional platinum-
based chemotherapy in women with relapsed ovarian cancer: the ICON4/AGO-
OVAR-2.2 trial. Lancet 2003;361(9375):2099-106.
1
/
2
100%