Lire l'article complet

La Lettre du Cardiologue - n° 307 - février 1999
3
epuis des décennies, il est admis que l’embolie pul-
monaire (EP) est un diagnostic difficile. Elle peut
simuler pratiquement toutes les affections cardio-
pulmonaires et son diagnostic, selon l’orientation clinique ini-
tiale, fait intervenir de nombreuses disciplines médicales. Ce poly-
morphisme symptomatique a longtemps fait considérer la clinique
comme un élément négligeable et peu fiable dans la démarche
diagnostique. Depuis quelques années, la clinique a retrouvé toute
sa valeur avec une prise en compte globale des symptômes asso-
ciée au contexte (postopératoire, cancer) et à l’existence d’anté-
cédents personnels ou familiaux de maladie thromboembolique
(MTE). Cette probabilité clinique est en fait assez bien corrélée
au diagnostic final établi après les explorations complémentaires
dites invasives.
LES EXAMENS COMPLÉMENTAIRES DÉPENDENT
DU CONTEXTE LOCAL
Quel que soit l’arbre décisionnel utilisé, la tendance actuelle est
d’être le moins invasif possible. Toutefois, le choix des examens
complémentaires dépend du contexte local, mais l’analyse et l’in-
terprétation des résultats doivent être rigoureuses et prendre en
compte la valeur d’une réponse positive ou négative pour chaque
examen.
L’EP n’est que l’aspect le plus grave de la MTE ; ainsi l’abord
du diagnostic indirect de l’EP peut se faire à partir de l’écho dop-
pler veineux (EDV) des membres inférieurs. En effet, chez un
patient ayant des symptômes de thrombose veineuse, l’EDV, bien
qu’observateur-dépendant, est très sensible et très spécifique.
Cependant, si on l’utilise de façon systématique en prospectif
dans une série de patients suspects d’EP, la sensibilité de l’EDV
n’est que de 29 % et il permet d’éviter l’angiographie pulmonaire
dans seulement 9 % des cas (1).
La scintigraphie pulmonaire de perfusion (SP) ou, mieux, de
ventilation-perfusion (V/P), est encore le test le plus utile et le
mieux étudié, en dehors de l’angiographie pulmonaire, pour le
diagnostic d’EP. Une perfusion normale permet d’exclure le dia-
gnostic d’EP avec une probabilité supérieure à 95 % ; en revanche,
la présence de critères dits de haute probabilité a une valeur pré-
dictive positive supérieure à 90 % des cas, mais cela ne repré-
sente que 41 % des cas. En fait, dans près de deux tiers des cas,
la scintigraphie est considérée comme non diagnostique et une
EP est effectivement confirmée par l’angiographie dans 4 à 46 %
des cas (2).
Ainsi, le dernier mot dans la démarche diagnostique revient à
l’angiographie pulmonaire, examen dit invasif avec une mor-
talité faible (0,5 %) et un taux de complications variable de 3 à
8%,dont certaines graves (choc anaphylactique, perforation car-
diaque). Il faut savoir cependant que la valeur de cet étalon-or est
toute relative en raison d’une variation interobservateur qui
dépend des caractéristiques techniques et de la qualité de l’an-
giographie, mais aussi du caractère proximal ou distal de l’EP.
Ainsi, dans l’étude PIOPED (3), les experts étaient en désaccord
quant à l’existence d’une EP dans 8 % des cas et dans 17 % des
cas quant à son absence.
L’échocardiographie transthoracique (ETT) a fait l’objet de
nombreuses évaluations et sa place est maintenant bien définie.
Environ 40 % des patients ayant une EP ont une anomalie à l’ETT,
ce qui enlève à cet examen toute valeur pour le dépistage des EP
tout-venant. La sensibilité de l’ETT dépend essentiellement de
la sévérité de l’EP et, devant un tableau clinique d’EP sévère ou
massive, l’ETT a toute sa valeur car elle permet de recueillir des
éléments pronostiques (3). Elle peut révéler des signes de sur-
charge ventriculaire droite et des anomalies de la cinétique du
ventricule droit qui auraient une certaine spécificité (signe de Mac
Connell) et permet de calculer les pressions pulmonaires. L’ETT
écarte rapidement certaines affections pouvant simuler une EP
grave telle que tamponnade, infarctus du ventricule droit, dis-
section aortique. Complétée par un examen transœsophagien dans
les EP proximales, elle visualise le thrombus et autorise la mise
en route de traitements agressifs, thrombolyse ou chirurgie.
ÉDITORIAL
Les nouvelles stratégies diagnostiques devant une suspicion
d’embolie pulmonaire
●B. Charbonnier*
*CHR Trousseau, Tours
D
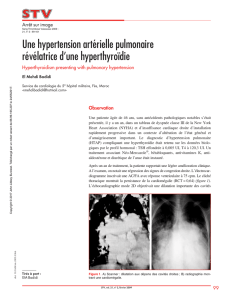
Un examen démonstratif.

La Lettre du Cardiologue - n° 307 - février 1999
4
Le dosage plasmatique des D-dimères, par méthode ELISA, a
pris une place importante à la suite des travaux de nos collègues
suisses (4). Ce test est au mieux utile chez des patients ambula-
toires : un test négatif (taux < 500 µg/l) a une valeur prédictive
négative de 99,5 %. Malheureusement, en général, ce test n’est
pas réalisé la nuit ni le week-end et en urgence. Les performances
des tests rapides par méthode au latex sont à ce jour encore insuf-
fisantes pour qu’on les utilise en routine ; en revanche, un test
ELISA rapide récent (VIDAS D-dimère Biomérieux) semble être
tout à fait fiable, aussi bien pour le diagnostic d’EP que pour celui
de thrombose veineuse profonde.
Le scanner spiralé avec injection intraveineuse de produit de
contraste est en train de chercher sa place dans la démarche dia-
gnostique de l’EP. Pour certains, les résultats sont tels qu’il doit
déjà remplacer la scintigraphie V/P et l’angiographie conven-
tionnelle. Il est à l’évidence peu agressif, avec, comme rare contre-
indication, celle des produits de contraste iodés, et les progrès
techniques en font un examen performant (5). Si on le compare
à l’angiographie, sa sensibilité est supérieure à 90 % et sa spéci-
ficité approche les 80 % avec des valeurs prédictives positive de
100 % et négative de 89 %. Néanmoins, cette technique nouvelle,
encore évolutive, nécessite une réalisation technique parfaite et
une connaissance sans faille des différents aspects de l’EP. La
seule faiblesse actuelle est peut-être l’EP sous-segmentaire iso-
lée (moins de 5 % des cas). Plusieurs études multicentriques éva-
luant le scanner spiralé sont actuellement en cours et permettront
d’apprécier la valeur exacte de cette technique dans le diagnos-
tic de l’EP.
Il est essentiel de connaître la valeur diagnostique du test utilisé
et, en cas de négativité et donc en l’absence de traitement, le risque
potentiel auquel est exposé le patient. Ainsi, après une angiogra-
phie pulmonaire normale, le risque de récidive d’EP à un an est
de 1,6 % (6). Pour la scintigraphie V/P, le risque est nul à 6 mois
(2). L’association scintigraphie V/P non concluante et explora-
tion non invasive des membres inférieurs négative comporte un
risque de récidive de 0,6 % (7). Un dosage de D-dimères infé-
rieur à 500 µg/l expose le patient à un risque de récidive de 1 %
à 3 mois (4). Enfin, le scanner spiralé négatif comporte un risque
de récidive de 3 % à 3 mois (8), mais ce chiffre sera probable-
ment revu à la baisse avec les améliorations techniques et une
meilleure connaissance des utilisateurs dans des séries prospec-
tives plus étoffées.
L’ARBRE DÉCISIONNEL VA VERS UNE SIMPLIFICATION
Ainsi, l’arbre décisionnel diagnostique de l’EP des années 2000
pourrait être extrêmement simplifié. En cas de suspicion clinique
chez un patient ambulatoire, le dosage des D-dimères, notamment
par méthode ELISA rapide, pourrait en être le pivot.
Un test négatif aurait le très grand intérêt d’éviter tout traitement
et toute exploration complémentaires, ce qui serait très rentable
du point de vue médico-économique.
En cas de test positif, le passage direct au scanner spiralé, plus
répandu que la scintigraphie, sera probablement la démarche la
plus efficace et la moins coûteuse, quel que soit le résultat de l’écho
doppler veineux des membres inférieurs, dont on a vu l’intérêt
limité pour le diagnostic indirect d’EP. Il reste à voir quelle sera
la place de la résonance magnétique, examen apparemment idéal,
visualisant le thrombus à la fois dans les artères pulmonaires et le
point de départ veineux, tout cela sans injection de produit iodé.
Mais là, nous sommes déjà dans le XXIesiècle ! ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Turkstra F., Kuljer P.M.M., van Beek E.J.R. et coll. Diagnostic utility of ultra-
sonography of leg veins in patients suspected of having pulmonary embolism. Ann
Intern Med 1997 ; 126 : 775-81.
2. Prospective investigation of pulmonary embolism diagnosis investigators -
Value of the ventilation perfusion scan in acute pulmonary embolism : results of
the Prospective Investigation of Pulmonary Embolism Diagnosis (PIOPED).
JAMA 1990 ; 263 : 2753-9.
3. Kasper W., Konstantinides S., Geibel A., Tiede N., Krause T.Y., Just H.
Prognostic significance of right ventricular afterload stress detected by echocar-
diography in patients with clinically suspected pulmonary embolism. Heart
1997 ; 77 : 346-9.
4. Perrier A., Desmarais S., Goehring C. et coll. D-dimer testing for suspected
pulmonary embolism in D-dimer testing for suspected pulmonary embolism in
out-patients. Am J Resp Crit Care Med 1997 ; 156 : 492-6.
5. Rémy-Jardin M., Rémy J., Deschildre F. et coll. Diagnosis of pulmonary embo-
lism with spiral CT : comparison with pulmonary angiography and scintigraphy.
Radiology 1996 ; 200 : 699-706.
6. Henry J.W., Releyea B., Stein P.D. Continuing risk of thrombo-emboli among
patients with normal pulmonary angiograms. Chest 1995 ; 107 : 1375-8.
7. Hull R.D., Raskob G.E., Ginsberg J. et coll. A non-invasive strategy for the
treatment of patients with suspected pulmonary embolism. Arch Intern Med
1994 ; 154 : 289-97.
8. Ferretti G.R., Bosson J.L., Buffaz P.D. et coll. Acute pulmonary embolism : role
of helical CT in 164 patients with intermediate probability at ventilation-perfu-
sion scintigraphy and normal results at duplex US of the legs. Radiology 1997 ;
205 : 453-8.
ÉDITORIAL
Le tracé électrique n’est pas toujours aussi probant.
1
/
2
100%