Asplénie : Diagnostic et prise en charge chez l'enfant

Médecine
& enfance
ÉTIOLOGIES
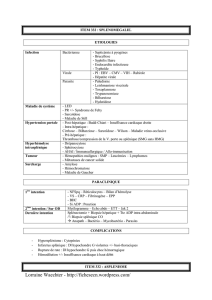
L’asplénie peut être totale ou partielle ;
dans ce dernier cas, on parle d’hypo-
splénie. Le diagnostic est fait par l’écho-
graphie abdominale et la recherche de
corps de Howell-Jolly sur le frottis san-
guin. Une thrombocytose peut être éga-
lement révélatrice de l’asplénie. Les
causes d’asplénie ou d’hyposplénie sont
multiples. L’asplénie ou l’hyposplénie
peuvent être congénitales ou secon-
daires à une radiothérapie, à un traite-
ment immunosuppresseur ou à un geste
chirurgical [1]. L’asplénie congénitale
peut être observée soit de façon isolée,
soit associée dans un syndrome malfor-
matif à une anomalie de rotation des or-
ganes lors du développement, comme
dans le syndrome d’Ivemark. Une splé-
nectomie chirurgicale peut être effec-
tuée après un traumatisme ou pour des
raisons hématologiques et/ou auto-im-
munes (sphérocytose héréditaire, pur-
pura thrombocytopénique immunitaire,
anémie hémolytique auto-immune,
etc.) [1, 2]. L’asplénie fonctionnelle se
définit par la présence anatomique de la
rate et de corps de Howell-Jolly au frot-
tis sanguin. L’asplénie fonctionnelle
peut se voir au cours de certaines mala-
dies hématologiques malignes (lym-
phomes) ou non malignes (sphérocyto-
se héréditaire, drépanocytose ou thalas-
sémie majeure) ; elle peut aussi être se-
condaire à une réaction chronique du
greffon contre l’hôte dans le cadre d’une
greffe de cellules souches hématopoïé-
tiques ou secondaire à une corticothéra-
pie prolongée [1, 2].
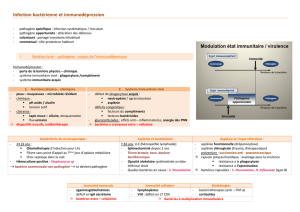
RÔLE DE LA RATE
LORS DES INFECTIONS
BACTÉRIENNES
La rate a un rôle central dans la protec-
tion contre les infections invasives bac-
tériennes et certaines infections parasi-
taires [1]. La rate est importante dans la
défense vis-à-vis de ces pathogènes par
plusieurs mécanismes : rôle dans la fil-
tration des bactéries ou des parasites
présents dans la circulation sanguine,
dans la phagocytose des bactéries et des
parasites opsonisés (facilitation à la
phagocytose), dans la production d’an-
ticorps et de composants du complé-
ment et dans l’activation de composants
du complément permettant l’opsonisa-
tion bactérienne [3, 4]. En cas de splénec-
tomie, l’incidence du risque infectieux
est estimée entre 0,23 et 0,42 % par an
[5], mais elle est plus importante au
cours des deux à trois années suivant la
splénectomie [6]. Le risque infectieux est
plus élevé chez le jeune enfant ; il faut
donc essayer, dans la mesure du pos-
sible, de ne pas splénectomiser un en-
fant avant l’âge de cinq ans, car, avant
cet âge, le système immunitaire est im-
mature vis-à-vis des bactéries encapsu-
Les patients ayant une asplénie fonctionnelle ou anatomique sont expo-
sés à un risque considérablement accru d’infections bactériennes inva-
sives, en particulier causées par les bactéries encapsulées comme
Streptococcus pneumoniae, Haemophilus influenzae de type b et Neis-
seria meningitidis. Le risque est plus élevé chez les enfants en bas âge,
mais les adultes ont aussi un risque accru d’infection bactérienne invasi-
ve. Les stratégies de prévention sont très importantes et se répartissent
en trois grandes catégories : la vaccination, l’antibioprophylaxie et l’édu-
cation. Le risque d’asplénie secondaire dans certaines pathologies est
souvent méconnu, tout comme le risque accru d’infection grave présen-
té par le patient asplénique et la prévention devant être mise en œuvre.
Seront discutés dans cet article les étiologies, le diagnostic, les compli-
cations infectieuses et la nécessité des mesures préventives chez les pa-
tients hypospléniques et aspléniques.
Asplénie : diagnostic et prise en charge
C. Picard, Centre d’étude des déficits immunitaires, hôpital Necker-Enfants Malades, Paris, Laboratoire de génétique humaine des maladies infectieuses,
Inserm U980, faculté de médecine Necker, Paris, université Paris-Descartes
octobre 2011
page 337
e
e
0
-
141856 337-9 17/10/11 20:38 Page337

lées. Le risque infectieux varie aussi en
fonction de la cause de l’asplénie : il est
plus élevé lorsque l’asplénie est secon-
daire à un lymphome ou à une thalassé-
mie que lorsqu’elle est due à une sphé-
rocytose héréditaire [2] ; c’est après les
splénectomies post-traumatiques qu’il
est le plus bas [2].
GERMES
Les infections observées chez les pa-
tients aspléniques sont principalement
des infections à bactéries encapsulées,
avec une incidence qui est dix à cin-
quante fois plus élevée que celle trou-
vée dans la population générale. Les
germes les plus fréquemment isolés
sont Streptococcus pneumoniae, suivi
d’Haemophilus influenzae de type b
puis de Neisseria meningitidis [7].
D’autres agents pathogènes ont pu être
observés lors d’infections invasives à
des fréquences plus élevées que dans la
population générale : Salmonella spp.,
Streptococcus spp., Pseudomonas spp.,
Capnocytophaga canimorsus, Babesia
microti, Plasmodium spp. [1]. Il est à no-
ter que près de 15 % des infections sys-
témiques chez les patients aspléniques
sont polymicrobiennes. La mortalité de
ces infections est de 1,4 à 4,4 % en
moyenne, la majorité des décès surve-
nant dans les vingt-quatre à quarante-
huit premières heures [2, 8, 9].
ÉDUCATION DES PATIENTS
ET DES FAMILLES
Les patients et leurs familles doivent
être clairement informés qu’il y a un
risque infectieux et que ces infections
peuvent mettre en jeu rapidement le
pronostic vital [5]. Les recommandations
sont que toute fièvre inexpliquée est une
urgence médicale et impose une consul-
tation dans les plus brefs délais et/ou
l’administration d’un antibiotique par
voie parentérale. Il faut prévenir les pa-
tients que le risque d’infection est plus
élevé dans les trois premières années
après la splénectomie, mais qu’il sera
probablement présent pour une plus
longue période et peut-être tout au long
de la vie. Il est nécessaire également
d’informer les médecins traitants du pa-
tient qu’il est asplénique et de proposer
au patient de porter une carte informant
de son statut d’asplénique. De plus, les
patients aspléniques devraient éviter
certains voyages ou sinon prendre impé-
rativement des précautions prophylac-
tiques dans les zones où le paludisme et
la babésiose sont endémiques, en raison
du risque vital de ces infections [1, 5].
ANTIBIOPROPHYLAXIE
ET ANTIBIOTHÉRAPIE
CURATIVE
La prophylaxie antibactérienne recom-
mandée dans cette indication est la phé-
noxyméthylpénicilline (Oracilline®), en
raison de son spectre étroit et d’un risque
de sélection de bactéries résistantes mi-
nime. L’utilisation de cet antibiotique a
l’avantage de réserver l’utilisation des cé-
phalosporines au traitement curatif. La
posologie pédiatrique recommandée est
de 100000 UI/kg/j jusqu’à 10 kg et de
50000 UI/kg/j après 10 kg sans dépas-
ser 2 MUI/j, à donner en 2 à 3 prises [7].
La prophylaxie par pénicilline de l’enfant
allergique n’est pas optimale ; dans ces
cas, on propose du triméthoprime-sulfa-
méthoxazole ou de l’érythromycine. La
durée de cette antibioprophylaxie est
controversée ; il faut la maintenir au
moins jusqu’aux cinq ans révolus de l’en-
fant asplénique et, dans le cadre d’une
splénectomie, pendant les trois ans qui
suivent ce geste pour les plus de cinq ans
[1, 10]. Si la compliance est bonne, le
mieux est de poursuivre cette antibiothé-
rapie le plus tard possible.
Une prophylaxie antibiotique est égale-
ment recommandée en cas de contact
avec un individu présentant une infec-
tion invasive à N. meningitidis ou à
H. influenzae de type b [1].
En cas de fièvre chez un patient asplé-
nique, une antibiothérapie empirique
curative doit être proposée [1, 5]. Ces
traitements antibiotiques empiriques ne
sont que des propositions, et il faudra
bien sûr les adapter à la documentation
infectieuse. L’antibiothérapie parenté-
rale usuellement proposée est la cef-
triaxone à la dose de 100 mg/kg/j en
une fois (maximum 2 g) ; pour les sujets
allergiques aux bêtalactamines, le tri-
méthoprime-sulfaméthoxazole et la
clindamycine sont deux alternatives. En
cas de prévalence locale élevée de
souches de pneumocoques résistantes à
la pénicilline, le traitement empirique
devra être fait en association avec la
vancomycine [5].
VACCINS
L’asplénie ou l’hyposplénie ne sont pas
des contre-indications à la vaccination
avec des vaccins vivants ou tués. Les pa-
tients doivent impérativement recevoir
une vaccination antipneumococcique,
anti-Haemophilus et antiméningococ-
cique [1, 5, 7, 11]. En cas de splénectomie
programmée, le patient doit recevoir
ces vaccins au plus tard dans les deux
semaines précédant le geste chirurgical.
Si les vaccinations n’ont pas pu être réa-
lisées avant la splénectomie, elles doi-
vent impérativement être effectuées au
décours de l’intervention.
Le vaccin conjugué antipneumococ-
cique 13-valent, ainsi que le vaccin
conjugué antiméningococcique du
groupe C doivent être utilisés chez les
enfants de moins de deux ans. Pour les
individus âgés de plus de deux ans, il
faut utiliser le vaccin antipneumococ-
cique polysaccharidique 23-valent (non
conjugué) et le vaccin antiméningococ-
cique non conjugué quadrivalent A, C,
Y, W-135. Le vaccin conjugué antipneu-
mococcique 13-valent pourra aussi être
associé chez les patients âgés de plus de
deux ans pour augmenter la réponse
immunitaire vis-à-vis de cette bactérie.
Pour le vaccin antipneumococcique po-
lysaccharidique 23-valent, les rappels
sont à prévoir tous les cinq ans, ou plus
précocement si les taux d’anticorps anti-
pneumococciques sont bas. La vaccina-
tion contre H. influenzae de type b doit
être systématiquement réalisée chez les
enfants non vaccinés de plus de cinq
ans (deux doses à deux mois d’interval-
le) et poursuivie chez les enfants qui
Médecine
& enfance
octobre 2011
page 338
141856 337-9 17/10/11 20:38 Page338

ont déjà été vaccinés avec un rappel
tous les dix ans.
La vaccination annuelle antigrippale
doit être proposée au patient et à sa fa-
mille pour réduire le risque d’infection
bactérienne secondaire à la grippe.
Ces vaccinations sont moins efficaces
lorsqu’elles sont effectuées dans les
mois suivant un traitement par anti-
CD20 chez les patients ayant une cyto-
pénie auto-immune réfractaire aux trai-
tements usuels [12].
CONCLUSION
Les patients aspléniques ou hyposplé-
niques sont à risque très élevé de déve-
lopper des septicémies et/ou des mé-
ningites à germes encapsulés, en parti-
culier à pneumocoque, ce qui souligne
le rôle primordial de la rate dans l’im-
munité antibactérienne encapsulée, très
probablement par un rôle de clairance
des bactéries opsonisées du sang par les
cellules phagocytaires de la rate. Pour
prévenir ces infections pouvant être fa-
tales, ces patients doivent bénéficier
d’une éducation, d’un traitement anti-
bio-prophylactique et de vaccinations
antipneumococcique, anti-Haemophi-
lus et antiméningococcique régulières.
La survenue d’une infection invasive
bactérienne chez un enfant doit faire re-
chercher une asplénie au même titre
qu’un déficit en complément ou un dé-
faut de production d’anticorps [13].
첸
Médecine
& enfance
octobre 2011
page 339
Résumé
Les patients avec une asplénie
congénitale ou ayant une fonction splé-
nique altérée (secondaire à une maladie ou
à une splénectomie) présentent un risque
accru de développer une infection bacté-
rienne invasive, en particulier à germe en-
capsulé, pouvant mettre en jeu le pronostic
vital. Les mesures de prévention reposent
sur trois principes : l’éducation, la vaccina-
tion et l’antibiothérapie prophylactique.
Mots clés
Asplénie, infections invasives
bactériennes, prévention, prophylaxie anti-
infectieuse.
Références
[1] PRICE V.E., DUTTA S., BLANCHETTE V.S., BUTCHART S. et
al. : « The prevention and treatment of bacterial infections in chil-
dren with asplenia or hyposplenia : practice considerations at
the Hospital for Sick Children, Toronto »,
Pediatr. Blood Cancer,
2006 ;
46 :
597-603.
[2] HANSEN K., SINGER D.B. : « Asplenic-hyposplenic overwhel-
ming sepsis : postsplenectomy sepsis revisited »,
Pediatr. Dev.
Pathol.,
2001 ;
4:
105-21.
[3] WELLER S., BRAUN M.C., TAN B.K., ROSENWALD A. et al. :
« Human blood IgM ‘memory’ B cells are circulating splenic mar-
ginal zone B cells harboring a prediversified immunoglobulin re-
pertoire »,
Blood,
2004 ;
104 :
3647-54.
[4] MEBIUS R.E., KRAAL G. : « Structure and function of the
spleen »,
Nat. Rev. Immunol.,
2005 ;
5:
606-16.
[5] CASTAGNOLA E., FIOREDDA F. : « Prevention of life-threate-
ning infections due to encapsulated bacteria in children with hy-
posplenia or asplenia : a brief review of current recommenda-
tions for practical purposes »,
Eur. J. Haematol.,
2003 ;
71 :
319-
26.
[6] SCHUTZE G.E., MASON E.O., JR., BARSON W.J., KIM K.S. et
al. : « Invasive pneumococcal infections in children with asple-
nia »,
Pediatr. Infect. Dis. J.,
2002 ;
21 :
278-82.
[7] LEGRAND A., BIGNON A., BOREL M., ZERBIB P. et al. : « Pré-
vention du risque infectieux postopératoire chez les patients
splénectomisés »,
Ann. Fr. Anesth. Reanim.,
2005 ;
24 :
807-13.
[8] HOLDSWORTH R.J., IRVING A.D., CUSCHIERI A. : « Postsple-
nectomy sepsis and its mortality rate : actual versus perceived
risks »,
Br. J. Surg.,
1991 ;
78 :
1031-8.
[9] BISHARAT N., OMARI H., LAVI I., RAZ R. : « Risk of infection
and death among post-splenectomy patients »,
J. Infect.,
2001 ;
43 :
182-6.
[10] DE MONTALEMBERT M., LENOIR G. : « Antibiotic preven-
tion of pneumococcal infections in asplenic hosts : admission of
insufficiency »,
Ann. Hematol.,
2004 ;
83 :
18-21.
[11] MOURTZOUKOU E.G., PAPPAS G., PEPPAS G., FALAGAS
M.E. : « Vaccination of asplenic or hyposplenic adults »,
Br. J.
Surg.,
2008 ;
95 :
273-80.
[12] BADER-MEUNIER B., ALADJIDI N., BELLMANN F., MON-
POUX F. et al. : « Rituximab therapy for childhood Evans syndro-
me »,
Haematologica,
2007 ;
92 :
1691-4.
[13] PICARD C., PUEL A., BUSTAMANTE J., KU C.L. et al. : « Pri-
mary immunodeficiencies associated with pneumococcal disea-
se »,
Curr. Opin. Allergy Clin. Immunol.,
2003 ;
3:
451-9.
141856 337-9 17/10/11 20:38 Page339
1
/
3
100%