Lire l'article complet

MISE AU POINT
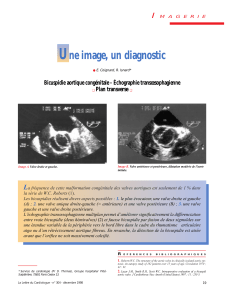
Figure 1. Forme rare de bicuspidie sans raphé : 2 sinus de Valsalva correspondant aux
2 sigmoïdes. Échographie transthoracique, incidence parasternale transverse. A. Diastole,
B. Systole. A : sigmoïde antérieure ; P : sigmoïde postérieure ; OD : oreillette droite ; OG :
oreillette gauche.
La disposition antéro-postérieure des sigmoïdes associée à une insuffisance aortique
minime donne un type 0/A-P/I de la classification de Sievers (2).
14 | La Lettre du Cardiologue Risque Cardiovasculaire • n° 436 - juin 2010
Bicuspidie aortique en 2010 :
diagnostic, histoire naturelle
et prise en charge
Bicuspid aortic valves: from diagnosis to management, 2010 update
J.L. Monin*
* CHU Henri-Mondor, Créteil.
L
a bicuspidie aortique affecte 0,5 à 1 % des
naissances, avec une nette prédominance
masculine (3 garçons pour 1 fille), ce qui en
fait la malformation cardiaque la plus fréquemment
détectée à l’âge adulte. Un certain nombre d’ano-
malies génétiques, biochimiques et histologiques
ont été associées à la bicuspidie, qui touche non
seulement la valve mais également l’ensemble de la
racine aortique (1). Une transmission autosomique
dominante à pénétrance variable pourrait affecter
un ou plusieurs gènes non identifiés ayant un rôle
dans la synthèse et le transport des protéines
élastiques de la média (notamment fibrilline et
NO-synthase). La majorité des sujets atteints de
bicuspidie auront recours à la chirurgie cardiaque au
cours de leur vie, essentiellement pour une valvulo-
pathie aortique, plus rarement pour une pathologie
de l’aorte ascendante. Le rôle du cardiologue est
avant tout de diagnostiquer une bicuspidie, puis de
surveiller l’évolutivité d’une possible valvulopathie
aortique ou d’une dilatation de la racine aortique,
pour une prise en charge globale des éventuelles
complications valvulaires et artérielles.
Diagnostic
échocardiographique
L’échocardiographie joue un rôle clé pour le
diagnostic et le suivi des bicuspidies. Cependant,
jusqu’à une période récente, un grand nombre de
bicuspidies ont probablement été diagnostiquées
tardivement, car nous étions focalisés sur la forme
sans raphé, qui représente seulement 6 à 7 % des
cas (2, 3). Cette forme rare représente une malfor-
mation sévère de la racine aortique, puisqu’elle
comporte authentiquement 2 sigmoïdes aortiques
et 2 sinus de Valsalva (figure 1). Deux articles
fondamentaux de W.C. Roberts et al., publiés en
2005, ont réactualisé nos connaissances sur la
bicuspidie (3, 4). Le message de ces études était
double. Premièrement, si l’on exclut les cas de
rhumatisme articulaire aigu, l’analyse consécutive
de l’ensemble des valves aortiques opérées dans un
grand centre américain révèle que plus de la moitié
des patients sont porteurs d’une malformation
congénitale aortique (bicuspidie dans 49 % des
cas, valve unicuspide dans 5 % des cas). Deuxième-

F i g u re 2 . Forme
commune de bicus-
pidie (71 % des
cas), incidence
parasternale trans-
verse. A. Diastole.
B. Systole. Individua-
lisation de 3 sinus de
Valsalva correspon-
dant aux 3 sigmoïdes ;
un seul raphé (flèche)
entre les sigmoïdes
coronaires gauche
(L) et droite (R), sans
retentissement hémo-
dynamique : type
1/L-R/No de la classi-
fication de Sievers (2).
N : sigmoïde non coro-
naire. OD : oreillette
droite ; OG : oreillette
gauche.
La Lettre du Cardiologue Risque Cardiovasculaire • n° 436 - juin 2010 | 15
Résumé
La bicuspidie aortique est la malformation cardiaque la plus fréquemment rencontrée chez l’adulte, avec
une prévalence de 0,5 à 1 % dans la population générale et une nette prédominance masculine (3/1). La
forme commune de bicuspidie est une symphyse entre les 2 sigmoïdes coronaires avec ouverture valvulaire
“en V inversé”, qu’il ne faut pas confondre avec une valve à 3 sigmoïdes. Le principal risque d’une bicus-
pidie est l’évolutivité précoce d’une valvulopathie aortique. Les complications aiguës liées à la dilatation
de l’aorte initiale sont beaucoup plus rares. En effet, le risque d’anévrisme ou de dissection aortique est
significativement plus élevé en cas de bicuspidie, sans toutefois atteindre le niveau de risque de la maladie
de Marfan. De ce fait, la surveillance d’une valvulopathie aortique et la mesure répétée des diamètres
aortiques sont indispensables pour anticiper les complications valvulaires et artérielles de la bicuspidie.
Mots-clés
Bicuspidie aortique
Valve aortique
Échocardiographie
Dissection aortique
Summary
Bicuspid aortic valve (BAV) is a
common congenital abnormality
affecting 0,5 to 1% of the general
population, with a male/female
ratio of 3/1. In the most frequent
type of BAV, a single raphe is
present between the two coronary
cusps, giving an inversed V-shape
opening of the valve, which may
be misdiagnosed as a three-cuspid
valve. Bicuspid valves are mainly
prone to the development of early
valve stenosis or insufficiency. The
risk of acute aortic dissection or
rupture is higher in BAV-patients
than in the general population;
however it is less frequent than
in patients with Marfan disease.
Thus patients with BAV should be
monitored for the development
of aortic valve complications
and the progressive dilatation of
the ascending aorta in order to
prevent acute aortic complications.
Keywords
Bicuspid aortic valves
Aortic valves
Echocardiography
Aortic dissection
ment, la forme commune de bicuspidie comporte
un raphé entre les 2 sigmoïdes coronaires (donc
3 sinus de Valsalva et la symphyse congénitale de
2 sigmoïdes). Ce raphé est souvent incomplet et
donne une ouverture “en V inversé” qu’il est très
facile de confondre avec une valve à 3 sigmoïdes
(figure 2) [3]. À ce propos, le terme de “pseudo-
bicuspidie” a pu être employé en cas de raphé
unissant 2 sigmoïdes aortiques. Cette pseudo-
forme est en fait la forme commune de bicuspidie,
retrouvée dans 9 cas sur 10 (2, 3). Ces patients ont
donc une anomalie des protéines micro-fibrillaires
de la média et un risque de dilatation de la racine
aortique. Ainsi, le terme de pseudo-bicuspidie,
qui pourrait suggérer une anomalie bénigne ne
justifiant pas de suivi particulier, paraît totalement
inapproprié et devrait être abandonné.
Classification des bicuspidies
Une équipe allemande a proposé, en 2007, une
classification anatomique des bicuspidies (2). Sur
1 206 patients opérés d’une valvulopathie aortique
à l’hôpital universitaire de Lübeck entre 1999 et
2003, 409 (34 %) avaient une malformation
congénitale de la valve aortique. L’étude repose
sur les 304 patients pour lesquels on dispose d’une
description chirurgicale de la valve (2). La classi-
fication comporte un critère majeur (le nombre
de raphés), définissant le type : types 0, 1 ou 2 en
fonction de l’absence ou de la présence de 1 ou
2 raphés (figure 3, p. 16) ; et 2 critères mineurs :
la position spatiale des valves ou des raphés
par rapport aux valves et la fonction valvulaire
(normale, sténose prédominante, insuffisance
prédominante ou sténose + fuite [figure 3, p. 16]).
Ainsi, la forme commune de bicuspidie comporte un
seul raphé (type 1, 88 % des cas pour H.H. Sievers
et C. Schmidtke [2] et 94 % pour W.C. Roberts et
J.M. Ko [3]). Cet unique raphé est le plus souvent
situé entre les sigmoïdes coronaires droite et
gauche (Left-Right [L-R]) avec sténose prédomi-
nante : bicuspidie de type 1/L-R/S (figure 3, p. 16).
Comme souligné précédemment, l’absence de
raphé (type 0) [figure 1] ne représente que 6 à
7 % des cas (2, 3), pour lesquels l’ouverture valvu-
laire ovalaire est plus facile à diagnostiquer que la
forme commune. Le type 2, également appelé valve
unicuspide (3), comporte 2 raphés avec ouverture
excentrée des valves réduite des 2/3 (figure 4,
p. 16), d’où une évolutivité hémodynamique plus
précoce ; la majorité des patients sont opérés de
sténose aortique avant l’âge de 50 ans (3).
Impact de l’anatomie
sur l’évolutivité
Quel est l’intérêt d’un diagnostic anatomique
précis en cas de bicuspidie ? Il semblerait qu’aux
différentes formes anatomiques corresponde une
évolutivité clinique plus ou moins rapide. Ce point
est évident lorsqu’il s’agit d’une valve unicuspide,
dont on a vu l’évolution précoce vers une sténose
aortique chirurgicale. Plus récemment, une étude
hispano-américaine a montré que l’évolutivité
d’une valvulopathie aortique était plus rapide dans
les bicuspidies de type 1 lorsque le raphé intéressait
la sigmoïde non coronaire (5). Cette série compor-
tait 310 patients ayant une bicuspidie de type 1
(âgés de 16 ans en moyenne lors du diagnostic,
71 % d’hommes). Les patients présentaient un raphé
situé entre les 2 sigmoïdes coronaires (type 1/L-R,

Bicuspidie aortique en 2010 :
diagnostic, histoire naturelle et prise en charge
MISE AU POINT
Critère majeur :
Nombre de
raphés
(%)
0 raphé/type 0 1 raphé/type 1 2 raphés/type 2
(7)
(4)
(2)
(2) (2)
(3) (71)
(26)
(0,3)
(0,3)
(0,3)
(39)
(15) (3) (5)
(2)
(2)
(5)
(1)
(1)
(1)
(5)
(2)(5)
(1)
(7)
(5)(88)
Sous-catégorie 1 :
Position des cuspides
(type 0) ou des
raphés (types 1 et 2)
(%)
Latéral Ant-post. L-R N-R N-L N-L/L-R
Sous-
catégorie 2 :
fonction
valvulaire
(%)
I
S
B (I + S)
No
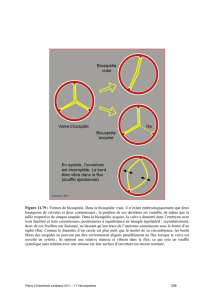
Figure 3. Classification des bicuspidies selon un critère majeur (nombre de raphés) et
2 sous-catégories. L’orientation des schémas est celle d’une vue échographique trans-
thoracique parasternale transverse. I : insuffisance ; S : Sténose ; No : fonction valvulaire
normale. B (Balanced) pour maladie aortique. Les chiffres entre parenthèses représentent
les pourcentages de fréquence pour chaque catégorie. Adapté d’après (2).
Figure 4. Forme rare de bicuspidie (5 % des cas), avec 2 raphés (valve unicuspide). Inci-
dence parasternale transverse (A) ; même incidence zoomée (B).
La disposition des raphés associée à une insuffisance aortique modérée donne un type
2/N-R/L-R/I de la classification de Sievers (2).
16 | La Lettre du Cardiologue Risque Cardiovasculaire • n° 436 - juin 2010
de chirurgie valvulaire aortique est de 1 patient
sur 10 en cas de type 1/ L-R contre 4 patients sur
10 dans le type 1/ N-R. Une des hypothèses pour
expliquer cette évolutivité précoce serait la surface
plus large de la sigmoïde non coronaire en cas de
bicuspidie, d’où une limitation d’ouverture plus
importante et une forte contrainte mécanique
entraînant une altération valvulaire plus rapide.
La même équipe avait publié auparavant une série
de 1 135 enfants et adolescents (67 % de garçons)
ayant une valve bicuspide (6). Il en ressortait que
la forme commune de bicuspidie (type 1/L-R, 70 %
des cas) était volontiers associée à une coarcta-
tion avec une évolutivité valvulaire plus lente. À
l’opposé, le type 1/N-R évoluait plus vite vers une
valvulopathie significative, sans être associée à
une coarctation (6).
Bicuspidie :
maladie de la racine aortique
La bicuspidie s’accompagne, dans la plupart des
cas, d’une dilatation de la racine aortique. Plusieurs
études sont en faveur d’une déficience des protéines
micro-fibrillaires de la média, sans qu’il y ait de
mutation du gène FBN1 de synthèse de la fibril-
line, à la différence de la maladie de Marfan (7).
L’hypothèse actuellement retenue par certains
auteurs serait une anomalie de l’ARN transcripteur
contrôlant le transport extracellulaire de la fibrilline
et/ou de la NO-synthase (7). Une étude italienne
portant sur 20 000 conscrits (âge moyen : 18 ans)
a permis de diagnostiquer 167 cas de bicuspidie à
l’échocardiographie (0,8 % de la cohorte), dont
50 % présentaient déjà une insuffisance aortique
minime à modérée, et 12 %, une fuite moyenne à
sévère (8). En cas de bicuspidie, l’ensemble de la
racine aortique est dilaté par rapport aux sujets
contrôle du même âge, d’autant plus qu’il existe
une fuite aortique (figure 5, tableau). Dans ce
cas, l’insuffisance aortique est souvent liée à un
certain degré de prolapsus valvulaire et aggravée
par la dilatation du culot aortique. L’insuffisance
valvulaire est donc à la fois cause et conséquence
de la dilatation aortique (1, 8).
Histoire naturelle
des bicuspidies
Le risque évolutif d’une bicuspidie est avant tout
valvulaire, les complications aortiques étant plus
n = 202) ou entre la sigmoïde coronaire droite et la
sigmoïde non coronaire (type 1/N-R, n = 108). Les
résultats montrent que, à l’âge de 20 ans, le taux

MISE AU POINT
Figure 5. Différents sites de mesure du culot aortique : échographie transthoracique
en incidence parasternale longitudinale et schéma correspondant. L’effacement de la
jonction sino-tubulaire est fréquemment retrouvé en cas de bicuspidie. A : anneau ;
1 : sinus de Valsalva ; 2 : jonction sino-tubulaire ; 3 : portion ascendante.
La Lettre du Cardiologue Risque Cardiovasculaire • n° 436 - juin 2010 | 17
rares. Par ordre de fréquence, la survenue d’une
sténose aortique est le premier risque. La bicuspidie
représente actuellement entre 30 et 50 % des cas
de rétrécissement aortique opérés dans les pays
occidentaux (2, 3), l’âge moyen à l’intervention
étant de 67 ± 11 ans en cas de bicuspidie contre
74 ± 8 ans en cas de valve à 3 sigmoïdes (3). Deux
séries récentes donnent une idée assez précise des
risques encourus en cas de bicuspidie aortique. Une
première série canadienne regroupe 642 patients
consécutifs examinés dans un grand centre de
cardiopathies congénitales adultes entre 1994
et 2001 (9). À l’entrée dans l’étude, l’âge moyen
était de 35 ± 16 ans et 68 % étaient des hommes.
Une coarctation était associée dans 25 % des cas,
le plus souvent traitée par voie chirurgicale ou
endovasculaire (150/159) ou sans retentissement
hémodynamique. L’ensemble de la cohorte a été
suivi pendant 9 ± 5 ans, 40 % des patients ayant
été suivis plus de 10 ans (9). Le premier résultat
est que le taux de mortalité de cause cardiaque
est de 0,3 % par an, sans différence significative
par rapport à un groupe contrôle apparié sur le
sexe et l’âge (p = 0,71). Après 9 ans de suivi moyen,
une complication aortique est survenue chez
11 patients (2 %) dont 5 dissections aortiques (taux
annuel de dissection : 0,1 %). À l’opposé, le taux
de complications valvulaires est plus important :
84 patients opérés d’un rétrécissement aortique
(13 %), 37 opérés pour insuffisance aortique (6 %)
et 10 pour endocardite aortique, dont la prévalence
annuelle était de 0,3 % (9). La survie à 9 ans de
cette cohorte n’était pas significativement altérée
par rapport à la population contrôle, l’essentiel
des complications étant valvulaires, avec un taux
d’accidents aortiques aigus nettement inférieur à
celui observé dans la maladie de Marfan (9). Ces
résultats concordent avec ceux d’une cohorte de
212 patients diagnostiqués à la Mayo Clinic entre
1980 et 1999 (10). Comme l’étude précédente, il
s’agissait de jeunes adultes (32 ± 20 ans), majori-
tairement de sexe masculin (65 %). À l’entrée dans
l’étude, tous les patients étaient asymptomatiques
et indemnes de valvulopathie significative ou d’at-
teinte de la fonction ventriculaire gauche (fraction
d’éjection moyenne : 63 ± 5 %, diamètre télédias-
tolique : 48 ± 9 mm). Après 20 ans de suivi, les
taux de chirurgie valvulaire aortique ou de chirurgie
de l’aorte ascendante étaient respectivement de
24 ± 4 % et 5 ± 2%, sans pour autant que la survie
globale soit diminuée par rapport à la population
contrôle (p = 0,72). Aucune dissection aortique
n’est survenue dans cette série.
Chirurgie prophylactique
de l’aorte ascendante :
le problème des 50 mm
En cas de bicuspidie, le risque de dissection aortique
est réel. Il serait 9 fois plus élevé que dans la popu-
lation générale, de l’ordre de 5 à 6 % au cours d’une
vie. Cependant, ce risque est encore plus élevé dans
la maladie de Marfan, où il est estimé à 40 % au cours
d’une vie (1). Étant donné que la bicuspidie est 50 à
100 fois plus fréquente que la maladie de Marfan, ces
deux pathologies sont présentes en proportions égales
(5 % des cas) dans les grands registres de syndromes
aortiques aigus tel l’IRAD (International Registry of
acute Aortic Dissection) [11]. De ce fait, les recom-
mandations américaines et européennes insistent
particulièrement sur les modalités de surveillance de
la racine aortique en cas de bicuspidie : une échocar-
diographie (voire un scanner ou une IRM en cas de
Tableau. Diamètres des différents segments de la racine aortique chez 167 cas de bicuspidie
(Tous), avec et sans insuffisance aortique (I Ao), comparés à 87 sujets contrôles. Toutes compa-
raisons versus groupe contrôle et intergroupes avec et sans I Ao : p < 0,001. Adapté d’après (8).
Diamètre (mm) Contrôle
(n = 87)
Bicuspidie
Tous
(n = 167)
Bicuspidie
sans I Ao
(n = 48)
Bicuspidie avec I Ao
(n = 110)
Anneau 22 ± 2 25 ± 3 23 ± 2 26 ± 3
Sinus de Valsalva 27 ± 3 33 ± 4 32 ± 3 34 ± 4
Jonction sino-tubulaire 25 ± 2 30 ± 4 28 ± 3 31 ± 4
Portion ascendante 25 ± 2 30 ± 4 28 ± 3 31 ± 4

Bicuspidie aortique en 2010 :
diagnostic, histoire naturelle et prise en charge
MISE AU POINT
18 | La Lettre du Cardiologue Risque Cardiovasculaire • n° 436 - juin 2010
1. Tadros TM, Klein MD, Shapira OM. Ascending aortic dilatation
associated with bicuspid aortic valve: pathophysiology, molecular
biology, and clinical implications. Circulation 2009;119:880-90.
2. Sievers HH, Schmidtke C. A classification system for the bicuspid
aortic valve from 304 surgical specimens. J Thorac Cardiovasc
Surg 2007;133:1226-33.
3. Roberts WC, Ko JM. Frequency by decades of unicuspid,
bicuspid, and tricuspid aortic valves in adults having isolated
aortic valve replacement for aortic stenosis, with or without
associated aortic regurgitation. Circulation 2005;111:920-5.
4. Roberts WC, Ko JM, Hamilton C. Comparison of valve struc-
ture, valve weight, and severity of the valve obstruction in 1849
patients having isolated aortic valve replacement for aortic valve
stenosis (with or without associated aortic regurgitation) studied
at 3 different medical centers in 2 different time periods. Circu-
lation 2005;112:3919-29.
5. Fernandes SM, Khairy P, Sanders SP, Colan SD. Bicuspid aortic
valve morphology and interventions in the young. J Am Coll
Cardiol 2007;49:2211-4.
6. Fernandes SM, Sanders SP, Khairy P, et al. Morphology of
bicuspid aortic valve in children and adolescents. J Am Coll
Cardiol 2004;44:1648-51.
7. Fedak PW, Verma S, David TE, Leask RL, Weisel RD, Butany J.
Clinical and pathophysiological implications of a bicuspid aortic
valve. Circulation 2002;106:900-4.
8. Nistri S, Basso C, Marzari C, Mormino P, Thiene G. Frequency of
bicuspid aortic valve in young male conscripts by echocardiogram.
Am J Cardiol 2005;96:718-21.
9. Tzemos N, Therrien J, Yip J et al. Outcomes in adults with
bicuspid aortic valves. Jama 2008;300:1317-25.
10. Michelena HI, Desjardins VA, Avierinos JF et al. Natural history
of asymptomatic patients with normally functioning or minimally
dysfunctional bicuspid aortic valve in the community. Circulation
2008;117:2776-84.
11. Pape LA, Tsai TT, Isselbacher EM et al. Aortic diameter ≥ 5.5 cm
is not a good predictor of type A aortic dissection: observations
from the International Registry of acute Aortic Dissection (IRAD).
Circulation 2007;116:1120-7.
12. Bonow RO, Carabello BA, Kanu C et al. ACC/AHA 2006
guidelines for the management of patients with valvular heart
disease: a report of the American College of Cardiology/American
Heart Association Task Force on Practice Guidelines. Circulation
2006;114:e84-231.
13. Vahanian A, Baumgartner H, Bax J et al. Guidelines on the
management of valvular heart disease: The Task Force on the
Management of Valvular Heart Disease of the European Society
of Cardiology. Eur Heart J 2007;28:230-68.
14. Guntheroth WG. A critical review of the American College of
Cardiology/American Heart Association practice guidelines on
bicuspid aortic valve with dilated ascending aorta. Am J Cardiol
2008;102:107-10.
15. Elefteriades JA. Natural history of thoracic aortic aneurysms:
indications for surgery, and surgical versus nonsurgical risks. Ann
Thorac Surg 2002;74:S1877-80; discussion S1892-8.
16. Davies RR, Gallo A, Coady MA et al. Novel measurement of
relative aortic size predicts rupture of thoracic aortic aneurysms.
Ann Thorac Surg 2006;81:169-77.
Références bibliographiques
mauvaise échogénicité) doit être répétée annuellement
en cas de diamètre aortique supérieur à 40 mm (ou
> 21 mm/m2). D’après les mêmes recommandations,
un remplacement chirurgical prophylactique de l’aorte
ascendante est indiqué si le diamètre aortique dépasse
50 mm, ou en cas de progression annuelle supérieure à
5 mm (12, 13). Le problème de ces recommandations
est qu’il n’existe actuellement aucune étude d’enver-
gure prouvant le bien-fondé de ces valeurs seuil, large-
ment extrapolées d’après les statistiques de la maladie
de Marfan (14). De plus, une large étude du registre
IRAD a bien démontré que le diamètre aortique, à lui
seul, était un mauvais facteur prédictif de dissection
(11). En effet, sur une série de 591 dissections touchant
l’aorte ascendante, le diamètre aortique mesuré à l’ad-
mission était inférieur à 55 mm dans 60 % des cas et
inférieur à 50 mm dans 40 % des cas. En outre, dans
cette série, le diamètre aortique n’était pas corrélé à
la mortalité hospitalière (11).
Faut-il indexer les diamètres
aortiques ?
L’application stricte de la règle des 50 mm, entraînant
de facto l’indication opératoire chez un patient asymp-
tomatique sans valvulopathie chirurgicale, pose donc
problème à un certain nombre de praticiens (11, 14).
Cependant, on ne peut pas nier que le risque de dissec-
tion/rupture aortique augmente significativement en
cas de dilatation extrême de l’aorte (> 60 mm) [15].
Le groupe de Yale a proposé d’indexer les diamètres
aortiques à la surface corporelle afin de mieux prédire
le risque de complication aiguë (16). Sur une cohorte
de 805 patients suivis pour anévrisme aortique, le taux
annuel cumulé de dissection, rupture aortique ou décès
augmentait assez brutalement (de 4 à 10 %) lorsque
le diamètre aortique indexé dépassait 27 mm/ m
2
(16).
Ces données s’appliquent essentiellement à une popu-
lation non Marfan, comportant peu de bicuspidies,
puisque les coarctations ont été exclues de cette étude.
À titre d’exemple, le seuil des 27 mm/ m2 est franchi à
55 mm de diamètre aortique pour un homme ayant
une surface corporelle de 2,0 m2 et pour un diamètre
aortique de 45 mm chez une femme ayant une surface
corporelle de 1,6 m
2
. Ces valeurs montrent bien la diffi-
culté d’appliquer globalement la règle des 50 mm, mal
adaptée aux différents gabarits individuels, notamment
chez les femmes.
Conclusion
Une prise en charge globale des patients ayant une
bicuspidie passe par un diagnostic précis reposant quasi
exclusivement sur l’échocardiographie transthoracique.
La redécouverte récente des différentes formes anato-
miques et la classification de Sievers éclairent cette
pathologie d’un jour nouveau. Le risque évolutif d’une
bicuspidie est avant tout valvulaire, et il n’y a pas de
spécificité dans le management et la décision théra-
peutique d’une valvulopathie aortique sur bicuspidie
par rapport aux autres étiologies. Les complications
aortiques aiguës sont beaucoup plus rares. S’il est vrai
que le risque de dissection aortique est plus élevé en
cas de bicuspidie par rapport à la population générale,
il est cependant très nettement inférieur au risque de la
maladie de Marfan. D’après les recommandations inter-
nationales, la surveillance annuelle des diamètres de la
racine aortique par échocardiographie, scanner ou IRM
est indiquée en cas de dilatation supérieure à 40 mm
(ou > 20 mm/m2). D’après ces mêmes recommanda-
tions, la chirurgie prophylactique de l’aorte ascendante
est indiquée en cas de dilatation supérieure à 50 mm,
y compris chez un patient asymptomatique sans valvu-
lopathie significative. Cette valeur seuil de 50 mm ne
repose malheureusement sur aucune preuve scienti-
fique solide. En pratique, le diamètre aortique indexé à
la surface corporelle pourrait être une aide à la décision
thérapeutique dans les cas difficiles, avec une valeur
seuil de 25 à 27 mm/m2 ne figurant pas explicitement
dans les recommandations actuelles. ■
1
/
5
100%