Cancer de l`endomètre : quand demander une enquête

COLLÈGE NATIONAL
DES GYNÉCOLOGUES ET OBSTÉTRICIENS FRANÇAIS
Président : Professeur J. Lansac
Extrait des
Mises à jour
en Gynécologie
et Obstétrique
–
TOME XXXII
publié le 3.12.2008
TRENTE-DEUXIÈMES JOURNÉES NATIONALES
Paris, 2008

369
Le cancer de l’endomètre est d’origine génétique dans moins de
5 % des cas. Les principaux gènes connus de prédisposition au cancer
de l’endomètre sont les gènes dits MMR (pour Mismatch repair), c’est-
à-dire essentiellement les gènes MSH2, MLH1, MSH6 et PMS2 qui sont
aussi des gènes de prédisposition au cancer colorectal dans le cadre du
syndrome HNPCC (Hereditary Non Polyposis Colorectal Cancer). On
connaît d’autres gènes plus rarement responsables de cancer hérédi-
taire de l’endomètre comme le gène PTEN, dans le cadre du syn-
drome de Cowden. Le reste de l’exposé se focalisera sur le cancer de
l’endomètre dans le cadre du syndrome HNPCC.
DÉFINITION DU SYNDROME HNPCC
Le syndrome HNPCC (ou syndrome de Lynch) est un syndrome
à transmission autosomique dominante caractérisé par l’apparition de
cancers de nature variée à un âge jeune (< 45 ans), et par un phéno-
* Service Histologie-Biologie Tumorale - Hôpital Tenon - 4 rue de la Chine - 75020 Paris
Cancer de l’endomètre :
quand demander une enquête
oncogénétique ?
A. FAJAC *
(Paris)

type particulier des cellules tumorales: l’instabilité des microsatellites
ou MSI (Microsatellite instability). Les cancers les plus fréquents sont les
cancers colorectaux et de l’endomètre.
Plusieurs groupes de travail internationaux ont tâché de standardi-
ser les critères diagnostiques du syndrome HNPCC. Les critères initia-
lement définis en 1991, dits d’Amsterdam I, sont des critères stricts ne
prenant en compte que les cancers colorectaux [1]. Ces critères sont :
— au moins trois apparentés atteints de cancer colorectal histolo-
giquement prouvé ;
— un des apparentés est lié au premier degré avec les deux autres;
— au moins deux générations successives sont atteintes;
— un des cancers est diagnostiqué avant l’âge de 50 ans ;
— il est exclu la polypose rectocolique familiale.
En 1999, ces critères sont élargis pour prendre en compte les can-
cers extra-coliques, dits du spectre étroit du syndrome HNPCC consti-
tuant les critères d’Amsterdam II [2]. Les cancers appartenant au
spectre étroit du syndrome HNPCC sont, outre le cancer colorectal,
les cancers de l’endomètre, de l’intestin grêle, de la vessie et des voies
urinaires. Le premier critère est donc modifié comme suit : au moins
trois apparentés atteints de cancer appartenant au spectre étroit du
syndrome HNPCC histologiquement prouvé. Les autres critères sont
inchangés.
Le syndrome HNPCC comporte aussi des cancers de l’ovaire,
des voies biliaires et de l’estomac (spectre dit large du syndrome
HNPCC). Des tumeurs cutanées (adénome et adénocarcinome séba-
cés, kératoacanthome) et cérébrales (glioblastome) peuvent également
être observées, définissant alors les syndromes de Muir-Torre et de
Turcot, respectivement.
Afin de mieux prendre en compte toutes ces tumeurs extra-
coliques et d’optimiser ainsi le diagnostic de syndrome HNPCC, un
groupe de travail international a défini des critères cliniques devant
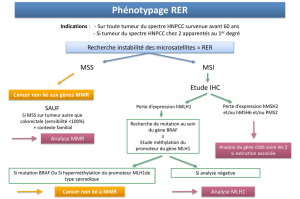
conduire à une étude du phénotype tumoral à la recherche d’une MSI,
cette étude étant techniquement moins lourde que la recherche de
mutation des gènes MMR : les critères de Béthesda établis en 1997 [3]
et révisés en 2004 [4] (Tableau I). Si un phénotype MSI est présent,
une analyse moléculaire des gènes MMR est secondairement réalisée.
370
FAJAC

GÈNES DU SYNDROME HNPCC
Plusieurs gènes responsables du syndrome HNPCC ont été identifiés
dans les années 1990. Il s’agit des gènes MMR MSH2 [5], MLH1 [6],
MSH6 [7] et PMS2 [8]. Les produits de ces gènes ont un rôle clé dans
un type spécifique de réparation de l’ADN qui est très important : la
réparation des erreurs d’appariements de l’ADN, erreurs qui se pro-
duisent lors des divisions cellulaires. Dans une tumeur due à une
mutation d’un gène MMR, le dysfonctionnement de ce mécanisme de
réparation entraîne une accumulation d’erreurs au niveau de l’ADN
et, plus particulièrement, au niveau des séquences répétées de l’ADN
que sont les microsatellites. Les « erreurs » présentes au niveau des
microsatellites sont des mutations de type délétions ou insertions de
quelques nucléotides et définissent le phénotype dit instable.
Parmi les quatre gènes cités plus haut, les mutations les plus fré-
quentes sont celles des gènes MSH2 et MLH1 qui représentent envi-
ron 90 % des familles chez lesquelles une mutation est identifiée.
Cependant, les histoires familiales comportant de nombreux cas de
cancer de l’endomètre comparativement au cancer colorectal sont
souvent dues à une mutation de MSH6.
371
CANCER DE L’ENDOMÈTRE :QUAND DEMANDER UNE ENQUÊTE ONCOGÉNÉTIQUE ?
Tableau I : Critères de Béthesda révisés
Indications à une recherche de MSI
1. Cancer colorectal diagnostiqué avant 50 ans
2. Présence de deux cancers du spectre HNPCC* synchrones ou métachrones chez un même
patient quel que soit l’âge
3. Cancer colorectal avec histologie évocatrice** diagnostiqué avant 60 ans
4. Cancer du spectre HNPCC chez deux apparentés au premier degré avec un des cancers
diagnostiqué avant 50 ans
5. Cancer du spectre HNPCC chez trois apparentés au premier degré ou deuxième degré quel
que soit l’âge
*Spectre HNPCC : les cancers associés au syndrome HNPCC sont les cancers colorectaux,
endométriaux, du grêle, de la vessie et des voies urinaires (spectre étroit), de l’ovaire, des voies
biliaires et de l’estomac (spectre large). Il s’agit dans tous les cas d’adénocarcinome.
**Histologie évocatrice : tumeur comportant un infiltrat lymphoïde ou une réaction lymphocytaire
de type Maladie de Crohn ou des cellules mucineuses en bague à chaton ou tumeur ayant un
aspect médullaire.

RISQUE DE CANCER DE L’ENDOMÈTRE
ET DES AUTRES CANCERS
Des valeurs précises du risque de cancer associé au syndrome
HNPCC, et en particulier du risque de cancer de l’endomètre, ne sont
pas disponibles. Les risques de cancer sont probablement différents
selon le gène MMR en cause. Le risque de cancer colorectal serait
plus faible chez les sujets porteurs de mutation du gène MSH6 que
chez ceux porteurs d’une mutation des gènes MLH1 ou MSH2, mais
le risque de cancer de l’endomètre ne serait pas différent.
Chez une femme porteuse d’une mutation constitutionnelle délé-
tère d’un gène MMR, le risque cumulé de cancer de l’endomètre varie
selon les études de 40 % à 60 % avec un âge moyen au diagnostic de
50 ans [9-10]. Des données récentes montrent que le risque est proba-
blement plus faible et d’environ 30 % à 40 % [11].
Quant au risque de cancer colorectal d’un sujet porteur d’une
mutation d’un gène MMR, il est d’environ 50 à 60 % et semble moins
élevé chez la femme que chez l’homme : 30 à 40 % chez la femme et
70 à 80 % chez l’homme [10, 12].
Le risque des autres cancers est répertorié au tableau II.
DIAGNOSTIC DE SYNDROME HNPCC
La confirmation biologique du diagnostic clinique de syndrome
HNPCC doit être réalisée chez un sujet atteint de cancer et repose sur
372
FAJAC
Tableau II : Risque des cancers du syndrome HNPCC (d’après [14])
Site Risque cumulé (%)
Côlon-rectum 50-60
Femme 30-40
Homme 70-80
Endomètre 30-40
Intestin grêle 1-5
Vessie, Voies urinaires 5
Ovaire 8
Voies biliaires 5
Estomac 5-10
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%