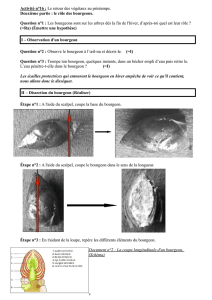
Morphogenèse crâniofaciale et odontogenèse

1
DrAgnèsBLOCH‐ZUPAN
Professeur desUniversités – Praticien Hospitalier
Morphogenèse crâniofaciale etOdontogenèse
UESpécifique Odontologie ‐PremièreAnnée CommuneauxEtudesdeSanté
Année 2012‐2013
Collège
National des
Enseignants en
Sciences
Biologiques
Odontologiques
Chapitre 3:Miseenplacedelaface
etdelacavité buccale
Nousaborderonsdanscecourslamiseenplacedelafaceetledéveloppement
delacavité buccalenotammentdupalais.
Lesobjectifs sontlessuivants:
‐décrirelamiseenplacedesbourgeonscrâniofaciaux etleurdevenir
‐identifierlesstructuresconcernéessurdesschémasetêtrecapablede
redessinerlesgrandesétapesdecedéveloppement
‐replacerl’origineembryologiquedecesstructures
‐connaîtrelachronologiedesévènements.
Lesaspectsmoléculairesliés à lamiseenplacedeceséléments,etleurdevenir
serontévoqués.

2
(SourisRARElacZ;sourceMRHINN,Institut deGénétique etdeBiologie Moléculaire etCellulaire IGBMC)
1.Introduction
1.1.Evolutiondudéveloppement embryonnaire
1.Introduction
Lamiseenplacedelafaceetdelacavité buccales’effectueentrelaquatrième
etladixièmesemainedudéveloppementchezl’hommeetestindissociable
delaformationdesarcspharyngésetdeleurcolonisationparlescellules
issuesdescrêtesneuralescéphaliques.
1.1.L’évolutiondudéveloppementembryonnairechezlasourisgénétiquement
modifiéeprésentéesurcesimagesillustrebienlesprofondsremaniements
nécessairesàlaformationdumassifcrâniofacial.L’âgedel’embryonest
donné ennombredesomitesetensuiteenjourE(laduréedegestationchez
lasourisestd’environ19jours).Cessouristransgéniquespossèdentun
élémentderéponseàl’aciderétinoïquelié aulacZ quipermetuncriblede
sélectionparlacolorationbleue(soiticilaconstructionRARElacZ).
Lacolorationbleuemarqueainsileszonesoù l’activité aciderétinoïqueest
effective(objectivéeparlaproductiond’aciderétinoïquelemétaboliteactif
delavitamineAourétinol).
RegardezainsiaujourembryonnaireE9.5lemassifcrâniofacial signalé parune
flèche.
L'aciderétinoïqueestunemoléculeindispensableaudéveloppement,ellepeut
aussiserévélerunpuissanttératogène(c’estàdireunesubstanceouun
procédé quiprovoquedesmalformationschezl’embryonoulefoetus quand
lamèreestexposée)affectantenparticulierledéveloppementdelafaceet
dupalais.

3
1.2.Coupesfrontales desouris E10.5
Foxg1‐Cre;ROSA26R
(sourceM.RHINN,IGBMC)
1.2.CoupesfrontalesdesourisE10.5Foxg1‐Cre;ROSA26R
Surcescoupesfrontalesdesourisgénétiquementmodifiées(parune
constructiondifférentenomméeFoxg1‐Cre;ROSA26R)aujourE10.5du
développementembryonnaire,lacolorationbleutée(à labéta‐galactosidase)est
unmarqueur,entreautre,desdérivésdescrêtesneuralesetseretrouvetout
autourdelacavité buccale(voirflèche)enparticulierdanslesarcspharyngés.

4
Audébutdelasemaine4dudéveloppementhumainlesrégions
crâniales etcervicales(cou)constituentenviron1/2delalongueurde
l’embryon.Lafaceendéveloppementestreprésentéeparlarégion
frontonasale etlepremierarcpharyngé.
Jour21/22
Embryon
rectiligne
Neuropore
cranial
Somites
Tube
neural
fermé
Neuropore
caudal
Jour24
Bourgeon
frontonasal
1erarc
2èmearc
Dépression
otique
Saillie
cardiaque
2.Mise enplacedelaface
2.1.Lasemaine 4
2.Mise enplacedelaface
2.1.Lasemaine 4
Toutcommenceàlaquatrièmesemainedudéveloppement.
‐L’embryonmesureentre2(début)et5(fin)millimètres.Lesrégionscrâniales et
cervicales(cou)constituentenvironlamoitié delalongueurdel’embryon.
‐Audébutdela4èmesemaine,l’embryonestencorerectiligne.Lessomitesforment
dessailliesnettementvisiblesàsasurface(le1ersomiteestapparuau20èmejour).
Leurnombresertàexprimerl’âgedel’embryonjusqu’à lafindela4èmesemainequi
correspondaustadededéveloppement28somites.Letubeneuralestfermé enregard
dessomitesmaisestouvertauniveaudesneuropores.
‐Lesplislimitantcéphaliqueetcaudalapparaissentrespectivementau22èmeetau
23èmejours.
‐Au24èmejour,leneuropore crânial seferme.Acemomentles2premiersarcs
branchiauxsontvisibles.Lecœurconstitueunevolumineusesailliesousl’embryon.
‐Aujour26,leneuropore postérieurseferme.Troisarcsbranchiauxsontvisibles.Ilya
apparitionauniveaudel’encéphale,descourburesmésencéphalique etcervicale.
L’ébauchedumembresupérieurapparaît,lesfossettesauditives(dépressionotique)
sontvisibles.
‐Aujour28,quatrepairesd’arcspharyngéssontvisiblesainsiquelesbourgeonsdes
membresinférieursetlesplacodes ectoblastiquescristalliniennesàl’origineducristallin
(développementdel’œil).Laparoiventraleestpratiquementachevée.

5
2.2.Lessemaines 4/5
Bourgeon
frontonasal
Bourgeon
maxillaire
Bourgeon
mandibulaire
2èmearc
2.2.Lessemaines 4/5
Lafaceendéveloppementestreprésentée parlarégionfrontonasale (envert)
etlepremierarcpharyngé (enorangé)scindé enbourgeonsmaxillaireset
mandibulaires.Elleestmiseenplaceaucoursdudeuxièmemoisparle
développementetlafusionde5bourgeons :lebourgeonfrontaloufrontonasal
(envert),lesdeuxbourgeonsmaxillaires,lesdeuxbourgeonsmandibulaires.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%



![Morphologie des Angiospermes [Mode de compatibilité]](http://s1.studylibfr.com/store/data/000565368_1-a68c29846ff57d73904763e33ee955b5-300x300.png)