Score HER2 pour les carcinomes gastriques

Score HER2 pour les carcinomes gastriques
Principales différences avec le score HER2 des carcinomes
mammaires – Réalisation en pratique
F. Penault-Llorca*, G. Monges**
FICHE technique
L’efficacité des thérapies ciblant HER2 dépend du statut
HER2 pour les tumeurs gastriques aussi bien que pour
les tumeurs mammaires. Une surexpression et/ou une
amplification de HER2 a été détectée dans 15 à 25 % des
carcinomes gastriques localement avancés. Comme dans
le cancer du sein, un statut HER2 positif est un facteur
pronostique péjoratif du fait de l’agressivité de la maladie
et de la diminution de la survie. Une Autorisation de
mise sur le marché (AMM) a été donnée le 19 janvier
2010 pour les cancers de la jonction œsogastrique et
les cancers gastriques métastatiques surexprimant HER2
par immunohistochimie (IHC) [3+ ou 2+ amplifiés par
hybridation in situ (HIS) fluorescente (FISH)] à la suite
des résultats positifs de l’étude ToGA(1). Une extension
d’AMM a été apportée le 6 août 2010, incluant la tech-
nique d’hybridation in situ Silver (SISH).
À la différence des cancers du sein, l’expression de HER2
dans les carcinomes gastriques est plus volontiers hété-
rogène (au moins 30 % de cellules tumorales marquées,
contre moins de 3 % pour les tumeurs mammaires) et, en
raison du pôle sécrétoire, plus la tumeur est différenciée
(et intestinale), moins le marquage membranaire est
complet (figure 1). Il y a donc eu une adaptation des
pratiques (avec multiplication des biopsies) et de l’inter-
prétation des résultats pour le test HER2 gastrique(2-4).
Cette hétérogénéité conduit également à tester à nou-
veau le statut HER2 sur la pièce de gastrectomie, et/
ou les métastases ganglionnaires à distance en cas de
statut négatif sur les biopsies initiales.
GContingences méthodologiques
du test HER2
Phase préanalytique
Fixation
Une fixation optimale est un prérequis indispensable à
l’obtention de tests IHC et HIS fiables. Pour une bonne
pénétration du fixateur, la mise en fixation doit être
réalisée rapidement (moins de 1heure après le prélè-
vement en cas de pièce opératoire). Le fixateur recom-
mandé est le formol à 10 %
tamponné. Le temps de
fixation doit être de 24 à 48 h pour les pièces opéra-
toires et au moins de 6 h pour les biopsies.
Inclusion en paraffine
La température de la paraffine doit être idéalement
de 56 à 57°C ; elle ne doit pas excéder 60°C. Une fois
fixés et inclus en paraffine, les échantillons sont stables
pendant plusieurs dizaines d’années. Ils doivent être
conservés dans une pièce fraîche (température maxi-
male tolérée : 27°C).
* Centre Jean-Perrin,
Clermont-Ferrand.
** Institut Paoli-Calmettes,
Marseille.
Correspondances en Onco-Théranostic - Vol. I - n° 2 - avril-mai-juin 2012
I
Figure 1. Particularités du marquage HER2 dans
les cancers gastriques.
Hétérogénéité Marquage basolatéral (3+)
Marquage non significatif du tissu
normal ou métaplasique : absence de
contrôles internes négatifs

FICHE technique
Sections
Plusieurs travaux ont montré, après section et étale-
ment, une chute de l’antigénicité avec le temps. Pour
la technique d’IHC, il est recommandé de préparer
les lames le jour même ou au maximum 2 semaines
à l’avance et de conserver les coupes tissulaires à
l’abri de la lumière et de la poussière, à 4°C. Par
contre, l’utilisation de rubans de paraffine gardés à
température ambiante est possible , et n’altère pas
la qualité des tests.
Description des méthodes disponibles
La technique d’IHC est suffisante pour déterminer le
statut HER2 des tumeurs dans environ 90 % des cas.
Seuls les cas ambigus sont actuellement vérifiés par
une technique d’HIS.
Technique immunohistochimique
Deux
kits standardisés
, approuvés par la Food and
Drug Administration (FDA) aux États-Unis, sont lar-
gement répandus et utilisés :
•
HercepTest™, le premier commercialisé, par Dako
(Glostrup, Danemark), utilise l’anticorps polyclonal
A485. L’étude ToGA a été réalisée avec ce kit ;
•
Pathway®, commercialisé par Ventana-Roche
(Tucson, Arizona, États-Unis), utilise le clone 4B5.
Plusieurs anticorps spécifiques anti-HER2 sont
également disponibles, hors kits standardisés. Les
plus utilisés sont l’anticorps monoclonal NCL-CB11
(Novocastra, Newcastle-upon-Tyne, Royaume-Uni),
l’anticorps monoclonal SP3 (Microm, Lyon, France),
l’anticorps monoclonal 4B5 (Ventana-Roche) et l’anti-
corps polyclonal A485 (Dako), tous dirigés contre
la partie intracytoplasmique de la protéine HER2.
L’anticorps Tab250 (Invitrogen, Carlsbad, Californie,
États-Unis) reconnaît le domaine extracellulaire de
HER2.
Sources de variation des tests IHC
Les principales étapes susceptibles de faire varier
les résultats pour les techniques IHC non standar-
disées sont, hormis les étapes préanalytiques que
nous venons de voir, les conditions de démasquage
antigénique (tampon utilisé, pH de la solution, etc.),
la concentration de l’anticorps utilisé, le type d’anti-
corps, la réalisation ou non d’aliquotes et leur mode
de conservation, le temps d’incubation, le type de
révélation utilisée. L’utilisation des micro-ondes et
des cocotte-minute n’est pas recommandée, en raison
de l’instabilité des résultats.
Utilisation de témoins ou contrôles pour valider
latechnique IHC
Il est impératif d’utiliser des témoins externes (un
ou plusieurs cas dont le degré de positivité HER2 est
connu) lors de la réalisation de chaque test. Il est
important également de contrôler le pourcentage de
cas positifs obtenus dans l’année en le corrélant aux
données anatomocliniques. Il n’y a pas de témoins
internes négatifs, puisque les glandes normales
peuvent être positives en IHC.
Hybridation in situ fluorescente
Trois tests FISH sont approuvés par la FDA : les kits
PathVysion (Abott/Vysis, Downers Grove, Illinois,
États-Unis) et HER2 FISH pharmDx™ (Dako), incluant
tous 2 la sonde centromérique du chromosome 17,
et INFORM/HER2 (Ventana-Roche), comportant la
sonde HER2 seule. D’autres sondes sont également
disponibles (ZytoVision, Kreatech, etc.), mais elles
sont moins répandues et utilisées selon la littérature.
L’avantage de disposer de la sonde pour le centromère
du chromosome 17 est que son évaluation permet
un contrôle interne de la qualité de la technique et
l’évaluation des éventuelles variations du nombre de
chromosomes (polysomie en cas d’augmentation du
nombre de chromosomes 17 ou monosomie en cas
de perte de l’un des chromosomes 17).
Hybridation in situ non fluorescente
Plusieurs systèmes d’hybridation in situ non fluores-
cente (BrISH) sont commercialisés, dont les kits de CISH
(Chromogenic In Situ Hybridization) de Zymed/Invitrogen,
à révélation par un chromogène, et de SISH de Ventana-
Roche. Leur excellente concordance avec les techniques
de FISH et la meilleure visualisation des structures tis-
sulaires en font des techniques de choix dans le cancer
gastrique. La plupart sont commercialisés en double
couleur, sinon, lorsque la connaissance du nombre
de chromosomes 17 est nécessaire, il faut réaliser une
seconde technique d’HIS sur une coupe consécutive.
Contraintes liées à l’HIS
La technique d’HIS est réservée à des centres spécia-
lisés, car l’interprétation des signaux nucléaires d’une
hybridation est longue et minutieuse et demande une
expertise. Des variations intra- et interlaboratoires sont
possibles, liées à des variations techniques (fixation,
épaisseur des coupes, prétraitements, etc.) et à des diffi-
cultés d’interprétation (difficulté de repérage des zones
invasives, superpositions nucléaires fréquentes dans les
adénocarcinomes bien différenciés, autofluorescence,
difficultés liées à l’interprétation des polysomies).
Correspondances en Onco-Théranostic - Vol. I - n° 2 - avril-mai-juin 2012
II

FICHE technique
Le prétraitement est l’étape la plus critique de la
technique. Parfois, le tissu normal ne requiert pas les
mêmes conditions de digestion que le tissu tumo-
ral. La digestion tissulaire est conditionnée par la
nature même de la tumeur (en particulier si le stroma
tumoral est fibreux) et surtout par le fixateur utilisé.
Les fixations alcooliques entraînent souvent des sur-
digestions avec des phénomènes de “noyaux vides
ou troués”.
Réalisation du score HER2
La biologie des carcinomes gastriques étant totale-
ment différente de celles des carcinomes mammaires,
il faut complètement réapprendre à interpréter les
tests HER2 pour le cancer gastrique. Répondre stric-
tement aux critères utilisés pour le sein entraîne
une forte sous-estimation de la sensibilité de l’IHC
à détecter les cas amplifiés. Il n’y a pas de contrôles
internes négatifs.
La détermination du statut HER2 pour les patients
atteints de cancers gastriques se fait par IHC. Le test
est réalisé sur la tumeur primitive (pièce opératoire
ou biopsies). Le score de l’IHC est basé sur l’intensité
du marquage membranaire et sur le pourcentage
de cellules marquées (figures 2 et 3). Un marquage
membranaire est significatif s’il est net, complet ou
basolatéral en U.
Règle du microscope (figures 2 et 3) : pour évaluer de
façon reproductible l’intensité du marquage par IHC,
le degré du grossissement microscopique (X) auquel
le marquage membranaire est clairement visible doit
être pris en compte, avec un seuil de 10 % de cellules
marquées pour les pièces opératoires et le marquage
d’au moins 5 cellules adjacentes cohésives pour les
biopsies, soit :
•
grossissement faible (2,5 à 5 ×) : identification du
score 3+ (complet, en U ou latéral) ;
•
grossissement intermédiaire (10 à 20 ×) : score 2+
(complet, en U ou latéral) ;
•
fort grossissement (40 ×) : score 1+ (tout marquage
membranaire) ou négatif.
Les cas ambigus ou 2+ seront testés par une tech-
nique d’HIS, à la recherche d’une éventuelle amplifi-
cation du gène HER2 qui rendrait le patient éligible
au traitement par trastuzumab au stade métasta-
tique. L’utilisation systématique de la technique
d’HIS n’est pas recommandée, car la présence d’une
amplification sans surexpression de la protéine HER2
n’est pas un critère d’éligibilité au traitement en
Europe.
Les résultats de FISH et SISH sont exprimés par un
ratio entre le nombre de copies des HER2 et le nombre
de copies du chromosome 17, dans 20 à 40 cellules
comptées. La définition de la positivité de la FISH ou
la BrISH dans les tumeurs gastriques ou de la jonction
est un rapport HER2/CEP17 ≥ 2.
Avec une sonde HER2 unique, un cas est considéré
comme positif à partir de 6 copies. En raison de l’hété-
rogénéité tumorale, les techniques d’hybridation in
situ avec sondes non fluorescentes semblent les plus
adaptées à la pratique de routine. Lorsque le ratio est
compris entre 1,8 et 2,2, il est suggéré de compter
plus de noyaux (au moins 20 de plus) et dans d’autres
zones tumorales et/ou d’autres coupes.
Correspondances en Onco-Théranostic - Vol. I - n° 2 - avril-mai-juin 2012
III
Grossissement : objectif X
(nécessaire en cas de marquage équivoque)
Score
3+
2+
1+
0
2,5/5 × – (10 ×)
10 × – (20 ×)
20 × – (40 ×)
40 ×
Fort (visible à l’œil)
Faible à modéré
À peine visible (nécessite
un fort agrandissement)
Négatif
Marquage membranaire clairement distinct
D’abord à 2,5 (5 ×) – (10 ×) confirmé à plus fort grossissement
Figure 2. IHC : score d’intensité.
Proposition d’approche standardisée.
Figure 3. IHC : critères du score.
Score 1+
Score 3+
Score 2+
Score 0 Marquage membranaire significatif
Intensité du marquage
Fort (à 2,5 × – 5 ×)
Complet, basolatéral ou latéral
Pas de
marquage
au40 ×
À peine
visible
(à 40 ×)
Faible
àmodéré
(à 10 – 20 ×)
Doit être au moins :
•5cellulescohésivesregroupées
pour lesbiopsies
•10%pourlescaschirurgicaux

FICHE technique
GSynthèse des recommandations
Recommandations pour la pratique du test HER2
dans les cancers de l’estomac et de la jonction œso-
gastrique(4)
1. Oublier tout ce que l’on a appris pour l’interprétation
du test HER2 dans le cancer du sein.
2. Tout patient ayant un cancer gastrique doit être testé
pour HER2.
3. Il convient de réaliser au moins 8biopsies endo-
scopiques pour les cancers inopérables (mais aussi pour
les cancers opérables, car la chimiothérapie préopératoire
peut rendre difficile l’interprétation du test HER2 sur la
pièce opératoire).
4. L’IHC doit être le test initial :
–elle permet la localisation de zones HER2 positives
dans des tumeurs hétérogènes (importance de l’échan-
tillonnage) ;
–l’évaluation du score HER2 est différente de celle uti-
lisée dans le cancer du sein (le marquage membranaire
n’est pas obligatoirement complet, et le pourcentage de
cellules marquées nécessaires est plus faible : 10 % sur
pièces opératoires et au moins 5cellules cohésives sur
biopsies) [tableau].
5. Les tumeurs IHC 2+ doivent être testées par FISH ou SISH.
6. Le test doit être réalisé dans des laboratoires entraînés
et inscrits dans une démarche active d’évaluation externe
de la qualité.
7. Les résultats doivent être rendus rapidement (idéale-
ment dans les 5jours).
Correspondances en Onco-Théranostic - Vol. I - n° 2 - avril-mai-juin 2012
IV
1. Bang YJ, Van Cutsem E, Feyereislova A et al.; ToGA Trial Investigators. Trastuzumab in combi-
nation with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced
gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised
controlled trial. Lancet 2010;376:687-97.
2.
Penault-Llorca F, Vincent-Salomon A, Bellocq JP et al. Mise à jour des recommandations
du GEFPICS pour l’évaluation du statut HER2 dans les cancers du sein en France. Ann Pathol
2010;30:357-73.
3.
Penault-Llorca F, Chenard MP, Bouché O et al. HER2 et cancer gastrique, application pour la
pratique clinique en 2011. Ann Pathol 2011;31(2):78-87.
4. Rüschoff J, Hanna W, Bilous M et al. HER2 testing in gastric cancer: a practical approach.
Mod Pathol 2012;25(5):637-50.
Pour en savoir plus…
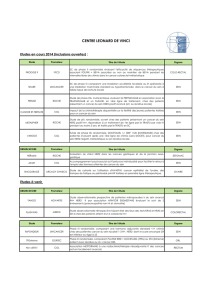
Caractéristiques du marquage Score/classification
Pas de marquage ou marquage membranaire dans < 10 % des cellules 0/négative
Marquage membranaire faible/imperceptible dans ≥ 10 % des cellules ;
les cellules ne sont marquées que sur une petite partie de leur membrane
Tout marquage ne rentrant pas dans la catégorie 2+ ou 3+
1+ /négative
Marquage membranaire complet ou basolatéral, faible à modéré dans ≥ 10 % des cellules 2+/équivoque
Marquage membranaire complet ou basolatéral modérée à fort dans ≥ 10 % des cellules 3+/positive
Les prélèvements biopsiques endoscopiques montrant des “clones” IHC 3+ et/ou FISH+ cohésifs sont considérés comme positifs
indépendamment de leur taille (même si < 10 %), avec, néanmoins, une limite inférieure à au moins 5 cellules cohésives.
Tableau. Score modifié pour l’évaluation
du statut HER2 du cancer de l’estomac.
1
/
4
100%