Lire l`article complet

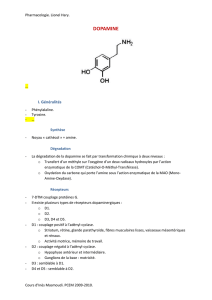
Figure. Principales voies dopaminergiques.
Voies dopaminergiques
Mésocorticale
Mésolimbique
Nigrostriée
Tubéro-
infundibulaire
Incerto-
hypothalamique
Thalamus
Cortex cingulaire antérieur
Aire tegmentale ventrale
Cortex préfrontal
Putamen
Hypothalamus
Substantia nigra
Noyau accumbens
Cortex enthorinal
Amygdale/hippocampe
La Lettre du Psychiatre • Vol. VI - n° 4 - juillet-août 2010 | 121
MISE AU POINT
Dépression, schizophrénie,
toutes les voies mènent-elles
à la dopamine ?
Depression, schizophrenia: dopamine disorders?
L. Bindler*, M.V. Chopin*, P. Nuss*, C.S. Peretti*
U
n syndrome de dysrégulation dopaminergique
(SDD) observé chez des patients parkinso-
niens traités par agonistes dopaminergiques
a fait l’objet de publications récentes (1). Cette
observation fait écho à celle de troubles psychia-
triques apparus pendant et après intervention
chez des patients ayant bénéficié de l’implan-
tation d’électrodes de stimulation chronique sous-
thalamique (2, 3). Le “modèle parkinsonien”, qui
comporte notamment les hallucinations, le ralen-
tissement psychomoteur et les troubles du compor-
tement “d’allure maniaque” du SDD, a ainsi remis au
goût du jour une approche dimensionnelle de deux
maladies psychiatriques : la dépression et la schizo-
phrénie. Plusieurs études suggèrent de concevoir
pour ces troubles un filtre dimensionnel commun,
sorte de moulinette dopaminergique qui constitue-
rait une voie finale commune, confluent de diverses
approches étiopathogéniques.
Rappel sur les voies
dopaminergiques (4)
La dopamine est un neurotransmetteur synthétisé à
partir de la tyrosine. Les neurones dopaminergiques
peuvent être regroupés en 5 voies fonctionnelles
(figure) :
➤
La voie nigrostriée est composée de projections
neuronales de la substantia nigra pars compacta
* Service de psychiatrie, hôpital Saint-
Antoine, Paris.

122 | La Lettre du Psychiatre • Vol. VI - n° 4 - juillet-août 2010
Résumé
Un syndrome de dysrégulation dopaminergique (SDD) observé chez des patients parkinsoniens traités par
agonistes dopaminergiques a récemment fait l’objet de publications. Le “modèle parkinsonien”, a ainsi
remis au goût du jour une approche dimensionnelle de deux maladies psychiatriques : la dépression et
la schizophrénie. À partir de l’hypothèse d’une voie finale dopaminergique commune, nous avons repris
les différentes hypothèses étiopathogéniques de ces deux maladies. L’approche dopaminergique doit
être relativisée, mais elle a le mérite de réconcilier les différentes approches et hypothèses étiologiques
développées ces dernières années dans ces deux maladies plurifactorielles. Elle ouvre ou relance des pers-
pectives de recherche dans le domaine de la neurotransmission dopaminergique et de la pharmacologie
des épisodes dépressifs ou psychotiques résistants aux thérapeutiques classiques.
Mots-clés
Dopamine
Dépression
Schizophrénie
Summary
Patient with Parkinson’s disease
may suffer from behavioural
disorders when treated with
dopamine agonists. These
disorders have been regrouped
into a dopamine dysregulation
syndrome. We hypothesised
that depression and schizo-
phrenia may be other specific
dopamine dysregulation disor-
ders. A dopamine approach of
these two disorders may have
therapeutic and pharmaco-
logical implications.
Keywords
Dopamine
Depressive disorder
Schizophrenia
(tronc cérébral) vers le striatum dorsal (putamen et
noyau caudé). Elle est impliquée dans la planification
et le contrôle du mouvement ;
➤La voie mésolimbique, projection neuronale de
l’aire tegmentale ventrale vers le noyau accumbens,
l’amygdale et l’hippocampe, participe aux circuits
de la récompense et de la motivation ;
➤
La voie mésocorticale, dont les neurones plus
médians que les précédents ont des projections de
l’aire tegmentale ventrale vers les cortex cingulaire
antérieur, enthorinal et préfrontal, est impliquée
dans la concentration et les fonctions exécutives,
en particulier la mémoire de travail.
➤
La voie tubéro-infundibulaire, composée de
projections neuronales du noyau arqué hypothala-
mique vers l’éminence médiane hypothalamique,
contrôle la libération d’hormones de croissance via
la prolactine ;
➤
La voie incerto-hypothalamique, dont les
neurones se projettent de l’incerta vers l’amygdale
et l’hypothalamus, est impliquée dans les compor-
tements sexuels.
Ces 5 grandes voies sont au cœur des hypothèses
dopaminergiques actuelles concernant la dépression
et la schizophrénie.
Le “modèle parkinsonien”
Plusieurs éléments récents concernant la maladie
de Parkinson, comme l’individualisation du SDD,
l’observation des effets des agonistes dopaminer-
giques ou de la stimulation cérébrale profonde, ont
remis sur le devant de la scène les théories dopa-
minergiques dans la dépression et la schizophrénie.
La maladie de Parkinson idiopathique – et sa triade
symptomatique classique (rigidité-akinésie-hyper-
tonie) – est connue pour résulter d’une atteinte de
la voie dopaminergique nigrostriée. Certains symp-
tômes survenant plus tardivement dans l’évolution
de la maladie comme la dépression, l’anhédonie, le
déficit de motivation ou l’apathie pourraient résulter
d’une atteinte dégénérative à plus long terme des
voies dopaminergiques mésolimbiques, comme cela
a été démontré chez l’animal puis chez l’homme (5).
Une étude récente en imagerie cérébrale par tomo-
graphie par émission de positrons (TEP) a permis de
corréler la symptomatologie dépressive de patients
parkinsoniens avec un déficit en transporteur de la
dopamine dans les régions corticales limbiques (6).
L’utilisation de nouveaux traitements dans la
maladie de Parkinson a permis de préciser les rôles
respectifs des différentes voies dopaminergiques.
Depuis 2000 ont en effet été regroupés sous une
même entité syndromique neuropsychiatrique – le
SDD – différents troubles du comportement surve-
nant préférentiellement chez des patients traités
par agonistes dopaminergiques : hyperactivité
nocturne, somnolence diurne, modifications du
régime alimentaire, développement d’une activité
créatrice et de bricolage, hypersexualité, comporte-
ments de prise de risque, jeu pathologique, achats
compulsifs, activités répétitives de punding (définies
comme relevant d’une intense fascination pour des
mouvements répétés et apparemment dépourvus de
signification, comme la collection, le rangement ou
le déplacement d’objets) [7] et addiction aux traite-
ments dopaminergiques (1). Ces troubles semblent
régresser à la diminution des doses d’agonistes
dopaminergiques prescrites, notamment à la suite
de l’implantation d’électrodes de stimulation chro-
nique sous-thalamique. Cette dernière technique
thérapeutique développée depuis 1995 a permis de
préciser quelles étaient les zones limbiques du noyau
sous-thalamique impliquées dans le contrôle des
émotions. Le lien entre troubles neuropsychiatriques
et agonistes dopaminergiques a été étudié plus
précisément par certains auteurs qui ont retrouvé,
chez l’animal puis chez l’homme, des effets anti-
dépresseurs des agonistes dopaminergiques (en
l’occurrence le pramipexole) comparables à ceux
de certains antidépresseurs sérotoninergiques (8, 9).
Plus récemment, il a même été mis en évidence
un lien entre les propriétés antidépressives de ces
molécules et leur affinité spécifique pour les récep-
teurs D3-dopaminergiques, de localisation limbique
préférentielle (10). Dans le passé, d’autres substances
dopaminergiques avaient déjà été utilisées à des fins
antidépressives : l’amineptine (Survector
®
), retiré
du marché parce que provoquant une hypertension
artérielle pulmonaire, et le bupropion (Zyban®),
prescrit aujourd’hui en France dans le maintien de
l’abstinence après sevrage tabagique. Ces deux molé-
cules, qui possédaient des effets thymiques modérés

La Lettre du Psychiatre • Vol. VI - n° 4 - juillet-août 2010 | 123
MISE AU POINT
avec échappement thérapeutique important, étaient
surtout efficaces sur le plan dimensionnel (sur le
ralentissement psychomoteur, par exemple), plus
que d’un point de vue catégoriel (sur la dépression).
Ainsi, l’atteinte presque exclusivement dopaminer-
gique de la maladie de Parkinson semble constituer
un modèle conceptuel in vivo important pour l’étude
des voies dopaminergiques et de leurs implications
dans la symptomatologie psychiatrique tant dépres-
sive que schizophrénique.
Dépression
Le rôle de la dopamine dans la dépression est connu
ou supposé depuis plusieurs années. Les progrès
en imagerie fonctionnelle ont permis une nouvelle
avancée dans la compréhension de l’étiopathogénie
de cette maladie. Ainsi, certains auteurs ont repris et
complété l’état des connaissances sur la dépression
et ont attribué un rôle central à la dopamine dans
sa pathogenèse.
Étude sur les récepteurs
Des études d’imagerie fonctionnelle ont permis de
préciser les différences de répartition des récepteurs
dopaminergiques chez les patients déprimés par
rapport à des sujets témoins. Il s’agit en réalité d’études
d’imagerie de radioligands du transporteur présynap-
tique de la dopamine (DAT) et surtout des récepteurs
D2 (11-13). Les résultats, bien que non consensuels,
montreraient une augmentation de la fixation de ce
ligand au niveau striatal, région anatomique à laquelle
on suppose un rôle dans la genèse des états dépres-
sifs, chez les patients dépressifs – en particulier chez
ceux présentant un ralentissement psychomoteur
important. Cette hyperfixation pourrait s’expliquer
par trois hypothèses : une augmentation du nombre
de récepteurs D2, une affinité augmentée de ces
récepteurs, ou encore une hypodopaminergie synap-
tique diminuant la compétition de site entre ligand
et dopamine. Une étude récente a mis en évidence
une hyperfixation d’un radioligand aux récepteurs D2
et D3 du cortex temporal, laissant même supposer
une relation linéaire entre gravité de la dépression
et hypodopaminergie synaptique temporale (14).
Encore discutés, notamment parce que l’anxiété
pourrait modifier l’expression des récepteurs D2, ces
résultats ouvrent des voies de recherche et pourraient
permettre une meilleure compréhension des modifi-
cations dopaminergiques liées à la dépression.
Génétique
Des facteurs d’héritabilité de la dépression sont
désormais reconnus, représentant 30 à 40 % des
cas selon les études. De pénétrance très incom-
plète, il est cependant possible d’isoler des poly-
morphismes génétiques dits “prédisposants”. En
particulier, ont pu être incriminés des gènes codant
pour le récepteur dopaminergique D4, pour le DAT
présynaptique ou pour la catéchol-O-méthyl-
transférase (COMT), dont on connaît le rôle dans
l’inactivation postsynaptique de la dopamine (4).
L’hypothèse de l’implication de gènes codant pour
le récepteur dopaminergique D4 doit être relativisée
par la distribution spécifique de ces récepteurs dans
des régions qui ne sont pas celles identifiées dans
les études d’imagerie.
Interactions sociales
Le déterminisme génétique de la dépression a été
relativisé par l’observation d’une pénétrance très
incomplète, et on évoque désormais plus volon-
tiers une interaction gène-environnement. Certains
auteurs tentent d’expliquer cette “pression envi-
ronnementale” par une mise en jeu des systèmes
dopaminergiques mésolimbiques. Une sensibilité
des systèmes de récompense plus importante chez
des patients dépressifs que chez des sujets sains a
pu être démontrée : la réponse de ceux-là à la prise
d’un psychostimulant serait disproportionnée et
en lien avec une altération des cortex préfrontal,
orbito-frontal et du putamen (15). Plusieurs auteurs
ont parlé d’une hyperréactivité au stress “psycho-
social”, notamment chez les patients bipolaires ;
celle-ci pourrait être médiée par la dopamine et les
systèmes de récompense.
Patients bipolaires
Une récente revue de la littérature portant sur les
patients bipolaires (16) a confirmé l’hypothèse
d’un relargage dopaminergique associé à des états
maniaques, comparables pour certains symptômes
au SDD provoqué par les agonistes dopaminergiques.
Il a même été décrit un cas de virage maniaque
sous pramipexole, un traitement agoniste dopa-
minergique, ainsi que nous l’avons vu plus haut. En
corollaire de cet afflux dopaminergique, il y aurait
une down-régulation des récepteurs dopaminer-
giques pré- et postsynaptiques, d’où l’apparition de

124 | La Lettre du Psychiatre • Vol. VI - n° 4 - juillet-août 2010
Dépression, schizophrénie, toutes les voies
mènent-elles à la dopamine ?
MISE AU POINT
symptômes dépressifs en lien avec l’hypodopami-
nergie relative. Cette théorie pourrait mener à une
meilleure compréhension des cycles des patients
bipolaires, plus ou moins rapides selon la réactivité
du système dopaminergique, notamment aux stress
environnementaux.
Ralentissement psychomoteur
Dans un souci d’approche dimensionnelle, des
auteurs ont tenté d’individualiser certaines dimen-
sions dépressives comme le ralentissement psycho-
moteur ou les caractéristiques psychotiques ou
mélancoliques qui seraient les plus “liées” aux
systèmes dopaminergiques. En pratique, cela pour-
rait mener à des orientations thérapeutiques ciblées.
Données pharmacologiques
Des études ont démontré les effets thymiques puis-
sants de certains antidépresseurs à cible d’action
dopaminergique privilégiée, comme l’amineptine,
retiré du marché français à cause de l’hypertension
artérielle pulmonaire qu’il entraînait. D’autres molé-
cules ont montré leur efficacité, tel le bupropion. Des
agonistes dopaminergiques ont même été utilisés
(cf. ci-dessus).
On peut également relier les effets thérapeutiques
des inhibiteurs de recapture de la sérotonine (IRS)
avec le système dopaminergique, tant on connaît les
nombreuses interactions entre ces deux systèmes
neurotransmetteurs.
Ainsi, la notion de voie finale commune dopami-
nergique s’intègre à une approche dimensionnelle
de la dépression. Elle permet d’interroger la nature
de la “symptomatologie résiduelle” ou la résistance
aux traitements de première intention : ces dépres-
sions-là ne seraient-elles pas finalement des formes
plus dopamino-déterminées ? Quelle pourrait alors
être la place, dans le traitement de ces formes de
dépression, de la dopaminothérapie ou de la stimu-
lation magnétique transcrânienne répétée (SMTr),
dont on sait que, appliquée en regard des zones
préfrontales, elle provoque une augmentation de
la concentration dopaminergique striatale (17) ?
Ne pourraient-elles pas être considérées comme
de bons traitements de seconde intention pour les
patients en rémission partielle ? Un récent rapport
de la Food and Drug Administration, autorité compé-
tente aux États-Unis, semble aller dans ce sens pour
la SMTr. D’autres auteurs, comme R. Jouvent (18),
se sont interrogés sur le caractère dépressif de ces
épisodes : ne seraient-ils pas de “simples” déficits
dopaminergiques chroniques ?
Schizophrénie
Un peu à l’image de ce qui a été estimé au sujet de
la dépression, une hypothèse empirique dopaminer-
gique avait été évoquée pour la schizophrénie il y a
déjà plusieurs années, lors du constat d’une efficacité
pharmacologique de molécules antagonistes des
récepteurs dopaminergiques (D2 en particulier) sur la
symptomatologie schizophrénique. Cette hypothèse
avait été un moment ébranlée par la description d’un
nombre plus important de récepteurs dopaminer-
giques dans de nombreuses aires sous-corticales, ce
qui contredisait l’hypothèse initiale de A. Carlsson
sur l’existence d’une hyperdopaminergie (19). Les
travaux ultérieurs de D.R. Weinberger (20) puis de
P. Seeman et al. (21) ont partiellement réhabilité
cette hypothèse. R. Murray et son équipe ont récem-
ment repris les différentes hypothèses étiologiques
de cette maladie sous l’angle dopaminergique pour
faire de la dopamine une “voie finale commune”
aux hypothèses étiopathogéniques de la schizo-
phrénie (22).
Étude sur les récepteurs dopaminergiques
Avec J. Delay, P. Denicker et l’avènement des
neuroleptiques en 1952, l’hypothèse de l’étiologie
dopaminergique de la schizophrénie, formalisée
en 1978 par A. Carlsson, a pu voir le jour : un excès
de dopamine serait à l’origine de la symptomatologie
schizophrénique. Plusieurs études ont démontré
une augmentation striatale de dopamine lors d’un
premier épisode psychotique et un relargage dopa-
minergique corrélé avec l’intensité des symptômes
psychotiques positifs (23, 24). Ce relargage phasique
aura d’autant plus d’effets qu’une hypodopaminergie
relative chronique aura permis une surexpression
des récepteurs D2, ce qui semble être le cas dans
la schizophrénie.
Susceptibilité génétique
L’hypothèse génétique de la schizophrénie se fonde
au départ sur des études de familles, de fratries et
de jumeaux schizophrènes. De nombreux gènes ont
été incriminés (Neureguline, Dysbindine, DISC1,

La Lettre du Psychiatre • Vol. VI - n° 4 - juillet-août 2010 | 125
MISE AU POINT
DAOA ou COMT), menant à l’hypothèse étiologique
d’une susceptibilité génétique pluridéterminée. Ces
gènes, pour la plupart, participent au système gluta-
matergique, lequel est impliqué dans la régulation
dopaminergique. Celui de la COMT est, quant à lui,
directement en cause dans le métabolisme dopa-
minergique des régions préfrontales.
Traumatismes périnataux
et obstétricaux
La prématurité, l’hypotrophie et l’hypoxie néonatale
sont désormais considérées comme des facteurs de
risque de schizophrénie et plus généralement de
psychopathologie. De tels événements sont à l’ori-
gine d’altérations fonctionnelles hippocampales. Une
altération hippocampale bilatérale a été retrouvée
chez des patients souffrant d’un trouble schizo-
phrénique chronique et une altération unilatérale
gauche a été retrouvée chez des sujets en premier
épisode psychotique comparés à des sujets sains.
Ces constatations ont conduit certains auteurs à
considérer les altérations hippocampales comme
un facteur de risque de schizophrénie, expliquant
ainsi le poids des antécédents obstétricaux dans
le spectre étiopathogénique de la schizophrénie.
Récemment, des études animales ont établi un lien
entre une atteinte hippocampale néonatale et une
hyperréactivité dopaminergique lors du développe-
ment, laissant supposer le rôle indirect – médié par
l’hippocampe – des événements de vie périnataux
sur le métabolisme dopaminergique.
Épisodes psychotiques pharmaco-
induits et cannabis
Il est bien connu que des produits psychostimu-
lants (dopaminomimétiques) peuvent induire des
états psychotiques aigus. Les amphétamines, en
particulier, peuvent provoquer des états proches
de la schizophrénie paranoïde : la psychose amphé-
taminique.
Au premier rang des facteurs de risque exogènes
de schizophrénie, le cannabis est très discuté. De
nombreuses études ont démontré qu’une consom-
mation cannabique augmentait le risque de déve-
lopper la maladie, sans doute en agissant comme
facteur précipitant dans une population “à risque”.
Cependant, seuls certains sujets consommateurs de
cannabis développent une schizophrénie. L’hypo-
thèse la plus probable pour expliquer cette diversité
est celle d’une interaction gène-environnement. L’un
des gènes candidats pour cette hypothèse est celui
de la COMT, notamment impliqué dans le métabo-
lisme dopaminergique préfrontal : deux études ont
démontré que le risque de développer une psychose
chez des adolescents consommateurs de cannabis
dépendrait du génotype de ces sujets pour la COMT
(25, 26). Ainsi, un polymorphisme allélique d’un gène
impliqué dans la “chaîne dopaminergique” pourrait
être responsable de la vulnérabilité des sujets au
cannabis comme facteur de risque de développer une
schizophrénie. L’implication récente du cannabis dans
les aspects neurodéveloppementaux et le traitement
du signal tant cérébelleux qu’hippocampique, sous-
tendue par des hypothèses glutamatergiques de la
schizophrénie, doivent cependant faire relativiser
cette hypothèse dopaminergique.
Genre
Le sex-ratio de la schizophrénie montre une surrepré-
sentation de patients de sexe masculin. Cette donnée
pourrait être intégrée à l’hypothèse dopaminergique,
à la lumière d’une publication récente de C.A. Munro
et al. (27) : les auteurs ont en effet démontré que,
chez le sujet sain, la libération striatale de dopamine
en réponse à la prise d’amphétamines est supérieure
chez les sujets masculins. Étant donné les hypothèses
dopaminergiques striatales développées plus haut,
cette étude ouvre une voie d’explication du sex-ratio
de la schizophrénie.
Événements de vie, isolement social
Ces dernières années, un intérêt considérable a été
porté au rôle de l’isolement social, des événements
de vie et du stress dans la pathogénie de la schizo-
phrénie. Les Anglo-Saxons utilisent le terme “adver-
sité sociale” pour décrire ces facteurs de stress
propres à la vie en milieu urbain ou à l’isolement
(de certains migrants, notamment). Il est admis
que ces facteurs participent au spectre des facteurs
de risque de développer un trouble psychotique de
type schizophrénique. R.M. Murray et al. font entrer
ces facteurs de risque dans leur hypothèse de la
voie finale commune en s’appuyant sur des études
animales qui ont démontré que l’isolement, d’une
part (28) et la subordination sociale d’autre part
(29, 30) sont associés à des modifications dopami-
nergiques et notamment à une augmentation du
relargage dopaminergique. Ainsi, pour reprendre
"ANMMDY
UNTR
DMKHFMD
#TKKDSHM
C¢@ANMMDLDMS
CHRONMHAKD
O@FD
www.edimark.fr
 6
6
1
/
6
100%