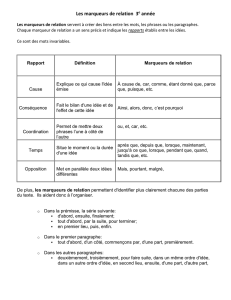
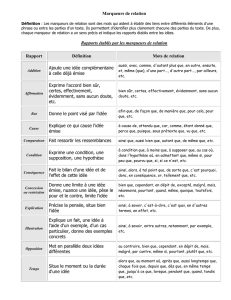
Marqueurs tumoraux et tumeurs germinales du testicule

Introduction
Les tumeurs germinales du testicule ne représentent que 1 % des tumeurs
chez les malades de sexe masculin. Pourtant, c’est la tumeur solide la plus fré-
quente chez l’homme jeune de 15 à 34 ans et son incidence a plus que doublé
à l’échelle mondiale au cours des 40 dernières années (1, 2). La prise en charge
de ces cancers est l’un des succès de l’oncologie. De fait, une guérison est
obtenue chez plus de 90 % des patients nouvellement diagnostiqués et chez
70 à 80 % des patients avec une maladie avancée nécessitant une chimio-
thérapie (1, 3). Ces résultats sont dus à l’efficacité des traitements et à l’uti-
lisation de marqueurs biologiques qui influencent les décisions cliniques à dif-
férents stades du traitement.
Les marqueurs biologiques sont des molécules produites par les cellules can-
céreuses et retrouvées en quantité détectable dans le sang circulant. Ils doivent
être recherchés lorsque leur utilité clinique est prouvée, c’est-à-dire lorsque la
connaissance du ou des marqueurs biologiques contribue à une décision
clinique aboutissant à un résultat plus favorable pour le patient. Ce résultat
clinique peut se traduire objectivement par un allongement de la survie ou
de la survie sans maladie, par une amélioration de la qualité de vie, par une
diminution de traitements potentiellement toxiques ou inefficaces ou par une
réduction des coûts. Utilisés pour le diagnostic des tumeurs germinales du
testicule, l’établissement de leur pronostic, la conduite de leur traitement et
la surveillance de leur évolution, les marqueurs biologiques ont une utilité
clinique qui va être détaillée dans ce chapitre.
Les marqueurs biologiques
Les tumeurs séminomateuses (séminome typique, séminome anaplasique ou
séminome spermatocytaire), les tumeurs germinales du testicule non sémi-
nomateuses (carcinome embryonnaire, tératome, tumeur du sac vitellin, cho-
riocarcinome) et les tumeurs germinales mixtes ayant une composante sémi-
nomateuse et non séminomateuse (1, 4) peuvent produire quatre marqueurs
Marqueurs tumoraux et tumeurs germinales
du testicule
D. BELLET et F. TROALEN

biologiques qui diffèrent en fonction de la nature histologique de la tumeur :
l’hormone chorionique gonadotrope (hCG), la sous-unité bêta libre de l’hor-
mone chorionique gonadotrope (hCGβ), l’alpha-fœto-protéine (AFP) et la
lactate-déshydrogénase (LDH).
L’hormone chorionique gonadotrope (hCG pour Human Chorionic
Gonadotropin) est une glycoprotéine qui a une masse moléculaire d’environ
36,7 kDa et une demi-vie de 24 à 36 heures (5). Elle est produite par les cel-
lules trophoblastiques du placenta au cours de la grossesse. Elle appartient à
la famille des hormones glycoprotéiques qui inclut également l’hormone lutéi-
nizante (hLH pour Human Luteinizing Hormone), l’hormone folliculo-sti-
mulante (hFSH pour Human Follicle Stimulating Hormone) et l’hormone sti-
mulant la thyroïde (hTSH pour Human Thyroid Stimulating Hormone).
Comme les trois autres hormones glycoprotéiques, l’hCG est composée de
deux sous-unités liées de façon non-covalente. Ces sous-unités dénommées
alpha (hCGα) et bêta (hCGβ) sont produites par des gènes différents loca-
lisés sur des chromosomes distincts (fig.1). Ces gènes peuvent être transcrits
et traduits simultanément pour produire l’hCG. De plus, l’un des gènes peut
être transcrit et traduit isolément ou préférentiellement pour produire l’une
ou l’autre des sous-unités qui est alors retrouvée dans la circulation sanguine
sous forme de sous-unité alpha libre (hCGαlibre) ou de sous-unité bêta libre
(hCGβlibre). Alors que la sous-unité alpha codée par un gène unique loca-
lisé sur le chromosome 6 est commune aux quatre hormones glycoprotéiques,
chaque hormone glycoprotéique possède une sous-unité bêta différente. La
sous-unité hCGβ, de masse moléculaire 22,2 kDa, a une demi-vie de 3 à
4 heures (5). Elle comprend 145 acides aminés et présente une composition
en acides aminés très proche de celle de la sous-unité hLHβ: l’hCGβet la
hLHβont une séquence de 115 acides aminés aminoterminaux identiques à
82 %. Cependant, l’hCGβprésente une chaîne carboxyl terminale de 24 acides
aminés qui n’est pas retrouvée dans les autres sous-unités bêta (6). Si la sous-
unité hLHβest codée par un seul gène localisé sur le chromosome 19, la sous-
unité hCGβest codée par quatre gènes différents, localisés également sur le
chromosome 19. De façon intéressante, ces gènes codent pour des sous-unités
hCGβde composition légèrement différente, notamment en position 117 (7).
Jusqu’à une période récente, le dosages de l’hCG et de sa sous-unité hCGβ
libre posaient de nombreux problèmes. En premier lieu, la similitude de struc-
ture entre l’hCG et la hLH ainsi que le manque de spécificité de certains anti-
corps faisaient que certains dosages d’hCG présentaient des réactions croisées
avec la hLH. De plus, des techniques dosent uniquement l’hCG alors que
d’autres mesurent spécifiquement la sous-unité hCGβlibre. Enfin, de nom-
breuses techniques détectent à la fois l’hCG et la sous-unité hCGβlibre. Pour
complexifier les problèmes, il faut souligner que les méthodes de dosages uti-
lisent divers étalons et expriment leurs résultats dans des unités différentes
(mUI/ml, UI/L, ng/ml, pg/ml). Récemment, un effort a été fait à l’échelle
internationale pour standardiser les méthodes de dosages de l’hCG et de la
64 Cancer du testicule

sous-unité hCGβlibre (8). Surtout, l’utilisation d’anticorps monoclonaux tota-
lement spécifique de l’hCG ou de l’hCGβlibre a permis le développement
de méthodes qui dosent séparément l’hCG ou l’hCGβlibre sans aucune réac-
tion croisée avec la hLH ou la sous-unité hLHβlibre (9, 10). Ceci est impor-
tant car certaines tumeurs testiculaires produisent à la fois l’hCG et l’hCGβ
libre, alors que d’autres ne produisent que l’un de ces deux marqueurs. En
utilisant des techniques sensibles et spécifiques, il est possible de détecter des
valeurs d’hCG inférieures à 27 pg/ml et des valeurs d’hCGβlibre inférieures
à 6 pg/ml (11). Les valeurs d’hCG usuelles et d’hCGβlibre chez l’adulte sont
inférieures respectivement à 720 pg/ml (0,7 ng/ml ou 7 mUI/ml) et 110 pg/ml
(0,1 ng/ml) (11). Il peut paraître surprenant de détecter de faibles taux d’hCG
ou d’hCGβlibre chez l’adulte, alors que cette hormone et cette sous-unité
libre ne sont pas censées être détectables en dehors de la grossesse où leur
taux est alors très élevé. L’explication a été trouvée en 1997 lorsqu’il a été
montré que l’un des gènes codant l’hCGβest transcrit et traduit par des cel-
lules normales non trophoblastiques d’origine histologique variée (7).
Finalement, l’ensemble de ces données récentes est important à connaître
lorsque l’on veut interpréter les résultats d’hCG ou d’hCGβlibre.
Marqueurs tumoraux et tumeurs germinales du testicule 65
ARNm CGβ
ARNm CGα
hCG
6q 21.1 19q 13.3
hCGβ librehCGα libre
Chromosomes
Sous-unités libres
Hormone dimérique
Fig. 1 – Expression des gènes codant pour l’hCG et pour ses sous-unités hCGαou hCGβ
libres.
L’alpha-fœto-protéine (AFP) est une glycoprotéine de masse moléculaire
70 kDa. Sa demi-vie chez l’adulte est de 5 à 6 jours (12). C’est la principale
protéine sérique du fœtus où elle est synthétisée par les cellules parenchyma-
teuses du foie, du sac vitellin et du tractus gastro-intestinal. Chez l’adulte
normal, le taux sérique d’AFP est compris entre 1 et 16 ng/ml. En dehors

des élévations du taux d’AFP sérique observées en cas de tumeurs testiculaires,
le taux d’AFP est également élevé en cas de carcinome hépatocellulaire et de
pathologie hépatique bénigne (cirrhose et hépatite). Depuis quelques années,
différentes techniques sont soit décrites (13), soit largement utilisées (14) pour
détecter plus spécifiquement l’AFP produite par les cellules malignes. Ces tech-
niques sont basées sur la détection de variants glycosylés de l’AFP qui se lient
à la lectine (13) ou sur l’utilisation d’anticorps monoclonaux (14).
La LDH apparaît dans le sérum sous la forme de cinq co-enzymes qui sont
des tétramères de deux sous-unités différentes (15). De ce fait, différentes tech-
niques de dosage ne présentent pas les mêmes limites supérieures des valeurs
usuelles et, pour comparer des résultats obtenus avec des techniques différentes,
ces résultats sont quantifiés en multiple de la limite supérieure des valeurs
usuelles (16).
Deux autres molécules, la phosphatase alcaline placentaire et la neurone-
spécifique-énolase (NSE) sont parfois utilisées comme marqueurs biologiques
des tumeurs testiculaires mais leur intérêt clinique n’est pas clairement défini
(17, 18).
Les marqueurs biologiques et le diagnostic
des tumeurs testiculaires
Le diagnostic précoce d’une tumeur testiculaire dès l’apparition des pre-
miers signes cliniques est particulièrement important puisqu’un diagnostic
tardif peut compromettre les chances de rémission ou de guérison. Une étude
a montré que si la période entre les premiers symptômes cliniques et l’éta-
blissement du diagnostic ne dépassait pas trois mois, les chances de survie à
trois ans étaient de 81 %. En revanche, si le diagnostic est plus tardif, les
chances de survie sont alors de 69 % (19). Lorsque le délai entre les premiers
symptômes cliniques et le diagnostic est inférieur à un mois, 7 % des patients
ont des métastases cliniquement décelables, alors que 50 % des patients ont
des métastases décelables lorsque le délai est de six mois (20). Or, au XXIesiècle,
il n’est pas rare d’avoir à traiter des cancers testiculaires métastatiques très
avancés chez des hommes qui avaient depuis plusieurs mois une masse testi-
culaire non traitée (21). Ces hommes, dont les chances de guérison sont com-
promises, ont souvent des taux sériques élevés de marqueurs biologiques et
un dosage de ces marqueurs dès l’apparition des premiers signes cliniques
aurait alors permis l’établissement du diagnostic de tumeur du testicule.
En cas de séminome pur où, par définition, le taux d’AFP doit être négatif
(inférieur à la limite supérieure des valeurs usuelles observées chez l’adulte),
un taux d’hCG supérieur aux valeurs usuelles est observé dans 15 à 50 % des
cas (1, 22, 23) (tableau I). Chez ces patients, une élévation du taux d’hCGβ
libre est plus fréquente qu’une élévation du taux d’hCG : dans une série de
54 patients où le taux d’hCG était élevé chez 50 % des malades, une élévation
66 Cancer du testicule

du taux d’hCGβlibre a été observée chez 83 % des patients (23). Ces résul-
tats indiquent clairement que certaines tumeurs séminomateuses ne produi-
sent que l’hCGβlibre. La LDH est également un marqueur biologique des
tumeurs séminomateuses puisque 80 % de ces tumeurs présentent une élé-
vation du taux sérique de cet enzyme (1, 24).
En cas de tumeurs germinales du testicule non séminomateuses (TGNS),
le taux sérique d’AFP est élevé, selon les séries, chez 40 à 70 % des patients
(1, 22). Le taux d’hCG est supérieur aux valeurs usuelles chez 40 à 82 % des
patients, alors qu’une élévation du taux sérique d’hCGβlibre est observée chez
63 à 74 % des malades selon les séries (1, 22, 23). Enfin, la LDH est aug-
mentée chez environ 60 % des patients avec une tumeur germinale du testi-
cule non séminomateuse (1). Au total, au moins un marqueur biologique pré-
sente un taux sérique anormalement élevé chez environ 90 % des malades
avec une TGNS (22). La présence d’un taux élevé d’AFP indiquera l’existence
d’un contingent de cellules vitellines et la présence d’hCG sérique révélera un
contingent de cellules trophoblastiques au sein de la TGNS. Finalement, l’élé-
vation du taux sérique d’hCGβlibre indique la présence d’un contingent de
cellules tumorales trophoblastiques ou non trophoblastiques puisque les
tumeurs germinales non séminomateuses, et plus particulièrement les téra-
tomes, peuvent être composées de cellules d’origine histologique variée et que
la sous-unité hCGβlibre est produite par des cellules de différents types his-
tologiques (7, 22).
Les marqueurs biologiques et l’aide au pronostic
Dès le début du traitement d’une tumeur du testicule, il est important d’es-
timer son pronostic à partir de critères cliniques, radiologiques ou biologiques.
Le pronostic peut être défini notamment comme la prédiction de la réponse
au traitement, la prédiction d’une éventuelle récidive ou celle de la durée de
survie (25). Dans le cas des tumeurs du testicule, les patients sont classifiés
en trois groupes selon la probabilité d’avoir une réponse complète à la chi-
miothérapie. Une telle classification a permis l’étude de traitements visant à
réduire la toxicité sans compromettre l’efficacité chez les patients avec un bon
Marqueurs tumoraux et tumeurs germinales du testicule 67
Marqueur biologique Tumeurs séminomateuses Tumeurs non séminomateuses
AFP - 40 à 70 %
hCG 15 à 50 % 40 à 82 %
hCGβlibre 42 à 83 % 63 à 74 %
LDH 80 % 60 %
Tableau I – Pourcentage de tumeurs germinales du testicule présentant une élévation d’un
marqueur biologique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%