L`expression du patrimoine génétique

1
Séquence 2 – SN12
L’expression
du patrimoine génétique
Séquence 2
Sommaire
1. La synthèse des protéines
2. Phénotypes, génotypes et environnement
Synthèse de la séquence 2
Exercices de la séquence 2
Glossaire des séquences 1 et 2
© Cned - Académie en ligne

3
Séquence 2 – SN12
1La synthèse
des protéines
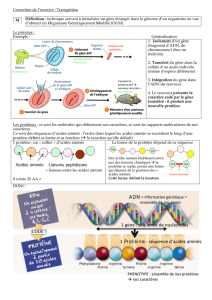
Les caractéristiques ou le phénotype d’un individu sont sous la dépendance d’une catégorie de
molécules : les protéines. Elles sont très nombreuses et constituent sa « boîte à outils », lui per-
mettant d’assurer différentes fonctions vitales comme la digestion, la production d’énergie, la
fabrication de ses constituants…
Le phénotype d’un individu dépend de son génotype dont l’expression se traduit par la synthèse
de protéines.
Introduction
Quelques protéines et leurs fonctions biologiques :
Protéines
Protéines
Fonctions
Fonctions
ADN polymérase, amylase Enzymes
Hémoglobine Protéine de transport
Ovalbumine Protéine nutritive
Actine, myosine Protéines contractiles
Collagène, kératine Protéines de structure
Anticorps Protéines de défense
Oestrogènes, insuline Protéines hormonales
On cherche donc à comprendre la cor-
respondance entre le message porté par
l’ADN (génotype) et la nature des pro-
téines fabriquées par un individu (dont
dépend son phénotype).
L’ADN est le support de l’infor-
mation génétique, c’est-à-dire de
l’ensemble des gènes (génotype)
qui déterminent les caractéris-
tiques (phénotype) d’un individu
et donc la synthèse de protéines.
Pour s’interroger
ADonnées générales sur la nature
chimique des protéines
Les protéines appartiennent à la famille des protides qui désignent des
molécules de base : les acides aminés et leurs polymères ou polypep-
tides (enchaînement d’acides aminés).
© Cned - Académie en ligne

4
Séquence 2 – SN12
Les acides aminés
Il existe 20 acides aminés différents qui ont en commun un groupement
fonctionnel acide (COOH) et un groupement fonctionnel amine (NH).
Chaque acide aminé diffère par un groupement appelé radical.
Formule générale :
R (radical variable d’un acide aminé à l’autre)
(fonction amine) NH2 C COOH (fonction acide)
H
Tableau des 20 acides aminés
Noms
Noms
Abréviations
Abréviations
3 lettres
3 lettres
Abréviations
Abréviations
1 lettre
1 lettre
Acide aspartique Asp D
Acide glutamique Glu E
Alanine Ala A
Arginine Arg R
Asparagine Asn N
Cystéine Cys C
Glutamine Gln Q
Glycine Gly G
Histidine His H
Isoleucine Ile I
Leucine Leu L
Lysine Lys K
Méthionine Met M
Phénylalanine Phe F
Proline Pro P
Sérine Ser S
Thréonine Thr T
Tryptophane Trp W
Tyrosine Tyr Y
Valine Val V
Document 1
© Cned - Académie en ligne

5
Séquence 2 – SN12
Appliquer un modèle
La glycine est un acide aminé ayant pour formule chimique globale
C2H5O2N et l’alanine C3H7O2N.
Ecrivez leur formule développée en faisant apparaître les groupements
fonctionnels.
Les acides aminés s’unissent par des liaisons covalentes appelées
liaisons peptidiques. Chaque liaison s’établit entre le groupement acide
d’un acide aminé et le groupement amine d’un autre acide aminé avec
perte d’une molécule d’eau.
Par additions successives d’acides aminés, on aboutit à une molécule
linéaire appelée polypeptide.
Les polypeptides
Comprendre le lien entre les phénomènes naturels et le langage mathé-
matique.
Écrire toutes les combinaisons possibles de tripeptides (chaines à 3
acides aminés) en utilisant 3 acides aminés différents notés A, B et C.
En utilisant 3 des 20 acides aminés différents, combien de tripeptides
peut-on envisager sachant qu’on peut utiliser plusieurs fois le même
acide aminé ?
Défi nir alors la notion de séquence d’un polypeptide.
Les protéines:
Ce sont des polypeptides dont le nombre d’acides aminés est supérieur
à 20. Certaines protéines peuvent être constituées de plusieurs centaines
d’acides aminés. On imagine donc pour des protéines constituées de 100
acides aminés l’importante diversité de leur séquence possible (20100 !)
Caractéristiques structurales des protéines
Recenser et extraire des informations
Début de la structure primaire d’une protéine : la chaîne ß de l’hémoglobine.
Activité 1
Activité 2
Activité 3
Document 2
© Cned - Académie en ligne

6
Séquence 2 – SN12
Qu’entend-on par structure primaire ?
Les acides aminés d’une séquence protéique se comportent comme des
molécules ionisées, chargées électriquement (positivement ou négative-
ment). Il peut alors s’établir des interactions (attractions ou répulsions)
entre différents acides aminés. Certaines régions de la séquence se re-
plient donnant à la protéine une confi guration spécifi que dans l’espace.
On parle de confi guration spatiale ou structure tridimensionnelle de la
protéine dont dépend sa fonction biologique.
Le simple changement d’un acide aminé peut modifi er les interactions
entre acides aminés et donc la structure tridimensionnelle d’une pro-
téine. Sa fonction peut alors changer (document3)
Interactions entre acides aminés chargés électriquement et structure
tridimensionnelle d’une protéine
Pour répondre à ces multiples
contraintes chimiques, physiques,
et électriques, la protéine
s’adapte au mieux :
Moi j’ai une
longue chaîne
carbonnée
Moi aussi
je suis
tout petit
Je suis chargé
négativement
Je déteste
l’eau
Moi je suis
énorme
avec un
gros cycle
Je suis aussi
chargé
négativement
Je suis
tout petit
Je suis chargé
positivement
Hé bien moi
j’adore l’eau
Je repousse
le 4 mais je
suis attiré
par le 9
Un acide aminé est remplacé
par un autre et voilà le résultat :
D’autres liaisons chimiques (ponts disulfure) peuvent se former entre
acides aminés soufrés de plusieurs chaînes différentes. Il existe donc des
protéines formées de plusieurs chaînes polypeptidiques (document 4).
Protéine formée de deux chaînes polypeptidiques
Document 3
Document 4
© Cned - Académie en ligne
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
1
/
50
100%