« Reconstruction Ancestrale du type de Placentation chez les

Aix – Marseille Université
Faculté des sciences de Luminy
Bioinformatique – Biochimie Structurale & Génomique
(BBSG)
Année Universitaire 2013 – 2014
RAPPORT DE STAGE
« Reconstruction Ancestrale du type de
Placentation chez les Euthériens : Recherche
d’Evolutions Convergentes et Parallèles »
Présenté et soutenue par Dardaillon Justine
Effectué dans le cadre d’une Première Année du Master BBSG,
Au sein de l’EBM (Evolution Biologique et Modélisation),
Sous la supervision du Dr Pierre Pontarotti, Directeur de recherche au CNRS.

2
SOMMAIRE
Introduction……………………...……….…………………………………....…page 3
Matériel et Méthodes……………….…...…..……………………………………page 3
Résultats………………………………………………………………………..…page 5
Discussion……………………………………………………………………...…page 6
Conclusion………………………..………...………………………………...…..page 7
Remerciement...…………………………………………………….……….....…page 7
Références………………………………………………………….……….....…page 7
ANNEXE I..…………….………………..……………………………................page 9
ANNEXE II..…………………………….………………………………….......page 10
ANNEXE III.…………………………….…………………………………...…page 11
ANNEXE IV………………………………..………………………………...…page 12
ANNEXE V.…………………………………..……………………………...…page 13

3
Introduction:
L’analyse de l’évolution convergente peut permettre de mieux comprendre les mécanismes liés à l’évolution et
permettrait, sous l’hypothèse que les mêmes gènes (suite éventuellement à des pressions environnementales similaires)
seraient impliqués dans les mêmes changements phénotypiques, de mieux prédire les sites et les changements génétiques
impliqués pour un même phénotype. La convergence évolutive peut-être définie, au sens large, par l’apparition de
manière indépendante d’un même caractère plusieurs fois au cours de l’évolution au sein de lignées phylogénétiquement
éloignées (1). On distingue généralement l’évolution convergente et l’évolution parallèle. Dans le premier cas, le même
état dérivé d’un caractère est présent chez des espèces ne partageant pas d’ancêtre commun proche et où l’état ancestral
du caractère considéré n’est pas le même. Dans l’autre cas, l’état du caractère qui est apparu plusieurs fois dérive du
même état ancestral.
A l’heure actuelle, les facteurs conduisant à l’évolution du placenta sont encore méconnus et mal compris, or
cette structure semble être apparue plusieurs fois au cours de l’évolution et ce, dans différentes lignées telles que les
reptiles et les mammifères, d’où l’importance de comprendre l’évolution du placenta et de ses membranes fœtales
associées afin de déterminer si il y a eu convergence évolutive pour l’apparition de cette structure. Même si de
nombreuses variations de la structure du placenta et des membranes fœtales associées se prêtent à l’analyse cladistique,
Mess et Carter (2007) dans une étude récente ont obtenus des résultats contradictoires qui nécessitent de réexaminer la
question avec un plus large échantillonnage et puis éventuellement, avec la génomique comparative (2, 4).
D’une manière générale, la placentation est définie comme étant la formation et la croissance du placenta à
l’intérieur de l’utérus. Sa fonction est de transférer les nutriments des tissus maternels à l’embryon qui se développe (3).
Ici, nous allons nous intéresser principalement aux Mammifères et plus particulièrement aux Euthériens (Mammifères
placentaires). En effet, il n’y a pas de placentation chez les Monotrèmes (mammifères qui pondent des œufs), et les
Marsupiaux ou Métathériens possèdent un placenta rudimentaire avec lequel il est encore aujourd’hui difficile de
comparer les structures des placentas complexes des euthériens; la gestation des Marsupiaux est généralement très courte
puisque la plus grosse partie du développement se passe dans la poche, l’embryon est accroché à une tétine maternelle (5,
6, 7). Chez les Euthériens, le placenta se forme après que l’embryon s’est implanté dans la paroi de l’utérus (3). Les
placentas sont classés en fonction du nombre de tissus qui séparent le sang maternel et fœtal mais aussi en fonction de
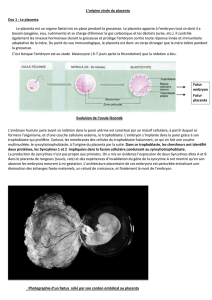
leur type d’implantation et de leur pouvoir invasif (Annexe I). Ainsi, on distingue trois grand types de placentation au
sein des Euthéria : la placentation de type épithélio-chorial où le trophoblaste (cellules délimitant la périphérie de l’œuf)
est en contact direct avec l’épithélium utérin, la placentation de type endothélio-chorial où l’épithélium utérin a disparu et
où l’endothélium des capillaires maternels est en contact avec le trophoblaste, et la placentation de type hemo-chorial où
tout les tissus maternels ont disparus et où le sang maternel est en contact direct avec le chorion fœtal (Annexe I).
L’objectif est d’effectuer une reconstruction du caractère ancestral pour le type de placentation chez les
Euthériens afin de détecter d’éventuelles évolutions parallèles pour certains états de caractère au sein de cette lignée.
Dans un autre sujet présenté par M. Graig Germany, la même approche sera réalisée sur la lignée des squamates. Il est
important d’étudier d’abord l’évolution de la placentation au sein de ces deux lignées afin de pouvoir par la suite étudier
de manière plus fiable la présence d’éventuelles évolutions convergentes entre ces lignées pour le caractère apparition du
placenta.
Dans cette étude, nous souhaitons donc, déterminer comment la membrane interhaemale (barrière entre sang
maternel et fœtal) évolue chez les Euthériens en tentant de définir le type de barrière placentaire présent dans le plus
récent Ancêtre Commun des mammifères placentaires. Par des reconstructions ancestrales du caractère « type de
placentation » via l’interface Mesquite, nous allons rechercher les cas de convergences évolutives puis, par la suite, ces
cas seront appuyés ou réfutés par la recherche de signatures génomiques.
Matériel et Méthodes :
Création d’un jeu de donnée
La première partie de cette étude a consisté à rechercher et sélectionner le plus grand nombre d’espèces
possibles (225 au total) et à déterminer leur type de placentation parmi les trois grands types décrits précédemment
(Annexe V). Nous avons essayé de réaliser le plus grand échantillonnage possible afin de représenter au mieux
l’ensemble des groupes et sous-groupes phylogénétiques présents chez les Euthériens. Pour chaque espèce, nous avons
ensuite cherché leur type de placentation respectif via la recherche d’articles scientifiques à l’aide du moteur de recherche
Web of Sciences et de la base de donnée BiblioVie (8). Ainsi, lors des reconstructions ancestrale qui seront réalisées

4
ultérieurement via l’interface Mesquite, le jeu de donnée réalisé sera rentré sous la forme d’une matrice contenant les
noms des espèces et les états du caractère pour chacune d’elles (type de placentation : 0 pour les monotrèmes, 4 pour les
placentas des Marsupiaux, 1 pour les placentas épithélio-choriaux, 2 pour les placentas endothélio-choriaux et 3 pour les
placentas hemo-choriaux).
Création de modèles d’arbres phylogénétiques représentant les Euthériens
Dans un deuxième temps, la phylogénie des mammifères ne pouvant à l’heure actuelle être résolue de manière
absolue (9), nous avons choisi de réaliser nos propres arbres phylogénétiques comprenant l’ensemble des espèces que
nous allons par la suite considérer. De la même manière que précédemment et à l’aide notamment de Taxonomy
Browser, nous avons donc cherché des articles présentant la phylogénie des mammifères et permettant de placer sur nos
arbres chacune des espèces de notre sélection. Les différents arbres trouvés lors de cette recherche bibliographique nous
ont permis d’obtenir l’ensemble des topologies possibles de la phylogénie des mammifères que nous considérons. Les
différents modèles d’arbres obtenus à cette étape sont entrés au format nexus sur l’interface Mesquite afin de pouvoir
réaliser la reconstruction ancestrale du caractère pour chacun d’eux avec la matrice obtenue précédemment.
Reconstruction ancestrale du caractère via l’interface Mesquite version 2.75 for Windows (1GB
memory dedicated)
Mesquite est un outil bioinformatique utilisant le langage Java et regroupant un ensemble de logiciels permettant
notamment l’analyse phylogénétique d’organismes et l’analyse comparative de données propres à ces organismes.
L’interface Mesquite propose ainsi, et entre autre, la possibilité d’effectuer des reconstructions ancestrales de caractère.
La reconstruction ancestrale d’un caractère permet, lorsque les données fossiles sont inconnues, d’inférer les états actuels
des espèces et de déterminer à chaque nœud de l’arbre l’état le plus probable du caractère considéré, et ce, à l’aide
d’algorithmes mathématiques donnant les probabilités de présence et d’absence pour chacun des états à chaque nœud
considéré.
Dans un premier temps, nous avons réalisé la reconstruction ancestrale du caractère « type de placentation »
pour chacun des arbres modèles avec la matrice précédente via la méthode de parcimonie qui permet de choisir la
représentation pour laquelle le nombre de changement évolutif est le plus minime. Dans un second temps, nous avons de
nouveau réalisé la reconstruction ancestrale du caractère pour chacun des arbres modèles via, cette fois-ci, la méthode du
maximum de vraisemblance qui consiste à rechercher l’état ancestral le plus probable selon un modèle d’évolution
stochastique, ici, le modèle choisi est le modèle Mk1 ("Markov k-state 1 parameter model") ou modèle de Markov à un
paramètre (c’est-à-dire que le seul paramètre pris en compte est le taux de transitions qui est symétrique et où tout les
types de changement ont la même probabilité de se produire). Dans notre étude, ce paramètre a été optimisé à 1.00
[optimization of parameter of Mk1 model : 1.00].
Recherche des espèces dont le génome est disponible
Ensuite, nous avons recherché parmi nos 225 espèces, celles dont le génome était déjà intégralement séquencé et
publié en consultant les bases de données telles qu’EnsemBL Genome, GOLD Genome Online Database et Genome 10
K Project. Nous avons ainsi regardé si les différents groupes présents dans notre arbre étaient suffisamment bien
représentés afin d’éviter la perte trop significative d’informations par la suite. Dans le cas de groupes non représentés,
nous avons alors établis une liste de génomes à éventuellement proposer pour être séquencés.
Recherche de signatures génomiques de convergence évolutive
Enfin, sur le même principe que l’étude menée par Parker et al. (2013), nous avons récupéré les arbres
phylogénétiques après la reconstruction ancestrale du caractère et nous avons supprimé toutes les espèces dont le génome
n’était pas disponible (10). L’arbre obtenu correspond à l’hypothèse H0, puis nous avons mis en opposition notre
hypothèse de départ H0 (arbre phylogénétique d'origine) avec des topologies alternatives mettant les espèces présentant
des caractères convergents ensemble (monophylie du groupe considéré, topologie obtenue à la main). Le groupe
monophylétique ainsi obtenu est placé au niveau du dernier ancêtre commun observé pour les caractères convergents
considérés. D’une part, pour le cas de l’état épithélio-chorial et d’autre part pour l’état endothélio-chorial, nous
souhaitons tester les différentes topologies afin de trouver d’éventuelles signatures génomiques appuyant la convergence
évolutive considérée. Nous avons finalement choisi (comme dans l’étude de Parker et al. (2013)) d’éliminer les deux
groupes extérieurs qui représentaient les marsupiaux et les monotrèmes (10).

5
Résultats:
Création de modèles d’arbres phylogénétiques représentant les Euthériens
Au cours de notre recherche, nous avons trouvé 4 zones de variation possibles qui nous ont permis d’obtenir 24
topologies d’arbres phylogénétiques possibles (Annexe II). La zone de variation la plus importante pour nos résultats
étant sans doute au niveau des clades Afrotheria et Xenarthra qui sont des groupes frères suivant certaines études, il s’agit
en réalité de l’hypothèse de l’existence du groupe monophylétique des Atlantogenata regroupant les deux groupes
précédents (arbre 1 à 12). Afin de savoir si ces différences de topologies influent sur la reconstruction du caractère
ancestral, nous avons choisi de tester à chaque fois les 24 topologies obtenues.
Reconstruction ancestrale du caractère via l’interface Mesquite version 2.75 for Windows (1GB
memory dedicated)
Lorsqu’on observe l’ensemble des 48 reconstructions ancestrales du caractère obtenues (24 topologies testées
suivant le Maximum de Parcimonie et suivant le Maximum de Vraisemblance), on observe dans tout les cas que le
caractère hemo-chorial est le caractère ancestral (les arbres ne sont pas fournis en annexe car le grand nombre d’espèces,
au total 225, les rend illisibles au format A4). Dans tous les cas également, la Hyène (Hyaena hyaena) a un placenta
hemo-chorial contrairement à l’ensemble du groupe des Carnivores dont elle fait partie qui ont un placenta endothélio-
chorial. Le caractère épithélio-chorial apparait 3 fois (chez les Perissodactyla et les Cetartiodactyla, chez Scalopus
aquaticus (Talpidae) et dans la lignée des Strepsirrhini) quelque soit la topologie testée. Le caractère endothélio-chorial
apparaît 8 ou 9 fois suivant la topologie utilisée, en effet, au niveau des Hyracoidea (hemo-chorial) et des Proboscidae et
Sirenia (endothélio-chorial) les 3 topologies étaient possibles mais une seule (celle où les groupes Proboscidae et Sirenia
sont plus proches l’un de l’autre que de Hyracoidea) donne une seule apparition pour le caractère endothéliochorial.
Quelques différences sont observables sur les reconstructions du caractère ancestral réalisées avec le Maximum de
Vraisemblance. Pour les arbres 1 à 13, 16, 19 et 22, le caractère ancestral est le caractère hemo-chorial avec une
probabilité de 0,9999. Pour les arbres 14, 15, 17, 18, 20, 21, 23 et 24, le caractère ancestral est hemo-chorial avec une
probabilité avoisinant 0,55 mais le caractère endothélio-chorial a également une probabilité d’environ 0,28 d’être le
caractère ancestral.
Figure 1 : Reconstruction ancestrale du caractère « type de placentation » sur l’arbre 1 via le Maximum de Parcimonie.
On peut voir ici en blanc, le groupe
extérieur des Monotrèmes et en noir, le
groupe extérieur des Marsupiaux. On
voit également les 4 grands clades
constituant le groupe des Eutheria
(Euarchontoglires, Laurasiatheria,
Xenarthra et Afrotheria qui forment ici
le groupe monophylétique des
Atlantogenata).
Recherche des espèces dont le génome est disponible
La liste des 32 espèces dont le génome est disponible est fournie en Annexe V avec la liste des espèces qu’il
serait utile de séquencer par la suite pour obtenir un arbre plus précis et plus informatif.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%