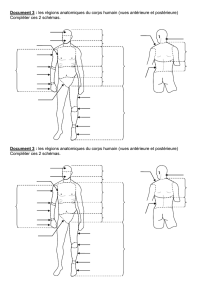
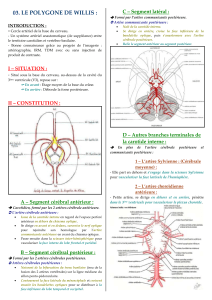
Radio-Anatomie de la partie antérieure du cercle artériel du cerveau

UNIVERSITE DE NANTES
FACULTE DE MEDECINE
MASTER I SCIENCES BIOLOGIQUES ET MEDICALES
UNITE D’ENSEIGNEMENT OPTIONNEL
MEMOIRE REALISE dans le cadre du CERTIFICAT d’ANATOMIE,
d’IMAGERIE et de MORPHOGENESE
2010-2011
UNIVERSITE DE NANTES
Radio-Anatomie de la partie antérieure du cercle artériel du
cerveau : variations anatomiques et pathologie anévrysmale
Par
LE RHUN Marianne
LABORATOIRE D’ANATOMIE DE LA FACULTE DE MEDECINE DE NANTES
Président du jury : Pr. R. ROBERT
Vice-Président : Pr. J.M. ROGEZ
Enseignants : • Pr. O. ARMSTRONG
• Pr. O. BARON
• Pr. G. BERRUT
• Pr. C. BEAUVILLAIN
• Pr. D. CROCHET
• Pr. H. DESAL
• Pr. B. DUPAS
• Dr E. FRAMPAS
• Dr A. HAMEL
• Dr O. HAMEL
• Pr. Y. HELOURY
• Pr A. KERSAINT-GILLY
• Pr. J. LE BORGNE
• Dr M.D. LECLAIR
• Pr. P.A. LEHUR
• Pr. O. RODAT
Laboratoire : S. LAGIER et Y. BLIN - Collaboration Technique

UNIVERSITE DE NANTES
FACULTE DE MEDECINE
MASTER I SCIENCES BIOLOGIQUES ET MEDICALES
UNITE D’ENSEIGNEMENT OPTIONNEL
MEMOIRE REALISE dans le cadre du CERTIFICAT d’ANATOMIE,
d’IMAGERIE et de MORPHOGENESE
2010-2011
UNIVERSITE DE NANTES
Radio-Anatomie de la partie antérieure du cercle artériel du
cerveau : variations anatomiques et pathologie anévrysmale
Par
LE RHUN Marianne
LABORATOIRE D’ANATOMIE DE LA FACULTE DE MEDECINE DE NANTES
Président du jury : Pr. R. ROBERT
Vice-Président : Pr. J.M. ROGEZ
Enseignants : • Pr. O. ARMSTRONG
• Pr. O. BARON
• Pr. G. BERRUT
• Pr. C. BEAUVILLAIN
• Pr. D. CROCHET
• Pr. H. DESAL
• Pr. B. DUPAS
• Dr E. FRAMPAS
• Dr A. HAMEL
• Dr O. HAMEL
• Pr. Y. HELOURY
• Pr A. KERSAINT-GILLY
• Pr. J. LE BORGNE
• Dr M.D. LECLAIR
• Pr. P.A. LEHUR
• Pr. O. RODAT
Laboratoire : S. LAGIER et Y. BLIN - Collaboration Technique

Remerciements
Au Pr Olivier Hamel pour m’avoir proposé ce sujet passionnant, pour ses conseils, ses
encouragements et sa disponibilité.
Au Pr Hubert Desal pour le temps qu’il m’a généreusement accordé, pour l’intérêt qu’il
porte à mon sujet, pour les magnifiques images qu’il m’a fait découvrir, pour son aide… tout
simplement pour le passionné qu’il est.
Au Pr Roger Robert pour m’avoir fait découvrir et aimer la Neuro-Anatomie et pour
m’avoir donné la chance de faire ce Master d’Anatomie.
Au Dr Jean-Michel N’Guyen pour son aide précieuse en statistique.
A Messieurs Stéphane Lagier et Yvan Blin pour leur aide et leur humour qui m’ont été
indispensables lors de mes dissections.
A l’ensemble de nos Professeurs d’Anatomie pour la qualité de l’enseignement qu’ils nous
ont offert et pour nous avoir transmis avec passion et dévouement le goût pour cette
formidable matière.
A toute l’équipe du Service de Neuro-Radiologie Diagnostique et Interventionnelle de
l’Hôpital G. et R. Laënnec du CHU de Nantes pour m’avoir accueillie et m’avoir aidée dans
mes analyses.
A François pour ses encouragements et ses indispensables conseils tout au long de ces années.
A tous mes camarades de Master qui ont partagé ces heures d’analyse d’imagerie et de
dissections. Ces moments resteront inoubliables.
A mes proches pour leur présence, leur soutien, leur aide… à chaque instant.

Table des matières
Introduction
1. Rappels anatomiques
1.1. Embryologie
1.2. Anatomie modale
1.2.1. Artère Cérébrale Antérieure
1.2.2. Artère Communicante antérieure
2. Matériel et méthodes
2.1. Patients
2.2. Angioscanner Multi-Détecteurs
2.3. Analyse des données
2.4. Analyse statistique
3. Résultats
3.1. Patients
3.2. Variations anatomiques
4. Discussion
Conclusion
Références bibliographiques
Liste des abréviations

Introduction
Le cercle artériel de la base du cerveau (CAC) est un système d’anastomose entre les
circulations carotidienne et vertébrale. Il constitue un moyen de suppléance majeur en cas
d’interruption du flux artériel. Un CAC complet et normal n’est présent que dans 50% des
cas. De nombreuses variations anatomiques prédominant sur la partie antérieure du CAC ont
été décrites (1). Une connaissance de l’embryologie permet de mieux comprendre l’origine de
ces variations. Certains auteurs ont suggéré une forte association entre les variations
anatomiques et le développement d’anévrysmes intra-crâniens (AIC) (2,3).
Un AIC est une hernie de la paroi d’une artère cérébrale dont la complication presque
exclusive est la rupture, responsable de la plupart des hémorragies sub-arachnoïdiennes
(HSA). La partie antérieure du CAC et notamment l’artère communicante antérieure (ACoA)
est le site le plus fréquent (25-40%) des AIC (1,2).
L’angiographie rotationnelle 3D (AR3D) est la technique de référence pour l’analyse de la
vascularisation cérébrale. L’angioscanner multi-détecteurs (AMD) est cependant devenu
l’examen de première intention en cas de suspicion d’HSA en raison de sa simplicité de
réalisation et de son innocuité (4). Il permet non seulement la détection des AIC mais
également la discussion de la méthode thérapeutique la plus adaptée.
Le but de notre travail a été de rechercher une association entre les variations anatomiques de
la partie antérieure du CAC et le risque anévrysmal.
Dans un premier temps nous rappellerons les principales bases anatomiques de la partie
antérieure du CAC. Nous étudierons ensuite, grâce à l’analyse de nombreux AMD, la
prévalence et le type de variations anatomiques observées en cas d’anévrysme de la partie
antérieure du CAC et d’AIC d’autre localisation. Enfin, nous confronterons nos résultats à
ceux des études menées précédemment.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%