B. Mialhe memoire

1
UNIVERSITE CLAUDE BERNARD LYON 1
LE CANCER DU SEIN
DE PHENOTYPE BASAL
Mémoire du diplôme d’études spécialisées en anatomie pathologique
Soutenu par Blandine MORELLON MIALHE
Le 29 Septembre 2008
Sous la direction du Dr Isabelle Treilleux
Composition du jury :
- Madame le Professeur E. BRAMBILLA (CHU Grenoble)
- Monsieur le Professeur M. PEOCH (CHU Saint Etienne)
- Madame le Professeur M. DEVOUASSOUX-SHISHEBORAN (CHU Lyon)
- Madame le Professeur F. THIVOLET-BEJUI (CHU Lyon :
coordonnateur interrégional).

2
SOMMAIRE
1. INTRODUCTION..............................................................................p3
2. LE PHENOTYPE BASAL EN IMMUNOHISTOCHIMIE
2.1 Les cytokératines de type basal .....................................................p7
2.2 Les récepteurs hormonaux ............................................................p8
2.3 La famille HER ............................................................................p9
2.4 Marqueurs myoépithéliaux ............................................................p11
2.5 Autres marqueurs étudiés..............................................................p13
2.6 Problème des CK8 et 18 ...............................................................p13
2.7 Synthèse immunohistochimie/corrélations au pronostic ...................p14
3. CRITERES MORPHOLOGIQUES ET GRADE SBR ASSOCIES AU
PHENOTYPE BASAL
3.1 Carcinomes Sporadiques ...............................................................p16
3.1.1 Forte activité mitotique .................................................................. p16
3.1.2 Nécrose tumorale ........................................................................... p17
3.1.3 Infiltration de type « pushing » ....................................................... p17
3.1.4 Stroma lymphoplasmocytaire .......................................................... p17
3.1.5 Autres caractéristiques morphologiques ........................................... p18
3.1.6 Grade SBR .................................................................................... p18
3.2 Carcinomes Liés à des mutations de BRCA1 ..................................p19
4. SOUS TYPES HISTOLOGIQUES ASSOCIES AU PHENOTYPE BASAL
4.1 Carcinomes médullaires et carcinomes médullaires atypiques ..........p21
4.2 Carcinomes métaplasiques de haut grade .......................................p22
4.3 Carcinomes de type myoépithélial .................................................p23
4.4 Autres types histologiques ............................................................p24
4.5 Carcinomes in situ (CIS) de type basal ..........................................p24
5. CONCLUSION
5.1 Le phénotype basal en routine : tumeurs triple négatives ? ..............p26
5.2 Perspectives thérapeutiques pour les tumeurs du sein de mauvais
pronostic ...........................................................................................p28
6. REFERENCES ..................................................................................p30
TABLEAUX

3
1. INTRODUCTION
Le cancer du sein affecte environ 10% des femmes dans les pays
occidentaux et reste une des causes majeures de mortalité et de morbidité
dans cette population. En effet, malgré les progrès accomplis, la survie stagne
autour de 70% à 5 ans. Grâce à un dépistage de plus en plus précoce, le
diagnostic est établi à un stade localisé sans envahissement ganglionnaire
pour environ 62% des tumeurs (1). La plupart de ces patientes peuvent alors
recevoir un traitement associant chirurgie et radiothérapie locale plus ou
moins associées à une hormonothérapie. Une chimiothérapie est proposée aux
patientes ayant une tumeur plus agressive. Les groupes à risque nécessitant un
tel traitement adjuvant sont habituellement sélectionnés grâce à une
combinaison de critères pronostiques cliniques et histologiques classiques et
bien connus tels que l’âge, la taille de la tumeur, le statut ganglionnaire, le
grade de Scarff-Bloom-Richardson (SBR), le statut hormonal, le statut HER2
(Human Epidermal Growth factor Receptor-2) et les emboles vasculaires.
Cependant, la fiabilité de ces facteurs pour prédire l’évolution de la
maladie et son issue clinique n’est pas parfaite. En effet, on estime que sur 10
femmes recevant de la chimiothérapie adjuvante pour un cancer mammaire
sans envahissement ganglionnaire, seulement une a survécu grâce à cette
thérapeutique adjuvante. Deux d’entre elles meurent en dépit du traitement et
sept auraient survécu même sans ce traitement. Autrement dit, la
chimiothérapie proposée aux patientes sans envahissement ganglionnaire est
inutile dans 90% des cas et ne bénéficie qu’à 10% d’entre elles. De
nombreuses patientes ne sont donc pas traitées de la manière la plus adaptée.
Elles reçoivent des thérapeutiques inutiles qui comportent de nombreux effets
secondaires et qui présentent un coût économique non négligeable. Il parait
donc indispensable d’identifier de nouveaux critères pouvant s’ajouter ou
remplacer les facteurs pronostiques classiques afin de mieux sélectionner les
groupes de patientes nécessitant des thérapeutiques adjuvantes.

4
Les progrès récents sur la connaissance du génome humain et l’utilisation
des biopuces pour l’étude des tumeurs ont révolutionné la façon dont les
chercheurs peuvent étudier la pathogénie d’une maladie (2). L’analyse
simultanée de l’expression de milliers de gènes grâce aux « microarrays à
ADN » ou puces à ADN a permis de dégager des profils d’expression
génétique permettant de classer les tumeurs mammaires en fonction de leur
agressivité. Ainsi par la mesure simultanée du niveau d’expression d’ARNm,
les puces à ADN permettent d’aborder la complexité moléculaire des tumeurs
et d’établir le support de leur hétérogénéité évolutive.
La première classification des tumeurs du sein suivant leur profil
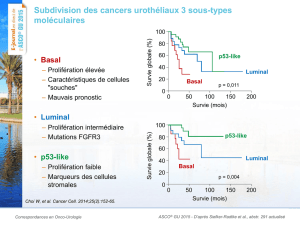
d’expression génique a été publiée en 2000 par Perou et al. (3). Les tumeurs
du sein étaient classées en quatre catégories définies chacune par le niveau
d’expression de groupes de gènes ou « clusters » et par leur pronostic. Par
ordre de pronostic du plus favorable au plus défavorable ont été décrits les
phénotypes suivants : luminal A (exprimant le récepteur aux oestrogènes),
luminal B (exprimant le récepteur aux oestrogènes mais avec soit un grade de
SBR élevé soit une surexpression de HER2), basal et HER2+ (mais sans
expression du récepteur aux oestrogènes). Les deux derniers profils (basal et
HER2+) montraient une survie globale plus courte que les phénotypes
luminaux A et B. Le phénotype basal comportait des ARNm exprimés
normalement dans les cellules myoépithéliales du tissu mammaire normal.
L’immunohistochimie effectuée sur la contrepartie fixée des tumeurs utilisées
pour les puces à ADN confirmait que les protéines correspondantes étaient
bien exprimées en montrant une positivité en immunohistochimie avec les
anti-cytokératines de type 5/6 ou 17. Le phénotype luminal lui était associé à
l’expression des cytokératines (CK) 8/18 et à un ensemble de facteurs de
transcription liés au récepteur aux œstrogènes.
Dans une autre approche mais toujours à partir de puces à ADN, Van’t
Veer et al. (4) ont identifié une série de 70 gènes dont le profil d’expression
permettait de séparer les tumeurs de bon pronostic de celles de mauvais
pronostic chez des patientes sans envahissement ganglionnaire. Van de Viger
et al. (5) ont validé cette signature de 70 gènes (encore appelée signature

5
d’Amsterdam) pour des patientes présentant un envahissement ganglionnaire.
Dans ces deux études il a été montré que le profil d’expression génique d’une
tumeur prédisait mieux son pronostic que les critères classiques
habituellement utilisés. De façon surprenante, il n’y a pas de concordance
entre les gènes identifiés par la signature d’Amsterdam (4,5) et par les
phénotypes non luminaux de Pérou (3). Cependant, une tumeur appartenant au
phénotype basal se retrouve aussi classée dans le groupe des tumeurs de
mauvais pronostic selon la signature d’Amsterdam.
Quant aux mécanismes de carcinogenèse, ils se sont développés à partir
des connaissances concernant la glande mammaire normale qui contient au
moins 3 types de « cellules épithéliales » : des cellules luminales situées dans
la lumière, des cellules basales ou myoépithéliales contre la membrane basale
et des progéniteurs qui permettraient le renouvellement des tissus. Les
différentes lignes de différenciation seraient associées à des expressions
différentes des cytokératines. Ainsi les marqueurs définitifs des progéniteurs
seraient la CK5/6 et la CK14. Les cellules luminales exprimeraient la CK8/18
et la CK19 à la différence des cellules basales exprimant plus volontiers la
CK5/6. Au cours de la maturation ces profils seraient évolutifs et il existerait
de nombreux stades intermédiaires d’expression des cytokératines (6). La
couche basale dans la glande mammaire qui est faite de cellules cubiques ou
fusiformes exprime aussi des marqueurs musculaires lisses tels que l’Actine
Musculaire Lisse, la Calponine, la p63 et la PS100 (7,8). C’est pourquoi on
parle souvent de phénotype basal/myoépithélial.
Au terme de ces analyses par biologie moléculaire et des connaissances
des différents composants de la glande mammaire normale, les pathologistes
ont cherché à définir le profil immunohistochimique du cancer du sein de type
basal en utilisant les marqueurs dont ils disposaient. Par la suite ils ont
essayé de décrire les caractéristiques morphologiques de ces cancers puis
d’identifier au sein des carcinomes infiltrants à quels sous-types
histologiques correspondaient le phénotype basal. C’est en suivant cette
démarche que nous proposons d’exposer l’état actuel de nos connaissances sur
le cancer du sein de type basal. Puis nous essayerons d’envisager si la mise
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
1
/
61
100%