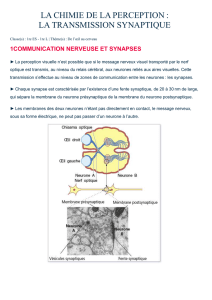
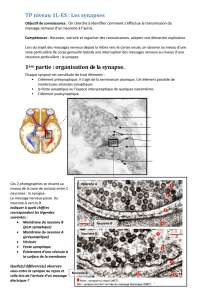
neurotransmetteurs

1
NEUROTRANSMETTEURS
4) Les récepteurs métabotropiques :
a. Les récepteurs couplés aux protéines G
Ce sont des récepteurs qui ne constituent pas un canal ionique.
Plus de 100 récepteurs :
• α et ß adrénergiques (Et pour chacun des récepteurs a et b, des sous types :
α1-2 et ß1-3)
• muscariniques à l’acétylcholine (5 sous types : m1-5)
• Récepteurs ionotropiques GABA-A ??
• Récepteur métabotropique GABA – B
• métabotropiques du glutamate (mGluR1-6)
• dopamine (D1-5)
• sérotonine
• neuropeptides
• rhodopsine.
1. Aspect de la protéine G :
Ces récepteurs ont tous en commun d’utiliser une protéine membranaire, la
protéine G formée de 3 sous unités : alpha, beta et gamma.
ils vont pouvoir agir sur la polarité membranaire, sur l’efficacité de la synapse :
• soit en agissant directement sur les canaux ioniques
• ou en agissant par l’intermédiaire de 2nd messagers.
La protéine G tient son nom du fait que la sous-unité alpha se lie à un dérivé de la
guanine comme le GTP, GDP.
Ce récepteur à la protéine G est localisé AND la face post synaptique et la protéine G
est liée au récepteur, à la face interne de la cellule post synaptique.
1 - Liaison du NT au Récepteur
2 - AND la liaison GDP avec la sous-unité alpha, GDP -> GTP.
Ö Constitue la forme active de la protéine G ?.
Puis scission, dissociation de la sous unité alpha liée au GTP d’une part, et des
sous-unités bêta et gamma d’autre part.

3 - La protéine G dans sa forme active peut :
• soit agir soit indirectement sur un second messager qui lui ouvre ou
ferme les canaux ioniques
neurotransmetteur.
aux ioniques :
ue à l’acétylcholine
• soit agir directement sur un canal ionique : dans ce cas, chacune de ses
parties, la sous-unité « alpha » ou « bêta et gamma » peut être la
protéine effectrice qui aura une action directe AND canaux ioniques.
Puis AND la sous unité Alpha il
y a une activité enzymatique
qui va permettre, à nouveau
de transformer les GTP en
GDP. Ainsi, cette sous-unité
alpha se lie aux sous unités
bêta et gamma pour
constituer la forme inactive de
la protéine G qui peut
répondre à nouveau au
2. Modulation directe des canaux ioniques :
Pour leurs possibilités d’action directe sur les can
Î Le Récepteur muscariniq
Î Le Récepteur GABA B :
Dans ce cas, c’est la sous unité
alpha liée au GDP qui constitue
forme active et effectrice de la
protéine G et se lie à des canaux
potassique
la
s pour déclenchent leur
ser
biteur).
t
D la
donc la
équence cardiaque.
ouverture
Ö flux sortant de potassium
Ö hyperpolarisation de la cellule
Ö Diminution les possibilités de réali
un PA (c’est un effet inhi
Exemple : Le récepteur
muscarinique à l’acétylcholine rédui
AND cœur l’émission de PA AN
fibre myocardique, et
fr
2

3
Ces voies de transmission qui utilisent la protéine G avec une modulation
directe des canaux ioniques agissent avec un délai de 30 à 100 ms après liaison
du NT à son récepteur.
Même si cet effet est relativement direct, on a un délai supplémentaire par
rapport aux récepteurs ionotropiques, donc une latence + importante d’action
de ces récepteurs métabotropiques.
Et une durée d’action plus importante dans le temps : quelques secondes à
quelques minutes.
L’activité se fait dans un espace proche de la localisation des récepteurs
protéines G. Le déplacement de la sous unité alpha ou des sous unités bêta et
ues dans un environnement proche de la
gamma ne peut pas se faire à distance
Ö Agissent sur des canaux ioniq
membrane post synaptique.
Donc on agit sur la polarité de la face post synaptique.
3. Modulation indirecte par les seconds messagers :
Action directe de la protéine G sur le canal ionique ≠ action indirecte :
l’effet de l’activation de la protéine G peut être plus ralenti si les parties actives
de la protéine G sont effectrices sur des enzymes intra cellulaire.
3 grandes enzymes qui peuvent être stimulées par les protéines G :
• L’adénine cyclase
• La phospholipase C
• La phospholipase a2
Ces enzymes elles mêmes vont activer des 2nd messagers :
a phospholipase C
• l’AMPc pour l’adénylcyclase,
• diaglycéral et IP3 (= inositol triphosphate) pour l
• l’acide arachidonique pour la phospholipase A2.
Enfin, après une cascade enzymatique et biochimique, activation de protéines
inases.
ifférents niveaux de l’efficacité
de la synapse (peuvent agir sur les canaux ioniques).
k
Protéines kinases = des molécules intra cellulaire qui peuvent diffuser dans le milieu
intra cellulaire voire le milieu extra cellulaire et agir à d

Les effets des protéines kinases : se fait à différents niveaux :
1è possibilité = action sur la libération des neurotransmetteurs AND neurone
pré synaptique : on parle d’un effet rétrograde de la diffusion des protéines
kinases AND la cellule pré synaptique.
Ces protéines kinases peuvent agir AND récepteurs ionotropiques, dans le sens
d’une ouverture ou fermeture. Ils peuvent agir soit sur les canaux potassiques,
soit sur les canaux calciques.
• En agissant sur les Canaux potassiques
Ö modification de la variation de polarisation de la membrane : faire
durer la période d’inversion de polarité ou au contraire la raccourcir
Ö cela fait varier la sensibilité des protéines canaux au calcium
sensibles au voltage AND la terminaison axonale.
Si on change le voltage de la terminaison axonale en jouant sur les
canaux potassiques, on change les possibilités de variation des
entrées de calcium dans la cellule.
• Ou on agit AND protéines canaux calciques qu’on ouvre ou qu’on ferme
Ö module la concentration de Ca de la terminaison axonale,
Ö module la libération de neurotransmetteurs, normalement libérés à
taux constant en fonction de l’arrivée des PA.
2è possibilité = On joue sur la réponse des récepteurs ionotropiques au
neurotransmetteur
Ö Facilitation d’action des récepteurs ionotropiques ou inhibition de leur action.
4

5
3è possibilité : on peut aussi agir AND canaux ioniques (canaux sodiques)
dépendant du voltage du neurone post synaptique qui sont responsables de la
réponse à la dépolarisation et donc de la possibilité d’émettre un PA
Ö On peut moduler la réponse à la dépolarisation membranaire.
Dernier mode d’action du 2nd messager : peuvent agir en modifiant l’expression
de gènes, en augmentant par exemple la création d’enzymes ou de nouvelles
protéines de membrane qui peuvent être des récepteurs ionotropiques, canaux
ioniques…
Ö On créé une possibilité de modification AND neurones de la capacité de
réponse au neurotransmetteur, de la capacité de diffusion du potentiel local
voire des capacités d’émission du PA.
La différence par rapport à l’action directe de la protéine G sur les récepteurs
ionotropiques :
C’est une action qui va diffuser dans la cellule, dans le neurone pré synaptique
C’est une action beaucoup plus longue
Et qui peut jouer sur la création de nouvelle protéine membranaire, donc
durable dans le temps.
Pour les phénomènes de modification plastique des réponses entre 2 neurones,
les capacités d’apprentissage, la mémorisation. Passe par la transcription
génique et la création de nouvelles protéines de membrane.
Autre cas : le récepteur tyrosine kinase qui appartient aux récepteurs
métabotropiques mais qui n’implique pas de protéine G.
Ces récepteurs sont spécifiquement activés par des hormones ou par des
facteurs de croissance, ou encore par des neurotransmetteurs de type neuro
peptides.
Constitution d’une enzyme qui engendre sa propre phosphorylation et qui active
d’autres protéines (donc qui inclue des protéines kinases).
Ö on se retrouve dans la même logique que les récepteurs à la protéine G avec
2nd messager.
On active une enzyme activant des protéines incluant des kinases et on va avoir
les mêmes modes d’action que les protéines kinases.
• Rq : Contrairement à la synapse électrique extrêmement rapide, unidirectionnelle,
une synapse chimique qui implique un récepteur ionotropique a des effets à court
terme, une action rapide mais peu durables dans le temps
• Rq : Et récepteurs métabotropiques : utilisation de 2nd messagers
Ö agissent avec une certaine latence. Pas de réponse neuronale immédiate mais
lente et durable dans le temps
Ö plus impliqué dans les formes d’apprentissage, mémorisation que les réponses
directes, motrices, réflexes qui impliquent des récepteurs ionotropiques.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%