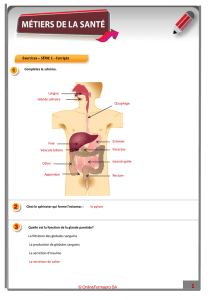
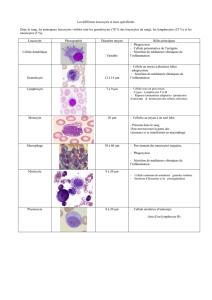
Aucun titre de diapositive

Les Interférons et leurs applications
thérapeutiques.
Patrick Blanco.
Laboratoire d’Immunologie.
Service de Médecine Interne et Maladies Infectieuses.
CHU Bordeaux.

50 ans d’Histoire
1957
IFN induit
par virus
1964
Protection infection
virale par IFN
chez souris
1969
Activité anti tumorale
de l’IFN chez souris
1970
IFNs = une famille
1973
Essai clinique
1975
IFNg
1976
Rôle IFN chez homme
pour traiter HBV
Rôle immunologique
1977
Activité anti-tumorale
chez homme
1981
Effet dans SEP
IFN recombinant
1982
IFNgcloné
1983
Premier ISG cloné
2-5Asynthetase
1986
IFN et leucémie à
tricholeucocytes
1988
IFNg-R cloné
1990
Peg-IFN
IFN-R cloné
IFN et HCV
1993
IFN et SEP (AMM)
1997
TLR cloné
2000
IFNgchez homme
(FDA)
1957: Isaacs et Lindenmann

•Type I Interférons:
–13IFNa, 1IFNb, 1IFNw, 1IFNe, 1IFNk
–Protéines non glycosylées de 165-200 aa
–Chromosome 9
•Type II Interféron
–IFNg
–140 aa
–Chromosome 6
•Type III Interférons
–3 IFNl
Généralités

•Récepteur Type I Interférons: IFNAR
–localisation ubiquitaire
–2 chaînes associées à Tyk2 et Jak1
–Chromosome 21
•Type II Interféron: IFNGR
–localisation ubiquitaire pour IFNGR1 et restreinte et
régulée pour IFNGR2
–2 chaînes associées
–IFNGR1: Chromosome 6 et domaine de liaison à Jak1
–IFNGR2: Chromosome 21 et domaine de liaison à Jak2
•Type III Interférons:IFNLR
Généralités

•Stimuli/Sécrétion
•Signalling
•Rôle
•Implications en pathologie humaine
•Thérapeutique
PLAN
Interférons de type I Interféron de type II
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
1
/
51
100%