chapitre vi membranes extraembryonnaires, implantation et

1
CHAPITRE VI
MEMBRANES EXTRAEMBRYONNAIRES,
IMPLANTATION ET PLACENTATION
6.1. LES MEMBRANES EXTRAEMBRYONNAIRES
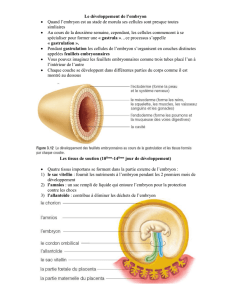
Lors de sa délimitation, l'embryon s'individualise de l'ensemble des structures
destinées à sa nutrition et à sa protection. Ces structures sont constituées par les dérivés
extraembryonnaires des trois feuillets primordiaux, l'ectoderme, l'endoderme primitif et le
mésoderme, auxquels se joignent les dérivés du trophectoderme du blastocyste. Ces
structures sont abandonnées ou résorbées à la naissance.
Quatre structures extraembryonnaires sont classiquement décrites. Leur disposition et
leurs caractéristiques histologiques diffèrent selon l'espèce.
6.1.1. Le chorion
Le chorion est la membrane la plus externe (figure 6.1). Elle est constituée du
trophectoderme (ou des cellules qui en dérivent et d'un feuillet mésodermique dérivé du
cœlome extraembryonnaire : la somatopleure. Cette membrane assure le contact direct du
conceptus avec l'utérus ou la coquille. Chez les mammifères, le chorion participe à la
formation du placenta. Le chorion ne s'observe que chez les amniotes ou vertébrés qui se sont
affranchis du milieu aqueux pour leur reproduction (reptiles, oiseaux, mammifères) ainsi que
chez les anamniotes placentaires.
6.1.2. L'amnios
Cette membrane ne se rencontre que chez les amniotes (mammifères, reptiles et
oiseaux). L'amnios reconstitue l'environnement aqueux de leurs ancêtres amphibiens et
poissons ou anamniotes. La membrane amniotique est formée de la somatopleure. Elle
entoure complètement l'embryon (figure 6.1). Il existe deux modes de formation de la cavité
amniotique :
- le schizamnios (Femme, primates, rongeurs) se forme par cavitation du massif
cellulaire surmontant l'embryon (figure 6.2).
- le pleuramnios (ruminants, cheval, carnivores, lapin) qui résulte de la fusion de replis
amniotiques (cf. chapitre V et figure 6.2). Au point de fusion apparaît le mésoamnios et après
la fusion des replis, l'amnios et le chorion sont complètement séparés par une lame
mésodermique, voire une partie de l'allantoïde.

2
La vascularisation de l'amnios est assurée par les vaisseaux allantoïdiens.
L'épithélium amniotique règle en permanence la pression dans la cavité. Cette membrane et
ce liquide ont pour fonctions :
- l'absorption des chocs
- de protéger le foetus de la déshydratation
- d'empêcher toute adhérence entre le fœtus et ses annexes
- de garantir la liberté de mouvement du fœtus
- de récupérer les premiers excrétas (méconium)
- de dilater et de lubrifier le canal pelvien lors de la délivrance chez les mammifères
placentaires (ce sont les "eaux" de la Femme et les "eaux grasses" de la jument).
6.1.3. L'allantoïde
Cette cavité se développe à partir de la portion postérieure de l'intestin primitif et
prolonge la future vessie à l'extérieur de l'embryon (figure 6.1). L'allantoïde est limitée par
l'endoderme primitif et le mésoderme extraembryonnaire dérivé de la splanchnopleure. Elle
apparaît chez tous les amniotes, mais se développe plus ou moins en fonction de l'espèce. Son
feuillet mésodermique est le lieu d'apparition du système vasculaire allantoïdien. Chez toutes
les espèces de mammifères à implantation tardive (ruminants, porc, cheval, lapin, carnivores)
ainsi que chez les oiseaux et les reptiles, l'allantoïde se développe considérablement, aux
dépens du cœlome extraembryonnaire. Il rejoint l'amnios pour former l'allanto-amnios et le
chorion pour former l'allanto-chorion, bien que le feuillet mésodermique de la
splanchnopleure ne fusionne pas complètement avec celui de la somatopleure.
La cavité allantoïdienne reste en communication avec l'intestin postérieur par le canal
allantoïdien ou canal de l'ouraque. La partie proximale de l'ouraque formera la vessie et la
partie distale le ligament vésical médian.
Les fonctions de l'allantoïde sont :
- de servir de réservoir d'eau et de déchets urinaires, surtout chez les oiseaux et les
reptiles où les petits éclosent presque secs. En fin d'incubation, l'eau du liquide allantoïdien
est récupérée et les déchets azotés (urée) sont conservés sous forme de cristaux. Chez les
mammifères, les échanges fœto-maternels permettent l'élimination de ces déchets au fur et à
mesure de leur production et ce d'autant plus efficacement que le contact fœto-maternel est
intime.
- de mettre en place le système vasculaire extraembryonnaire (respiration, nutrition et
excrétion). Ce système comprend deux artères et deux veines ombilicales. Les deux veines
fusionnent par la suite (figure 6.3)

3
6.1.4. Le sac vitellin
Le sac vitellin (ou yolk sac) est l'organe nutritif par excellence chez les embryons dérivés
d'œufs macrolécithes (oiseaux, reptiles, poissons, amphibiens et prothériens). Il est constitué
d'un feuillet dérivé de l'endoderme primitif doublé du feuillet mésodermique interne du
cœlome extraembryonnaire (splanchnopleure). Il entoure les réserves vitellines ("le jaune")
de l'oeuf et développe le système sanguin vitellin chargé de la nutrition de l'embryon (figure
6.3). Chez les mammifères placentaires, le sac vitellin apparaît, mais ne se développe pas ou
peu. Il ne renferme aucune réserve nutritive, mais met en place le système vasculaire vitellin.
Il est appelé lécithocèle. Au niveau du pôle abembryonnaire, le feuillet endodermique du sac
peut rester accolé au feuillet ectodermique du chorion sans que le mésoderme
extraembryonnaire ne les sépare. Cette zone représente l'ombilic du sac vitellin des oiseaux,
précurseur de l'omphalo-placenta de certains mammifères (cheval, chien). Chez les oiseaux,
le sac vitellin est résorbé au sein de la cavité abdominale peu avant l'éclosion. Chez les
mammifères, il régresse lors du développement de l'allantoïde.
6.1.5. Le cordon ombilical
Cette structure ne s'observe que chez les animaux placentaires. Elle s'individualise
lors du développement de la cavité amniotique qui finit par entourer complètement
l'embryon. Celui-ci n'est alors plus rattaché à ses annexes que par son cordon ombilical. Ce
dernier est bordé extérieurement par un feuillet ectodermique et contient, au sein d'un massif
mésodermique, les vaisseaux sanguins vitellins et allantoïdiens, les canaux allantoïdien et
vitellin. Suivant l'espèce et le stade du développement, certaines de ces structures
disparaissent.
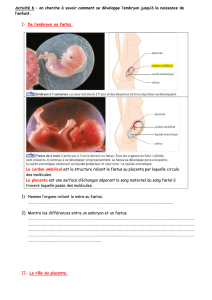
6.2. L'IMPLANTATION
L'absence de réserves nutritives chez l'oeuf microlécithe des mammifères marsupiaux
et placentaires oblige l'embryon à établir très tôt des contacts intimes avec l'organisme
maternel. L'implantation est ce processus par lequel l'embryon entre en relation étroite avec
l'organisme maternel. Il se déroule en trois phases :
- l'apposition ou simple contact de l'épithélium trophectodermique et de l'endomètre.
- l'adhésion des deux épithélia, ce qui constitue une véritable énigme, un paradoxe car
une cellule épithéliale ne peut en principe adhérer à un substrat que par son pôle basal. A
l'inverse, les deux épithélia adhèrent l'un à l'autre par leur pôle apical lors de l'implantation.

4
- l'attachement. Le chorion émet ses villosités et s'ancre véritablement dans la paroi de
l'utérus. L'importance des dégâts occasionnés à l'utérus varie en fonction du type de
placentation. Cet attachement constitue également une véritable énigme sur le plan
immunitaire.
Par la suite, une communication fonctionnelle entre les systèmes vasculaires fœtal et
maternel, ou placentation, s'établira sur toute la zone d'implantation (placentation diffuse) ou
sur une partie de celle-ci (placentation hémochoriale par exemple).
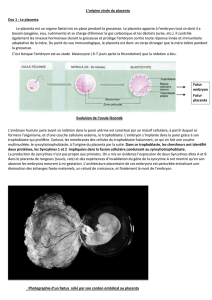
6.2.1. Les types d'implantation
On distingue plusieurs types d'implantation (figure 6.4) :
- superficielle ou centrale lorsque le chorion de l'embryon vient largement s'accoler à
l'endomètre de l'utérus. Le blastocyste occupe généralement toute la lumière utérine du fait
de son élongation (ruminants, porc, cheval, lapin). Ce sont les espèces à implantation tardive
chez lesquelles le chorion se révèle généralement peu invasif (peu ou pas de destruction de
cellules utérines).
- interstitielle ou excentrique lorsque l'embryon s'implante à un endroit restreint de
l'endomètre, souvent au fond d'une crypte (Femme, rongeurs). Ce sont des espèces à
implantation précoce et le chorion est toujours invasif (destruction importante de cellules
utérines).
6.2.2. La chronologie de l'implantation
- précoce : lorsqu'elle s'effectue immédiatement après l'éclosion du blastocyste (12-48
heures). Le trophectoderme ne s'étend pas et le blastocyste s'implante par son pôle
embryonnaire au fond d'une crypte endométriale (rongeurs, primates).
Chez les espèces polytoques (rongeurs), des contractions utérines distribuent les
embryons sur toute la longueur de la corne. Les embryons s'implantent dans des cryptes
situées en position mésométriale.
- tardive : elle s'observe chez les espèces où le trophectoderme se développe et où la
couche de Rauber disparaît (ruminants, porc, lapin). L'embryon se nourrit par imbibition et
n'établira de véritables contacts avec l'endomètre qu'après plusieurs jours ou semaines
(jument : 56 jours, vaches : 35 jours, brebis : 15 jours, chienne : 15 jours, truie : 10 jours).
- retardée : il s'agit de la diapause (cf. chapitre III)

5
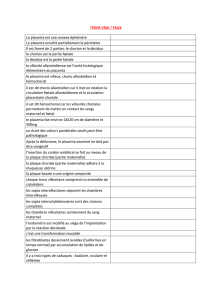
6.3. LA PLACENTATION
La placentation est la mise en place du placenta. Ce dernier représente la zone de
contact entre le chorion et l'utérus au travers de laquelle s'établiront les échanges de
substances nutritives, de gaz et de métabolites. Le placenta correspond à la totalité ou
seulement à une partie de la zone d'implantation. Il est constitué d'une partie maternelle et
d'une partie fœtale.
Il existe plusieurs systèmes de classification des différents types de placentas. Ces
systèmes ne se recoupent que partiellement.
6.3.1. Les systèmes de classification des placentas
6.3.1.1. d'après les membranes fœtales impliquées
- placenta chorio-vitellin ou omphalochorial. La partie fœtale du placenta est formée
par la juxtaposition du chorion et de la cavité vitelline. L'endoderme de la cavité vitelline est
directement en contact avec l'épithélium trophectodermique. Ce type de placenta est bien
développé chez les marsupiaux. On l'observe transitoirement chez les carnivores et la jument
où il est remplacé par un placenta allantochorial.
- placenta chorio-allantoïdien ou allantochorial. L'allantoïde et le chorion s'unissent
par leur feuillet mésodermique (splanchnique et somatique) pour former la partie fœtale du
placenta. C'est la situation la plus souvent observée chez nos mammifères.
- placenta chorio-amniotique ou amniochorial. Chez certaines espèces, la cavité
vitelline et l'allantoïde régressent. La partie fœtale du placenta est alors formée de l'union de
l'amnios et du chorion (primates). Chez d'autres espèces, la partie fœtale n'est que
partiellement formée d'un placenta amniochorial, le reste étant de type allanto-chorial (porc et
ruminants).
6.3.1.2. d'après les altérations de l'endomètre (figure 6.5)
- placenta adécidué (ou indécidu) Les interdigitations des villosités placentaires et
utérines sont peu profondes et se séparent facilement à la naissance sans entraîner
d'hémorragie ni de perte de tissu maternel. C'est le cas du placenta diffus de la truie et de la
jument ou du placenta cotylédonaire des ruminants.
- placenta décidué (ou décidu). Les interdigitations fœto-maternelles sont profondes et
ramifiées. Il y a hémorragie et perte de tissu maternel à la naissance. C'est le cas du placenta
zonaire des carnivores et discoïde des primates.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
1
/
26
100%