Infections et immunodépression DES réa

Infections et
immunodépression
Elodie Blanchard
Service des Maladies Respiratoires
Hôpital Haut Lévêque
Introduction
• Profil d’immunodépression variable
–VIH
– Transplanté d’organes ou CSH
– Corticothérapie, splénectomie…
• Urgence diagnostique et thérapeutique
• Traitement empirique bien réfléchi
• Mortalité lourde
Nombreux facteurs à prendre en
compte…
• Profil d’immunodépression
– Cellulaire: lymphopénie / neutropénie
– Humorale
– Variable selon la maladie et le traitement de la maladie
• Traitements reçus
– Pour la maladie sous-jacente
– En prophylaxie antiinfectieuse
– En traitement empirique
Plan
1. Terrain
• Profils d’immunodépression
• Traitements reçus
2. Approche diagnostique
• « DIRECT attitude »
3. Cas cliniques
Plan
1. Terrain
• Profils d’immunodépression
• Traitements reçus
2. Approche diagnostique
• « DIRECT attitude »
3. Cas cliniques
Profils d’immunodépression
Altération des défenses pulmonaires locales
• Altération du système muco-cilaire:
– Mucoviscidose
– Bronchopathie
– Radiothérapie
• Immunité muqueuse: immunité innée
– Radiothérapie
– Chimiothérapie
Neutropénie, granulopénie
• Durée
aplasie des chimiothérapies d’hémato
tumeurs solides
• Profondeur (<1000/mm3)
• Déficit quantitatif et fonctionnel (chimiotactisme, phagocytose)
• Pauvreté séméiologique des sites infectés par absence de
réaction inflammatoire
¾Attention à la sortie d’aplasie !
1. Infections bactériennes
Staph/strepto > BGN (E.Coli/Klebsiella sp./P.aeruginosa)
2. Infections fongiques
Aspergillus sp. , Candida sp, mucormycose
Incidence corrélée à la durée de la neutropénie
Déficit immunitaire humoral
• Défaut de production de gammaglobulines
• Primitif:
– DICV, SCID, X-linked agammaglobulinemia, Good…
• Secondaire:
– Hémopathie maligne: myélome, LLC
– Traitement: allogreffe de CSP, transplantation d’organes
avec immunosuppression médicamenteuse, anti-CD20
• Bactéries encapsulées:
Streptococcus pneumoniae, Haemophilus influenzae, Neisseria
meningitidis

Rôle des Ig
• Augmentation de la fréquence et de la gravité de toute
infection
• Bactéries encapsulées: Streptococcus pneumoniae,
Haemophilus influenzae, Neisseria meningitidis
Déficit immunitaire cellulaire
• Immunité adaptative
• Primitif:
SCID, DiGeorges, Wiskott-Aldrich, Sd des
lymphocytes nus
• Secondaire:
– Infection par le VIH
– Hémopathie: Hodgkin, maladies lymphoprolifératives
– Traitement: chimiothérapie (analogue des purines:
fludarabine, allogreffe de CSP, immunosuppresseurs
(CTC prolongée, SAL, ciclo, tacro, MMF, azathioprime),
anti-CD20
Exemple du VIH
• Infections pulmonaires corrélées à
l’immunité cellulaire
•Streptococcus pneumoniae
• CD4 > 200: tuberculose
• CD4 < 200: pneumocystose, Kaposi
• CD4 <100: toxoplasmose, cryptococcose,
mycobactéries atypiques, aspergillose
Déficit immunitaire cellulaire
• Bactéries:
–Pyogènes
–Legionella sp.
–Nocardia sp.
–Rhodococcus sp.
–Mycobacterium tuberculosis et non tuberculosis (avium,
xenopii, absessus…)
•Virus:
–Influenza, VRS, herpes, zona …
• Champignons
–Pneumocystis jiroveci, Aspergillus sp., coccoïdiomycose
• Parasites
–Toxoplasma gondii, Strongyloïdes stercoralis
Anti-TNF
Immunité antituberculeuse
Le TNF-Įintervient aux trois étapes
de l’immunité antituberculeuse
Les anticorps monoclonaux anti-
TNF peuvent neutraliser les trois
étapes, le récepteur soluble
n’affecte pas la formation et le
maintien du granulome
Tuberculose et anti-TNF
• Formes et délai de survenue
variables selon l’anti-TNF
utilisé
• Dépistage systématique avant
mise sous ttt
• HAS 2006:
• « Le groupe de travail a retenu
l’utilisation des tests
QuantiFERON® ou T-
SPOT.TB® (…) avant la mise
en route d’un traitement par
anti-TNFa »
Incidence et délai de survenue des
tuberculoses sous infliximab et
étanercept (d’après Wallis, 2007)
3.886.387T-spot TB
2.199.281Quantiferon
Gold
70IDR IndSpSe
Dysfonction splénique
• Situations:
– Splénectomie
– Irradiation splénique, irradiation corporelle totale
– Drépanocytose
• Organe lymphoïde secondaire
• Bactéries encapsulées +++:
Streptococcus pneumoniae, Haemophilus influenzae, Neisseria meningitidis
• Prévention:
– Vaccination pneumocoque/méningo/Haemophilus
– Prophylaxie anti-bactérienne (Oracilline) pendant 2 ans
Terrain Type
d’immunosuppression Infections
favorisées
Chimiothérapie
(tum solide/hémopathie) Neutropénie Bactéries
Champignons
LLC, Myélome, Déficits
immunitaires congénitaux
Transplantation de CSH
anti-CD20
Déficit de l’immunité
humorale Bactéries
encapsulées
Immunosuppresseur
Ac anti-CD52, SAL
Corticothérapie
Transplantation CSH
Hodgkin
Lymphoprolifération
Déficit de l’immunité
cellulaire Mycobactéries
Nocardia
Legionella
Virus
Pneumocystis,
Cryptococcus,
Histoplasma
Splénectomie, irradiation
splénique, irradiation
corporelle totale,
drépanocytose
Dysfonction splénique Pneumocoque

…et différence selon le moment
Traitements reçus
Traitement prophylactique
• Définition:
Administration d’agents anti-infectieux à une population
entière de patients afin de diminuer ou d’éradiquer le
risque infectieux de cette population
•Exemple:
– Cotrimoxazole (Bactrim®)
VIH si CD4<200, transplantation organes ou CSH (4-
12 mois), ttt par fludarabine, CTC prolongée
– Oracilline
Splénectomie, hyposplénisme secondaire (ICT)
• A prendre en compte dans les hypothèses diagnostiques
Traitement pré-emptif/empirique
•Empirique
–Définition:
Administration d’agents anti-infectieux en probabiliste à un
individu en cas d’état infectieux non expliqué
–Situation: l’attente des résultats microbiologiques pour
l’instauration d’un traitement curatif fait courrir un risque
vital au patient
–Molécules choisies selon le risque infectieux encourus par
le patient: terrain (communautaire ou nosocomial),
épidémiologie locale, traitements reçus
–Exemple: aplasie fébrile
•Préemptif:
–Definition:
Administration d’agent anti-infectieux à un individu en cas
de positivité de marqueurs microbiologiques, avant tout
signe clinique
–Exemple: PCR CMV chez le patient allogreffé de CSP
Approche diagnostique
immédiate
• Objectif: rechercher les éléments
permettant d’évoquer les dg les +
probables afin de débuter un ttt
probabiliste adapté (ttt empirique)
• Avant d’entreprendre une démarche
diagnostique visant à identifier le
pathogène responsable +++
ĺMortalité x 3 si pas de dg à J5 de l’IRA !
Causes infectieuses Causes non infectieuses
Infections bactériennes
• Bactéries pyogènes
• Bactéries intracellulaires
• Autres bactéries
Pneumocystis, Cryptococcus, Toxo
Infections fongiques invasives
• Champignons filamenteux, Levures
• Infections fongiques endémiques
Histoplasmose, coccidioidomycose
•Infections virales (primo-infections ou
réactivations)
• Virus respiratoires saisonniers
• Herpes virus
• Autres virus : adénovirus
Infections mycobactériennes
•Tuberculose et mycobactéries
atypiques
Oedème pulmonaire cardiogénique
Syndrome de fuite capillaire
Infiltration pulmonaire spécifique
Toxicité médicamenteuse
Hémorragie alvéolaire (plutôt greffe
HSCT)
Syndrome respiratoire aigu post-
transfusionnel
Pneumopathie radique
Protéinose alvéolaire
Dommage alvéolaire diffus
Bronchiolite
Bronchiolite oblitérante avec pneumonie
organisée
Second cancer
Causes d’insuffisance respiratoire aiguë chez les
patients d’oncohématologie.
Azoulay, RMR 2008
Stratégie « DIRECT »
• D: Délai depuis le début de
l’immunodépression
• I: type d’Immunodépression
• R: aspect Radiologique
• E: Expérience clinique, bibliographie
• C: tableau Clinique
• T: TDM thoracique
Azoulay, RMR 2008
Outils diagnostiques
• Imagerie : TDM thorax coupes fines
TOUJOURS !!!
Tout patient immunodéprimé doit avoir
un TDM thorax dans les 24h suivant
son admission !

Outils diagnostiques
• Fibroscopie bronchique avec LBA
– Rentabilité dg : 50 % chez hémato
–HSCT > LA
– Ag galactomannan/PCR pneumocystis
• Ponction sous TDM
–LA
– Nocardia/mycobactéries +++
Outils diagnostiques: biologie
• Sang:
– Hémocultures
–PCT
– Ag galactomannan / BD glucan
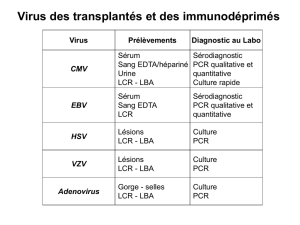
– PCR CMV / EBV
– Sérologie mycoplasma pneumoniae,
chlamydiae pneumoniae, legionnella
• Urine:
– Ag legionnelle, Streptococcus pneumoniae
Outils diagnostiques:
• ECBC
• Crachat induit : PCR pneumocystis (VIH)
• Aspiration naso-pharyngée: Virus, PCR mycoplasma
Technique: 1 KT vert sans aiguille,
seringue 1 mL, le cathéter est poussé
le long de la base de l'un cavité nasale
dans le nasopharynx, puis
récupération des sécrétions par
aspiration (si nécessaire, mettre
serum phy), puis le cathéter est rincé
par aspiration du milieu de transport
viro à travers le cathéter.
Cas cliniques
Cas clinique 1
• Mme M. 56 ans, transplantée rénale en 2010 pour
néphropathie à Ig A
• ATCD: tuberculose à l’âge de 20 ans traitée par 6 mois
de quadrithérapie, tabac 30 PA sevré
• Ttt : Rapamune (sirolimus) introduit en remplacement du
tacrolimus pour simplification, triactec
• Dyspnée d’aggravation progressive (2 semaines)
Cas clinique 1
• Fr = 30/min, SaO2
AA=89%,
T°C=38.6°C
• Crépitants des 2
champs pulmonaires
• GDS: pO2 = 65,
pCO2=37, pH = 7.38
Raisonnement
1. Terrain d’immunodépression
– Cellulaire : transplantation SOT ss IS
2. Prophylaxie ? Aucune
3. Traitements reçus ? Aucun
4. Tableau clinique
– Évolution subaigue pneumopathie
interstitielle hypoxémiante
Hypothèses diagnostiques ?
1. Pneumocystose
2. Pneumopathie CMV mais tardif
3. Pneumopathie immunoallergique au
sirolimus
4. Miliaire tuberculeuse mais traitement
5. Lymphangite carcinomateuse car
fumeuse
6. Pneumopathie à germes atypiques
(Mycoplasma pneumoniae)

Examens complémentaires
• TDM thorax coupes fines sans injection
Examens complémentaires
•Sang
– NFS: GB 9000/mm3 dont 7500 PNN, 780 L, Hb 10.5
g/dl, plq 170 000/mm3, LDH 600 UI/L, CRP 40 mg/l
– PCR CMV (+) = 900 cp/ml, PCR EBV (-)
– Hémocultures (-)
– Sérologie M.pneumoniae/C.pneumoniae (-)
• Aspi nasopharyngée
– Virus respi (-), PCR Mycoplasma (-)
• ECBC/BK crachats/crachat induit (-)
…Next ?
•FB + LBA
– Quels examens demandés ?
• Anapath
• Bactério/BK
•Viro
• Myco /Parasito: PCR pneumocystis
• Ag galactomannan ?
Et alors ?
Nous sommes vendredi et la FB ne sera pas faisable
avant lundi, le néphrologue vous demande s’il y a
quelque chose à faire avant les résultats du LBA qu’on
aura donc mercredi …
1. Surveillance, on n’instaure pas de traitement, ça
risquerai de négativer le LBA
2. Traitement probabiliste par antibacteriens (préciser)
3. Traitement probabiliste par Bactrim
4. Traitement probabiliste par antiviral (préciser)
5. Traitement probabiliste par antifongique (préciser)
6. Traitement par corticoïdes
Fin mot de l’histoire
• LBA : 700 000 cell, 50% lymphocytes
•PCR pneumocystis +
• Traitement par BACTRIM 12A/jour
+ corticoides 1 mg/kg (PaO2 < 70 mmHg) à
instaurer le vendredi
La PCR pneumocystis ne se négative pas
en 3 j de ttt !
Cas clinique 2
• M. B 53 ans J21 chimio induction LAM 2
• Sortie récente d’aplasie
• Fièvre 40°C depuis 5 jours, persistante
sous antibiothérapie large spectre
(Tienam/Vanco)
• Dyspnée d’aggravation progressive
• FR=30/min, SaO2=88% sous O2 4L/min
Examens complémentaires
•Sang
– NFS: GB 2200/mm3 dont 1000 PNN, 780 L, Hb 10.5 g/dl,
plq 50 000/mm3, LDH 600 UI/L, CRP 300 mg/l
– PCR CMV (-), PCR EBV (-)
– Ag galactomannan < 0.5
– Hémocultures (-)
– Sérologie M.pneumoniae/C.pneumoniae (-)
• Aspi nasopharyngée
– PCR Mycoplasma (-), Virus respi (+): Metapneumovirus
• ECBC/BK crachats/crachat induit (-)
…Next ?
• FB + LBA ?
– Quels examens demandés ?
• Anapath
• Bactério/BK
•Viro
• Myco /Parasito: PCR pneumocystis
• Ag galactomannan ?
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%