Télécharger votre cours

CHIMIE
ETUDE DE LA REACTION
D’ESTERIFICATION
Partie A : Estérification
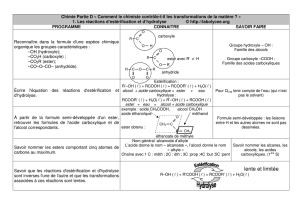
1) Equation de la réaction
L'estérification est la réaction qui permet d'obtenir un ester.
On peut, pour cela faire réagir un acide carboxylique R—COOH avec un alcool R'—OH.
Cette réaction conduit à un ester R—COO—R' et de l'eau H2O suivant l'équation ci-dessous :
OH H2O
OH
Remarque : Dans la réaction d’estérification le catalyseur est le plus souvent l’acide sulfurique ( H2SO4 )
2) Propriétés de la réactions d'estérification
Cette réaction est:
Lente :( donc on peut suivre son évolution au cours du temps )
limitée par sa réaction inverse ( la réaction inverse est appelée hydrolyse )
athermique :Elles ne nécessitent pas d'apport d'énergie thermique (chaleur) pour se produire
et ne dégagent pas d'énergie thermique. Ce qui ne signifie pas qu'un apport
d'énergie thermique soit sans effet sur ces transformations
3) Méthode expérimentale permettant de suivre l'évolution de la réaction d’estérification
Pour suivre l'évolution de ces transformations on dose à des dates t différents l'acide présent dans le
milieu réactionnel (voir le TP l'estérification ).

La connaissance des quantités de matière d'acide à l’instant initiale ( n0 ) et aux instants t > 0 ( nac =n0 – x )
permet de déterminer le taux d'avancement de la réaction à tout instant Soit τ = 𝒙
𝒙𝒎
= 𝒏𝟎−𝒏𝒂𝒄
𝒏𝟎
On donne le tableau descriptif de la réaction d’estérification Courbe de τ =f(t) est donné ci-dessous.
4) Etat d'équilibre
a- Point de vue cinétique
L'état d'équilibre est la situation pour laquelle la vitesse de la réaction d'estérification est la même
que la vitesse de la réaction inverse.( l’hydrolyse de l’ester )
Les quatre espèces (acide, alcool, ester et eau) coexistent.( on parle ainsi d’un équilibre dynamique)
b- Fonction des concentrations Π et constante d'équilibre K
Puisque les 4 constituants se trouvent dans le même V
On remarquera que, dans ce cas particulier, l'eau figure dans les expressions de Π et de K.
Cela tient au fait que l'eau n'est pas considérée ici comme le solvant mais comme un simple produit de la R°
Partie B : Hydrolyse
L’hydrolyse est la réaction inverse de l’estérification et qui possède les mêmes propriétés que la réaction
d’estérification soit :
Π’ : la fonction des concentrations correspond à cette réaction Π’ = 𝟏
𝜫
K’ : La constante d’équilibre correspond à cette réaction K’ = 𝟏
𝑲
On donne ci-dessous le schéma de la réaction
De même les réactions d’hydrolyse sont lentes, limitée et athermique
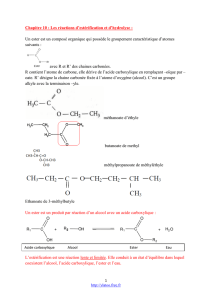
Équation de la réaction
RCOOH + ROH RCOOR' + H2O
E.initial x= 0
n0
n0
n(est)0=0
n(H2O)0=0
E.transitoire
l'avancement est x (mol)
n(ac)=n0-x
n(al)=n0-x
n(est)=x
n(H2O)=x
E.Final
l'avancement est xf (mol)
n(ac)f=n0-xf
n(al)=n0-xf
n(est)f=xf
n(H2O)f=xf
La fonction des concentrations s'écrit:
Π
=
[RCOOR'][H2O]
[RCOOH][R'OH]
La constante d'équilibre K s'écrit:
K
=
[RCOOR']éq[H2O]éq
[RCOOH]éq[R'OH]éq
ou encore:
K
=
n(RCOOR')éqn(H2O)éq
n(RCOOH)éqn(R'OH)éq

Soit la courbe ci-contre de nest = f( t )
Ces résultats sont obtenues Pour un mélange
équimolaire c'est-à-dire que les deux réactifs
ont le même nombre de moles
1er cas : courbe en rouge à t = 0 on a nacide = nalcool = 1mol
et à téq on a nest = neau = xf = 0,67 mol
2éme cas : courbe en vert ( à t = 0 on a nester = neau = 1mol
et à téq on a nacide = nalcool = xf = 0,67mol
L’alcool utilisé est de classe primaire
ATTENTION
1
/
3
100%